河北省130份西瓜品种与种质资源抗病基因KASP检测分析
2019-04-29张敬敬张海英潘秀清高秀瑞史宇凡党继革杨明珠武彦荣
张敬敬,张海英,潘秀清,许 勇,任 毅,高秀瑞,李 冰,史宇凡,党继革,杨明珠,武彦荣
(1.河北省农林科学院 经济作物研究所,河北 石家庄 050051;2.北京市农林科学院 蔬菜研究中心,北京 100097;3.河北双星种业股份有限公司,河北 石家庄 050061)
中国是世界上最大的西瓜种植国和消费国,每年的西瓜产量约7×103万t[1],河北省西瓜种植面积基本维持在6.67万hm2,居全国第5位[2]。由于西瓜经济效益高,生产区连年种植,连作障碍日益严重,造成西瓜枯萎病、炭疽病和白粉病等病害多发和重发,显著降低了西瓜产量和品质,因此,选育优质单抗或多抗西瓜品种仍是河北省的重要目标。
由于常规育种具有操作简单、选择性状综合全面等优势,目前仍是育种的主要方法,但常规育种易受环境和育种者的经验影响,存在育种周期长、效率低等缺点[3],尤其是田间抗病鉴定复杂,而多抗鉴定更难。近年来,随着高通量测序技术的发展,由LGC公司研发的竞争性等位基因特异性PCR技术即KASP技术具有高度稳定性、准确性和高效性,逐渐被用于重要功能基因的SNPs和InDels检测和重要性状标记[4-8],采用高通量分型KASP标记技术可同时鉴定多种病害,可加快西瓜抗病性育种步伐。
本试验针对河北省西瓜枯萎病、白粉病和炭疽病等病害发生严重,生产中抗病西瓜品种缺乏等突出问题,利用许勇团队开发的西瓜抗枯萎病、抗炭疽病和抗白粉病分子标记,对河北省130份西瓜品种和资源进行抗病性状功能基因的KASP标记检测,为准确评价西瓜品种和资源提供参考,以进一步提高河北省西瓜育种效率。
1 材料和方法
1.1 试验材料
以河北省近年来审(鉴)定西瓜品种和优势组合(星研七号、美佳、美胜、贵妃、17-11等)以及优异种质资源共130份为试验材料(表1),以3抗302为抗病基因分子检测的抗病对照,以GBZG为感病基因分子检测的感病对照。
1.2 DNA的提取及检测
取西瓜种芽放入加有钢珠的2 mL离心管中,每个材料3次重复,采用CTAB法提取DNA(向样品中加入100 μL CTAB,用组织打碎仪将种芽打碎后用离心机离心1 min(1 000 r/min),加入400 μL CTAB后65 ℃水浴加热30 min,加入三氯甲烷+异戊醇(24∶1)400 μL,4 ℃放置5 min,离心10 min(2 500 r/min)后取其上清液加入400 μL异丙醇,放入-20 ℃冰箱至少30 min,从冰箱取出后离心10 min(2 500 r/min),将上清液倒出,向沉淀物中加入70%酒精100 μL,离心5 min(2 500 r/min),倒出上清液,将沉淀物放入通风橱风干,加入50 μL ddH2O,放入-20 ℃冰箱备用),使用Thermo 公司生产的超微量分光光度计检测DNA浓度。
1.3 KASP标记检测
根据许勇团队开发的西瓜抗枯萎病、抗炭疽病、抗白粉病分子标记序列和上海生工生物工程(上海)股份有限公司合成的抗枯萎病、抗炭疽病、抗白粉病基因的KASP标记引物,使用LGC公司生产的KASP 平台检测。PCR反应体系为7.32 μL,包括1.5 μL DNA(2~10 ng/μL),4.32 μL Master Mix,1.5 μL KASP Assay Mix。PCR反应程序:94 ℃预变性15 min;94 ℃ 20 s,61 ℃ 1 min,10个循环;94 ℃ 20 s,55 ℃ 1 min,26个循环。反应结束后荧光扫描,并进行基因分型分析。
1.4 西瓜苗期接种枯萎病、炭疽病、白粉病病菌试验
西瓜枯萎病病菌生理小种、炭疽病病菌生理小种、白粉病病菌生理小种由北京市蔬菜工程中心许勇团队惠赠,试验于2018年10月在河北省农林科学院经济作物研究所智能温室中进行。
将130份试验材料和抗病对照、感病对照于55 ℃温汤浸种6 h后放置30 ℃恒温箱中培养24 h,取出发芽整齐的种子播种至已灭菌的育苗基质中,覆蛭石浇水盖膜保湿。
浸根接种枯萎病病菌:每份西瓜材料子叶展平期选取生长一致的幼苗30株,用清水洗净根系,在浓度为106个/mL分生孢子悬浮液中浸根15 min,接种后将瓜苗移栽至灭菌的基质中,放在28 ℃环境中生长,3 d后调查枯萎病发病情况。西瓜枯萎病抗性标准、等级划分和病情指数计算参照姬万丽等[9]试验方法。
喷雾法接种炭疽病病菌:西瓜幼苗长至2片真叶时,采用喷雾法于傍晚将浓度为106个/mL分生孢子悬浮液接种至西瓜叶片,每份材料接种30株,接种7 d后调查发病情况。参照崔召明等[10]方法的抗性标准、等级划分和病情指数进行划分和计算。
喷雾法接种白粉病病菌:于子叶展平期接种,用喷雾器将孢子悬浮液喷到叶片表面,每份西瓜材料接种30株。接种后保持温度28 ℃/20 ℃(日/夜),相对湿度约70%,接种12~15 d充分发病后,参照徐向丽等[11]方法计算病情指数。
2 结果与分析
2.1 西瓜种芽DNA质量浓度的检测结果
使用Thermo公司生产的超微量分光光度计检测提取好的西瓜种芽DNA浓度,用ddH2O稀释使DNA质量浓度在2~10 ng/μL。
2.2 西瓜抗枯萎病、炭疽病、白粉病的KASP检测结果和苗期接种结果
本研究根据许勇团队提供的西瓜抗病分子标记,利用高通量KASP对河北省130份西瓜参试材料进行了抗枯萎病、抗炭疽病和抗白粉病性状基因的KASP检测,为验证KASP引物的特异性及准确性,选取抗病材料3抗302和感病材料GBZG,检测结果见图1。由图1可知,KASP标记检测技术可以清晰地把上述抗病的2种基因型分开,三角形为抗病的纯合型材料,五角星为感病的纯合型材料,正方形为携带等位变异的杂合型材料,圆形为未检出。
本试验共检测了3个抗病基因,包括抗枯萎病基因(Fon-1)、抗炭疽病基因(AR1)、抗白粉病基因(PM1)。结果显示,Fon-1在供试材料中所占比例最大,有33份,占供试材料的25.38%,AR1在供试材料中有19份,占比14.62%,PM1在供试材料中有7份,占比5.38%,Fon-1和AR1同时在供试材料中有5份,AR1和PM1同时在供试材料中有1份,3种抗病基因同时在供试材料中有1份(表1、图2)。
苗期接种试验结果表明,130份供试材料抗枯萎病材料33份,其中中抗材料17份包括美胜、花早绿、贵妃等,轻抗材料16份包括0405-3、S67-M、S68-M等;抗炭疽病材料19份,中抗材料13份包括星研七号、双星37、S67-M等,轻抗材料6份包括S64-M、SJL、力母等;抗白粉材料7份包括美佳、S66、901新等,中间类型材料23份包括ZH、S68-M、NDL等,苗期鉴定结果与KASP检测结果相一致,均可为西瓜抗病育种提供参考。
根据KASP对西瓜抗病性状基因的检测结果,比对供试西瓜材料田间表现,抗枯萎病如贵妃、美胜、三白西瓜、花早绿、0412、0419等材料,此类型材料多晚熟,田间表现出生长势强,后期不衰秧,西瓜品质中等偏上的特点;抗炭疽病如星研七号、双星37、JB-1、LGZ、力母、力父等材料,此类型多晚熟,生长势强,瓜的类型较多,品质中等偏上,四倍体材料多属于这类;抗白粉病如美佳、901细花红、901新、S66等材料,此类型与小果型西瓜有血缘关系的居多,具体表现生长势中等,分枝性中等,果实品质较好;同时抗枯萎病和抗炭疽病2种病害材料包括F35板叶、S64-M、S67-M、0405-3、0406,此类型为中果型瓜,熟性较晚,生长势强,不衰秧;同时抗炭疽病和抗白粉病2种病害材料LGZ,该材料为小果型瓜、长势中庸、分枝性中等、叶片稀疏、较小、品质好;同时抗枯萎病、抗炭疽病和抗白粉病材料3种病害材料JB-3,田间表现为生长势较强,不衰秧,单瓜质量3~4 kg,浅黄底色上有深黄色花条、圆瓜、红瓤、质地沙,中心和边缘可溶性固形物含量分别为10.5%和7.8%。上述材料在西瓜抗性育种中具有较大应用潜力,尤其是同时抗上述3种病害材料JB-3,可进一步加强对该材料的利用。
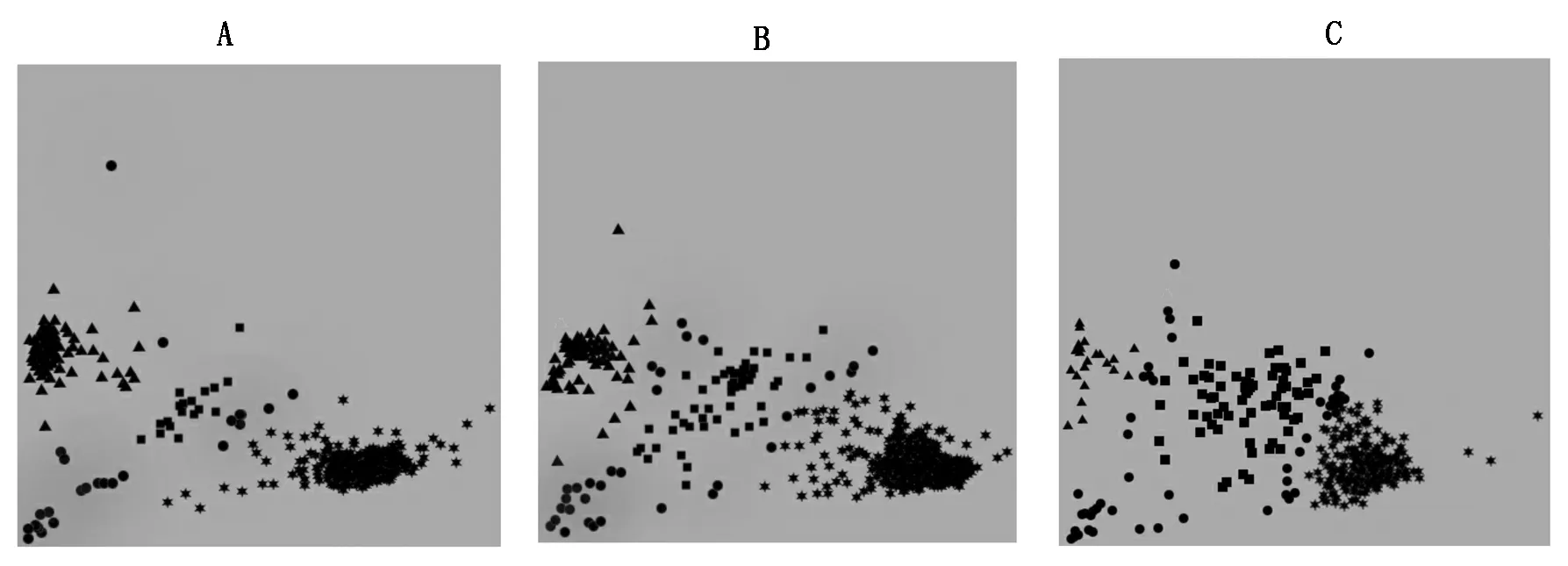
三角形.纯合型基因抗病;五角星.纯合型基因感病;正方形.杂合型基因;圆形.未检出;A.枯萎病基因的KASP标记;B.炭疽病基因的KASP标记;C.白粉病基因的KASP标记。Triangle.Homozygous resistance gene; Pentagram.Homozygous susceptible gene; Square.Hoterozygous gene; Roundness.Not detected; A.KASP marker of Fusarium wilt gene; B.KASP marker of anthracnose gene; C.KASP marker of powdery mildew gene.

材料名称Materialsname枯萎病Fusarium Wilt白粉病Powdery mildew炭疽病AnthracnoseKASP检测苗期接种KASP检测苗期接种KASP检测苗期接种材料名称Materialsname枯萎病Fusarium Wilt白粉病Powdery mildew炭疽病AnthracnoseKASP检测苗期接种KASP检测苗期接种KASP检测苗期接种3抗302 3 kang 302R15.1HRR34.2RR6.2HR0414-1-1S90.2SS76.6SS68.3SGBZGS94.7SS79.7SS67.1S丰抗 FengkangS94.6SS77.5SR23.4MRS56-1S84.3SS78.3SR22.4MR0405-3R52.7LRS67.9SR20.9MRS57-1H80.5SS70.2SS60.8S美胜 MeishengR39.6MRS63.7SS64.3SS63-MH83.7SS86.5SS63.5S0423-1R41.7MRS73.2SS69.9SS64-MR52.1LRS83.4SR39.7LR西农椭 XinongtuoR44.7MRS70.0SS66.1S美佳 MeijiaS86.3SR21.1RS62.8SF35板叶 F35 banyeR38.9MRS67.6SR26.9MRS66S85.4SR30.4RS65.1S黄肉 HuangrouS92.4SS70.6SS76.5SS67-MR61.8LRS80.9SR24.2MRJB-1S95.5SH46.0MR22.7MRS68-MR67.4LRH56.0MS64.3SJB-3R40.1MRR26.8RR20.1MRS69-MR58.2LRS79.4SS61.9S双星37 Shuangxing 37S86.1SS65.5SR18.9MRS70-MS90.8SS80.4SR20.8MRSJLR62.3LRS80.9SR39.2LRS71-MS95.2SS88.2SR18.6MRBLJM-1R53.3LRN49.2MS85.4SS72-MR60.6LRS71.9SS67.6SXC-1S96.1SS68.9SS88.9SS73-MS90.2SH48.1MH57.9S富士 FushiS90.3SS73.1SS90.0SS74-MS88.9SH53.3MN59.1SLXMN83.4SN43.7MN56.8SS80-MS96.1SN56.7MN58.5S(901)6-1-MN81.6SN56.6MN57.4SS85S95.7SS66.9SR25.3MRLDS95.3SS70.2SS90.1SS75R56.8LRS63.5SS60.9S花早F2-4 Huazao F2-4S94.4SS63.7SS63.3S秀丽F2-1-2 Xiuli F2-1-2S93.7SS67.1SS62.8SLYLR66.1LRS66.4SS70.6S全霜99F2-1-1Quanshuang 99F2-1-1S97.1SS72.4SS70.9S日引1-3-1-3Riyin 1-3-1-3R39.5MRS63.9SS65.6SBSH-1-1-1-2S88.9SS80.9SH59.7S花早绿 HuazaolüR38.4MRS61.5SS60.2S901新901xinS85.0SR20.5RS72.5S三白西瓜Three white watermelonR37.7MRS65.9SS64.3S日引1-3-1-2Riyin 1-3-1-2R39.7MRS72.3SS71.8SKB1MR65.6LRS74.6SS86.7SS84-1-MS96.8SH56.7MS77.3SKB2MR61.1LRS72.3SS88.7SS65S95.7SH49.6MS70.4SKBFS89.7SN57.9MS84.3贵妃 GuifeiR37.5MRS80.3SS75.1STZ6R51.7LRS68.8SS86.5S43451S88.7SH57.3MS72.3S农大S7 Nongda S7N82.5SN55.1MN59.1S903R42.5MRS76.6SS74.6S西农F1-2-MR40.6MRN56.3MS56.7S Xinong F1-2-M早系1-1 Zaoxi 1-1S90.4SS82.1SS68.4S0402N83.1SH47.7MH60.7SNDLR56.9LRH45.5MS59.8S0403R40.9MRS74.9SS79.6S88-2-2-5S93.4SR23.9RS67.5S星研七号 Xingyan No.7S88.8SS83.1SR22.6MR花早 HuazaoS90.6SH46.1MS65.9S0408S93.4SS80.2SR36.4LRXC2-1S89.1SN49.9MN59.9S901细花红 901 xihuahongS90.5SR33.4RS60.3SZY10S85.4SS86.3SH56.6S0410R46.1MRS61.8SS75.4SZHN85.2SH54.2MN60.1S0412R44.4MRH56.6MS72.5SW89S96.9SH53.8MR35.6LR0415S93.7SS70.7SH60.4S力母 LimuS92.1SS82.5SR35.1LR0419R46.7MRS71.9SS70.0S力父 LifuS92.4SS73.3SR32.7MR0420S95.6SS73.2SS69.8SLGZS95.7SR36.6RR40.5LR0422S94.9SS66.6SS73.6S0418-3-1S97.6SS64.9SN58.3S0424R65.3LRS68.4SS68.4SCXF-2-5S94.4SS69.9SS70.3S0425S94.5SS69.1SS72.1S小天使 XiaotianshiS90.2SS75.5SH60.8S齐抗 QikangR42.8MRS76.0SS63.8S
注:R.抗病;S.感病;H.杂合位点抗病;N.未检测出;HR.高抗;MR.中抗;LR.轻抗;M.中间类型。
Note: R.Resistant; S.Susceptible; H.Resistant at heterozygous sites; N.Not detected; HR.High resistant; MR.Middle resistant; LR.Light resistant; M.Middle style.
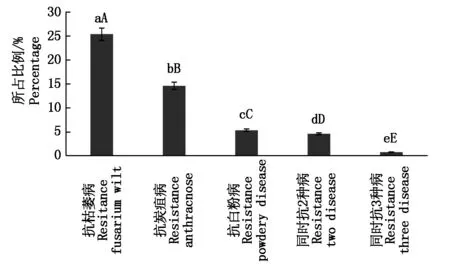
图2 西瓜抗病占比Fig.2 Disease resistance rate of watermelon
2.3 以KASP检测结果为基础的聚类分析
以抗枯萎病、抗炭疽病、抗白粉病KASP检测结果显示抗病、感病、杂合抗性和无检测信号4种结果为依据,将130份西瓜材料与抗病对照、感病对照分为4大类群(图3)。第1类有12份材料,为不抗白粉病材料,其中7份为感枯萎病材料,5份为抗枯萎病且感炭疽病材料;第2类有67份材料,为抗白粉病或同时感2种病害材料,其中7份材料抗白粉病,60份为同时感2种病害材料;第3类有38份材料,为枯萎病、炭疽病单抗或多抗材料,其中11份为单抗炭疽病材料,5份为同时抗炭疽病、抗白粉病材料,22份为单抗枯萎病材料;第4类有13份材料,在抗枯萎病、抗炭疽病或抗白粉病基因方面均无检测信号或杂合抗性,其中2份为感枯萎病且在抗白粉病和抗炭疽病基因处无检测信号,6份为感枯萎病且在抗白粉病或抗炭疽病基因处无检测信号或杂合抗性,5份为抗枯萎病、抗白粉病和抗炭疽病基因处均无纯合基因检出。
3 结论与讨论
3.1 抗病性检测分析及高通量分子检测应用
植物分子抗病性检测方法被广泛应用,如西瓜枯萎病检测方法中曹月霞等[12]建立了双重PCR检测体系,通过设计和应用引物Fon-2R/Fon-2F、Fon-3R/Fon-3F、Fon-4R/Fon-4F和Fon-6R/Fon-6F,采用电泳方法能检测出西瓜枯萎病菌。西瓜炭疽病检测中唐建辉等[13]利用2对引物CY1/CY2和SCAR 引物RB/RC组成双重 PCR 检测体系,并且能够直接在植物组织中将西瓜炭疽菌 (C.orbiculare) 检测出来。刘易科等[14]选用52个小麦抗赤霉病、条锈病、白粉病和纹枯病的基因(QTL)的功能标记或连锁标记对其进行分子鉴定和分析。本试验利用许勇团队研究的西瓜抗枯萎病[15]、抗炭疽病、抗白粉病[16]分子标记和KASP分型标记对130份西瓜材料进行抗病性分型检测,KASP标记具有快速、高效的特点。

图3 西瓜KASP结果聚类分析Fig.3 Analysis diagram of watermelon KASP results
徐平丽等[17]利用TaqMan 探针标记与 KASP 分子标记鉴别花生后代籽粒AhFAD2B基因的基因型,进而选育高油酸花生品种,大大减少了田间选择的工作量,提高了回交选育高油酸花生的效率;赵勇等[5]采用测序法、酶切扩增多态性序列法(CAPS)和竞争性等位基因特异性 PCR (KASP)法对大豆Dt1基因的4个 SNP 进行分型,结果表明,KASP 法准确率达94.3%,同时KASP具有快速、高效的特点;杨子博等[6]为了解江苏淮北地区小麦品种资源的籽粒硬度概况及硬度基因型分布规律,以74份近年来江苏淮北地区所育品种(系)和38份来自黄淮其他麦区的常用亲本为材料,采用单籽粒谷物硬度测试仪、KASP标记检测技术和基因扩增及测序技术对其SKCS硬度值及硬度基因型进行鉴定。张宏军等[18]利用小麦抗赤霉病Fhb1基因的 KASP 标记在回交后代中进行基因型分析,分别选择携带和不携带Fhb1基因的可育株, 对后代株系进行单花滴注接种鉴定和田间病圃自然鉴定,利用Fhb1基因分子标记辅助选择技术能够有效地提高黄淮冬麦区小麦品种的赤霉病抗性水平。Awais Rasheed[19]开发并鉴定了一批与普通小麦适应性、产量、品质、生物和非生物胁迫抗性相关的KASP标记,研究表明,KASP标记的检测效率是基于凝胶的传统PCR标记的45倍。目前,KASP标记已发展为一种单基因高通量基因型检测技术,本试验利用西瓜抗枯萎病基因Fon-1、抗炭疽病基因AR1、抗白粉病基因PM1的KASP标记,对130份材料进行基因型分析,分为纯合位点抗病、杂合位点抗病、纯合位点感病和未检出,与室内接种结果相一致,该方法可作为高通量SNP标记的补充,有效促进杂交亲本和高代品系的鉴定,提高西瓜育种效率。
3.2 聚类分析及以KASP为基础的聚类分析应用
聚类分析方法在作物育种中应用广泛。金凤媚等[20]通过测定番茄品质特性的遗传多样性和分子标记的多态性,对番茄品种资源进行了聚类分析,聚类分析是鉴别品种资源遗传差异程度、筛选核心资源的有效手段。刘亚利等[21]以5个玉米自交系为测验种,按NCⅡ遗传交配设计配制55个测交组合,进行产量配合力效应及聚类分析。根据产量SCA进行聚类分析,可将16个自交系分为5类。杨志刚等[22]以92份辣椒资源为材料,分别对辣椒色价值和辣椒单果质量、果肉厚、果实纵横径进行聚类分析,从中筛选干制红辣椒的优良种质材料。前人采用聚类分析法对番茄[20]、辣椒[22]、玉米[21]等作物进行分类,本试验基于西瓜抗枯萎病、炭疽病和白粉病的KASP检测结果,采用Ward离差平方和法对西瓜进行抗病性差异聚类分析,把130份材料分为4类,第1类有12份材料,为不抗白粉病材料;第2类有67份材料,为抗白粉病或同时感2种病害材料;第3类有38份材料,为枯萎病或炭疽病单抗或多抗材料;第4类有13份材料,为不抗枯萎病、炭疽病和白粉病材料。利用KASP分子标记进行聚类分析,分类结果更加科学可靠, 对于鉴别种质资源具有指导意义。
3.3 KASP检测结果应用
高通量分型KASP标记检测西瓜抗病性与苗期抗病鉴定结果一致,该技术具有高速高效准确特点,未来可利用该技术加快育种进程。利用KASP分子标记筛选出的同时抗3种病害的材料JB-3,田间表现生长势较强,不衰秧,单瓜质量3~4 kg,中心和边缘可溶性固形物含量分别为10.5%和7.8%。该材料在果实品质、耐低温弱光方面表现不理想,但由于JB-3可同时抗枯萎病、抗炭疽病和抗白粉病,未来可通过回交转育、定向选育方法培育出优质多抗西瓜新品种。
