不同PCR程序对甜菜DAMD引物扩增效果的影响
2019-04-28闫彩燕吴则东兴旺邳植
闫彩燕 ,吴则东 ,兴旺 ,邳植
(1.黑龙江省普通高等学校甜菜遗传育种重点实验室,哈尔滨150080;2.中国农业科学院甜菜研究所/黑龙江大学农作物研究院,哈尔滨 150080;3.黑龙江省甜菜工程技术研究中心,哈尔滨 150080)
0 引言
我国甜菜遗传育种等研究采用常规手段取得了一定进展[1],但甜菜分子标记的开发与利用落后于玉米、大豆、水稻、棉花等主要农作物。近些年,分子标记技术已逐步应用到了甜菜种质资源评价和辅助育种等多个方面。诸如,遗传图谱和指纹图谱的构建[2-4]、遗传多样性的评估[5-6]、亲缘关系及基因流动[7-8]的评价等。
小卫星区域DNA直接扩增(direct amplification ofminisatellite DNA by PCR,简称DAMD-PCR),1993年首次由Health等[9]提出,即以小卫星的核心序列为引物直接进行PCR扩增的一种技术。目前,DAMD-PCR技术已经应用于多种作物进行相关的研究。胡建斌等[10]建立了黄瓜的DAMD反应体系,并且只利用3条DAMD引物就可以将20份黄瓜材料进行分辨;Métais等人[11]评价了DAMD-PCR与ISSR、RAPD、RFLP以及AFLP等在菜豆的遗传多样性方面的差异,结果表明DAMD-PCR的多态性水平能够达到40%,由于DAMD-PCR扩增的位点数量较少,因此单独应用DAMD-PCR检测栽培豆科间遗传变异的能力有限;王掌军等[12]利用引物YNZ22一次就鉴别了21个甜瓜品种;Ince等[13]开发了辣椒的DAMD-PCR引物;Karaca等[14]利用DAMDPCR对鼠尾草进行了基因分型。目前DAMD-PCR在甜菜上应用却不多,兴旺等[15]、孙燕红等[16]已经初步建立了甜菜DAMD的PCR优化体系,用聚丙烯酰胺凝胶电泳比琼脂糖凝胶电泳的检测具有制作方便、检测简单等优点,但尚未对甜菜DAMD的应用进行深入的研究。利用DAMD-PCR等分子标记技术进行甜菜品种鉴定的工作仍然较少,针对甜菜品种鉴定的高效鉴定引物仍有待开发,相应的检测技术流程仍有待优化。本实验分析两种不同的扩增程序对甜菜DAMD-PCR扩增产物的影响。并对其结果进行了比较分析,从而确定了更适合于甜菜DAMD-PCR引物扩增的程序,以便使DAMD-PCR在甜菜上得到更好的应用。
1 材料与方法
1.1 实验材料
①实验材料:实验中用到的品种均来自国外种子公司,种子的品种名称及编号见表1。
②引物:实验中选用的引物均来源于相关文献,引物名称及序列见表2。

表1 本实验选用的甜菜品种名称及其编号Table 1 Name and number of sugar beet varieties selected in this experiment
1.2 实验方法
1.2.1 DNA提取
将甜菜种子播种于营养钵内,在昼夜温度 25 ℃,光照 280 μmol/(m2·s),光周期 14 h/10 h的培养室中发芽。待幼苗长至4~5片真叶时,将叶片和下胚轴一同取下,采用改良CTAB法[17]提取基因组DNA,利用核酸蛋白测定仪检测提取的DNA浓度和纯度。最后,将提取的DNA稀释至10 ng/μL,待用。
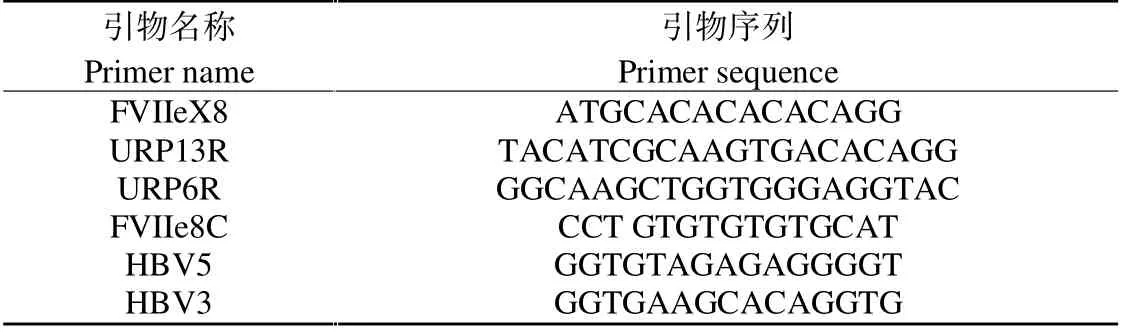
表2 实验中用到的引物名称及其序列Table 2 Primer names and their sequences used in the experiment
1.2.2 PCR程序
常规PCR程序:94℃预变性3min;随后35个循环,94℃变性30 s,55℃退火30 s,72℃延伸30 s;最后72℃延伸5min。
降落 PCR(touchdown PCR,简称 TD-PCR)程序:94℃预变性 3 min;94℃变性 15 s,退火 15 s,72℃延伸30 s,20个循环,退火温度从65~55℃,每降一度两个循环;之后25个循环,退火温度保持55℃;最后72℃延伸5min。
1.2.3 聚丙烯酰胺凝胶检测
采用8%的非变性聚丙烯酰胺凝胶电泳对扩增的产物进行分离。采用快速银染法[18]进行染色。显影结束后进行拍照记录。
2 结果与分析
常规PCR扩增程序和touchdown PCR程序扩增结果,见图1和图2。从图1和图2的对比可清楚地看出,6个引物在不同的退火温度下均扩增出了条带,但常规程序扩增的非特异带较多,不易于识别。相反,相对于常规PCR而言,touchdown PCR电泳结果条带明亮、清晰,没有弥散条带[19]。这6条DAMD引物均表现出了较好的多态性,每种引物以8个品种DNA为模板均扩增出了不同的带型,暗示单独利用这8个引物中的任意一种均能够鉴别出这8个品种。

图1 常规PCR程序甜菜DAMD扩增产物的结果Fig.1 Results of beet DAMD am plification by conventional PCR
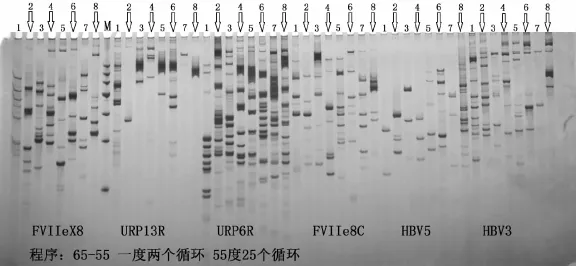
图1 TD-PCR程序甜菜DAMD扩增产物的结果Fig.1 Results of beet DAMD amp lification by TD-PCR
在常规PCR程序扩增条件下,使用FCIIeX8、URP6R、FVIIe8C、HBV5和HBV3引物扩增出的条带较多。其中,URP6R和FVIIe8C扩增的条带数目最多,条带数量在20个左右。FCIIeX8、HBV5和HBV3扩增的条带数量次之,条带数量为10~15个。URP6R扩增的条带数目最少,在常规PCR程序扩增时仅有2~4个条带。与常规PCR程序相比,touchdown PCR程序有助于提高特异性条带丰度。尤其是在使用URP13R引物进行扩增时,品种1~6均有新的特异性条带出现。其他引物对特异性条带的扩增效率也有不同程度的提高。使用touchdown PCR程序还有助于减少非特异条带数量。在使用URP6R、FVIIe8C和HBV5引物对6个品种进行检测时,与常规PCR程序相比非特异性条带数量明显减少。
3 讨论
TD-PCR是1991年由Don R H等人[20]提出,其基本原理是设计一系列从高到低的退火温度,设计的最高退火温度高于引物的Tm值,伴随着循环的进行,退火温度会降到与Tm值相同的温度,这样就确保了引物和模板的第一次杂交事件发生在最互补的反应物之间,伴随着退火温度的降低,虽然最终退火温度低于引物的Tm值,但是由于特异性的反应底物占据优势,因此最终产物仍然是以特异性产物为主[21]。TD-PCR可在不确定退火温度的情况下扩增出较为理想的条带[22]。Xiong等[23]在花生的DAMD扩增体系中将退火温度设定为50℃;Misra等[24]在苜蓿的DAMD扩增体系中设定退火温度为50℃;Bhattacharyya等[25]在金钗石斛的DAMD扩增体系中则设定退火温度为54℃;而本实验中即使将这些引物的退火温度提高到55℃,仍然产生了很多非特异性扩增的条带,说明不同的引物在不同作物上的使用退火温度会有所不同。本文通过利用touchdown PCR对6个不同DAMD-PCR引物进行扩增,均获得了理想的条带,说明在不确定引物退火温度的情况下或者同时扩增多个不同退火温度的引物时,可以采用TD-PCR程序将退火温度从高到低进行降落,从而达到获得较为理想扩增结果的目的。
