高效液相色谱测定咯菌腈在葡萄和土壤中的残留行为
2019-04-26孙明娜汪楚依高同春段劲生
孙明娜,汪楚依,王 梅,董 旭,童 舟,褚 玥,高同春*,段劲生*
(1.安徽省农业科学院植物保护与农产品质量安全研究所/农业农村部农产品质量安全风险评估实验室(合肥),安徽 合肥230031;2.安徽农业大学植物保护学院,安徽 合肥230036)
咯菌腈(fludioxonil),商品名为适乐时(Celeste025FS),化学名称为4-(2.2-二氟-1.3-苯并二氧杂环戊烯-4-基)吡咯-3-腈[1],是由先正达公司开发的的新型非内吸型苯基吡咯类广谱杀菌剂,它高效、安全,既可用作叶面杀菌剂,用于防治雪腐镰孢菌、小麦网腥黑腐菌、立枯病菌等,对灰霉病有特效;也可用作种子处理剂,主要用于防治谷物和非谷物类作物中的种传和土传病菌[2]。它兼具杀菌和抑菌作用[3],其作用机理是通过抑制与葡萄糖磷酰化有关的转运来抑制菌丝生长,最终导致病菌的死亡[4]。它用于种子处理,可防治种子带菌及土壤传播的真菌病害。其作用机理独特,持效期长,且不与其他杀菌剂发生交互抗性,属触杀型杀菌剂[5]。
葡萄病虫害的防治主要以化学防治为主,但在实际的生产中,由于有些性质稳定、不易分解的农药品种,或者不科学的使用农药就会造成过高的农药残留量[6],对非靶标生物造成健康危害,从而威胁到人类的身体健康和生存环境[7]。近几年来,高效农药品种不断出现,农药在农产品和环境中的残留非常低,就促使我们发展更加有针对性的检测方法[8],查阅现有文献,目前国内外对于咯菌腈的主要检测方法是应用气相色谱法(GC)[9]、气相色谱质谱法(GC-MS)[10]、也有研究报道使用高效液相色谱法(HPLC)[11]进行检测分析的,但是到目前为止,国内单独对咯菌腈在葡萄上的残留分析报道很少,国外大多是复配后的分析报道,大多是在其它基质上的分析。本试验建立了咯菌腈在葡萄和土壤中的残留检测的高效液相色谱方法,以期为葡萄中咯菌腈的残留检测提供技术参考[12]。
1 材料与方法
1.1 仪器和试剂 咯菌腈标准品纯度99.4%(购自自上海市农药研究所有限公司);CNW弗罗里硅土SPE小柱,500mg/6mL;PSA粒径40~60um;C18粒径50um;乙腈、二氯甲烷、氯化钠、均为分析纯;甲醇为色谱纯。
安捷伦1200高效液相色谱仪;RotavaporR-100型旋转蒸发仪,瑞士步琪公司;N-EVAP24氮吹仪,美国Organomation仪器有限公司;高速万能粉碎机,北京市永光明医疗仪器有限公司;ZB-85气浴恒温振荡器,江苏金坛市中大仪器厂;FA2104S电子天平,上海天平仪器厂。
1.2 田间试验方法 实验于2016~2017年在萧县和辛集两地露天实验地进行,供试药剂为40%咯菌腈悬浮剂,供试葡萄品种在安徽萧县为巨玫瑰,在河北辛集为巨峰。
1.2.1 消解动态试验 葡萄消解动态:设3个重复小区,每小区面积30m2,至少有30穗以上葡萄。于果实成熟一半大时(盛花后约35d左右)施药1次,并做标记,施药剂量200mg a.i/kg(制剂2 000倍液)。于施药后2h和1、3、5、7、14、21、30d用随机方法在试验小区内不同位置及上下不同部位采集6~12串(2kg以上)施药时确已着药、生长正常、无病害的葡萄果实。
土壤消解动态:选一30m2空白平整无植被土地,以200mg a.i/kg(制剂2 000倍液)的施药浓度,按照当地一亩葡萄园喷药的用水量换算出30m2土壤的用药量和兑水量,进行均匀喷雾,土壤样品每小区采集12点,消解动态试验取土深度0~10cm,采样量≥1kg。
1.2.2 最终残留试验 设2个施药剂量,分别为低剂量133.3mg a.i/kg(制剂3 000倍液)和高剂量200mg a.i/kg(制剂2 000倍液),于葡萄灰霉病发生初期田间喷雾,施药次数分别为3、4次,施药间隔期7d,每个处理设3个重复小区,每小区面积为30m2,小区之间设保护行,按照剂量由低到高的顺序,施药时应保持均速,使药液尽可能均匀地分布,不需要专门喷施土壤,并对着药果实采用系绳等方法进行标记,于最后1次施药后5、7、14d,采集成熟葡萄果实和土壤(0~15cm)样品。
1.2.3 葡萄果实和土壤的取样和处理 葡萄样品:将葡萄田间样本弃去病萄地表面。于施药后2h和1、3、5、7、14、21、30、45d采粒、残粒,除去果梗,混合均匀后,分取150g样品2份,按要求装入封口样品容器中,并按规定内容贴好标签。
土壤样品:过1mm孔径分样筛,混匀土样,四分法留取约150g样品2份。
所有样品均与-20℃下保存,备用。
1.3 分析步骤
1.3.1 葡萄样品前处理 称取20.0g打碎的葡萄样品于50mL离心管中,加入30mL二氯甲烷,机械振荡60min后静置5min,取15mL下层提取液浓缩近干,氮气吹干后加5mL甲醇/二氯甲烷(10∶90)溶解待净化。用5mL甲醇预淋弗罗里硅土小柱弃去,转移溶解液上柱,并用5mL×3甲醇:二氯甲烷(10∶90,V∶V)溶液洗脱,合并淋洗液15mL,浓缩近干,氮气吹干后用甲醇定容至5mL,过0.22μm滤膜液相待测。
1.3.2 土壤样品前处理 称取20.0g土壤样品于50mL离心管中,加入30mL乙腈(含0.1%甲酸),机械振荡60min,加入3g氯化钠,剧烈振荡1min后5 000r/min离心5min。取15mL上清液浓缩近干,氮气吹干后用5mL甲醇定容,移入装有75mgC18、75mgPSA的微型离心管中,涡旋1min后5 000r/min离心5min,取上清液过0.22μm滤膜待液相检测。
1.4 分析测定 检测条件:安捷伦1200HPLC(紫外检测器),流动相为乙腈:水=55∶45(V∶V),色谱柱:4.6mm×250mm,AgilentHC-C18柱;检测波长:260nm;流速:0.8mL/min;柱温:40℃;进样量10μL。
1.5 标准溶液的配置和标准曲线的绘制 准确称取咯菌腈标准品,用甲醇溶解并配置成1 000mg/L的标准储备液,将1 000mg/L咯菌腈标准溶液用甲醇稀释配得10、5、1、0.5、0.1、0.05mg/L系列标准溶液,在上述液相色谱条件下进行测定,其中y为咯菌腈峰面积,x为标准溶液浓度,以咯菌腈标准溶液浓度和测得的相应峰面积制作标准曲线。
1.6 添加回收试验 取未施用过咯菌腈的葡萄和土壤20.0g,进行添加回收试验,添加水平为0.05、0.1、0.5、1、5、10mg/L,每档重复5次。
2 结果与分析
2.1 方法的线性范围、回收率、精密度及检出限 结果表明:在0.05~10mg/L范围内,咯菌腈标准溶液浓度和测得的相应峰面积呈良好的线性关系,其标准线性方程为y=30.951x-0.417 1,相关系数为0.999 8。在0.02~2.0mg/kg添加水平下,咯菌腈在葡萄和土壤中的平均回收率分别为:89.0%~95.8%和88.2%~90.5%,相对标准偏差分别为:1.1%~7.1%和0.8%~6.4%。(表1和图1)咯菌腈在葡萄和土壤中的最小检出量为5×10-10g,最低检测浓度为0.02mg/kg,符合残留分析检测要求。

表1 咯菌腈在葡萄和土壤上的平均添加回收率和相对标准偏差
2.2 色谱条件的优化 由于咯菌腈标准溶液在260nm处有最大收峰,故选择260nm作为检测波长(图2)。分别以乙腈-水、甲醇-水不同比例作为流动相,综合考虑咯菌腈的保留时间及峰型,最终确定以V(乙腈)∶V(水)=55∶45,流速为0.8mL/min,柱温:40℃。咯菌腈标准溶液色谱图(图3)。在此检测条件下,仪器对咯菌腈的最小最小检出量为5×10-10g。
2.3 提取剂选择和提取条件的优化 根据咯菌腈的极性与溶解性,分别选用了二氯甲烷、乙腈、乙腈(1%甲酸)、石油醚、正己烷、乙酸乙酯为提取剂,同时分别采取超声、机械振荡等提取方式对比提取效果。结果表明:葡萄和土壤对不同提取剂的提取效果区别很大,其中石油醚、正己烷、乙酸乙酯在葡萄和土壤中的添加回收率均较低,而二氯甲烷、乙腈、乙腈(1%甲酸)在葡萄中的添加回收率分别为99.8%、89.5%和98.4%,在土壤中的添加回收率分别为85.0%、101.4%和99.2%。葡萄的提取剂在使用乙腈(1%甲酸)时,目标化合物相对保留时间处有杂峰干扰,经过对比最终选择二氯甲烷作为葡萄的提取剂,而乙腈和乙腈(1%甲酸)对土壤提取效果相差不大,而使用乙腈作为提取剂成本较低也相对环保,最终选择乙腈作为土壤的提取剂(表2)。此外,本试验还对超声提取和机械振荡2种提取方式进行了比较。结果发现(表3),机械振荡的提取效率最高,咯菌腈在葡萄和土壤中的平均回收率分别为87.4%和92.3%,明显优于超声提取的平均回收率67.1%和71.9%,故采用机械振荡作为葡萄和土壤提取方式。

a:葡萄空白(Blankgrape)b:葡萄添加(Grape)(0.2mg/kg) c:土壤空白(Blanksoil)d:土壤添加(Soil)(0.2mg/kg)图1 葡萄和土壤空白样品及添加回收色谱
图2 咯菌腈标准液检测波长
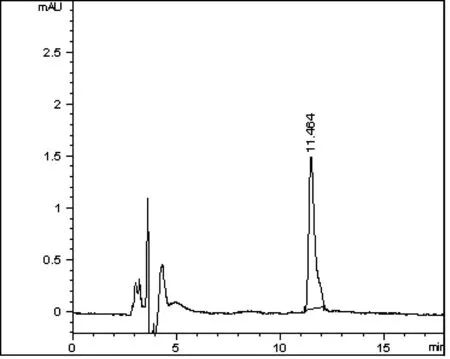
图3 咯菌腈标准溶液色谱图(1mg/L)
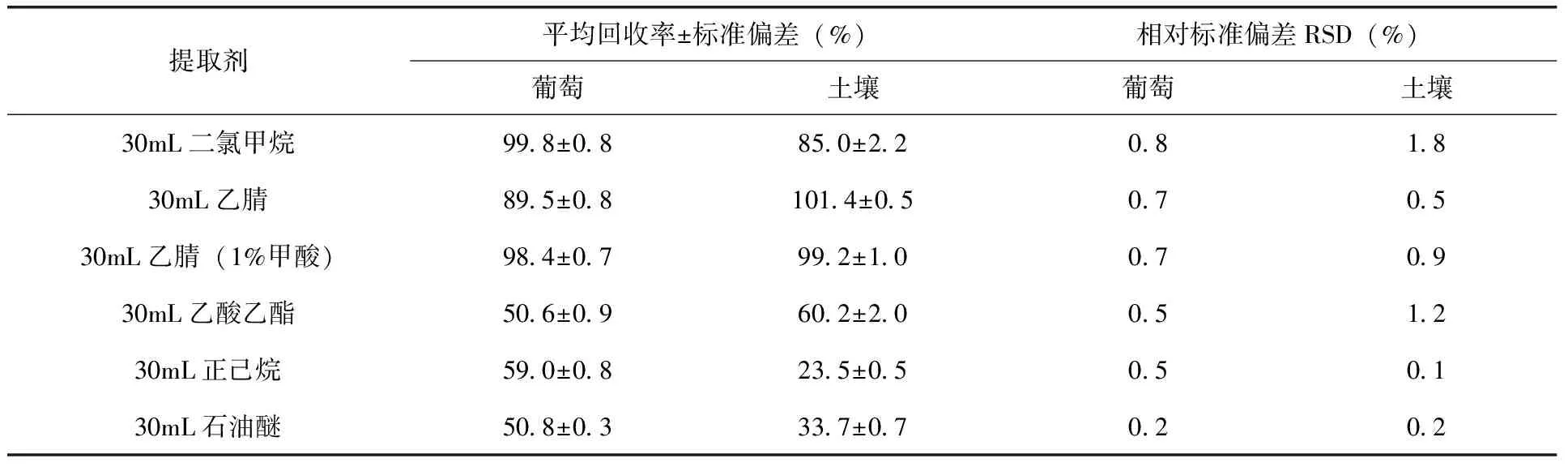
提取剂平均回收率±标准偏差(%)相对标准偏差RSD(%)葡萄土壤葡萄土壤30mL二氯甲烷99.8±0.885.0±2.20.81.830mL乙腈89.5±0.8101.4±0.50.70.530mL乙腈(1%甲酸)98.4±0.799.2±1.00.70.930mL乙酸乙酯50.6±0.960.2±2.00.51.230mL正己烷59.0±0.823.5±0.50.50.130mL石油醚50.8±0.333.7±0.70.20.2

表3 不同提取方式提取葡萄和土壤中咯菌腈的回收率
2.4 咯菌腈在葡萄上的消解动态 安徽萧县和河北辛集两年两地的消解试验结果显示:施药2h后,咯菌腈在2016年安徽萧县和河北辛集葡萄上的的原始沉积量分别为:0.870、0.064mg/kg;在2017年安徽萧县和河北辛集葡萄上的原始沉积量分别为:2.327、1.160mg/kg。40%咯菌腈悬浮液在安徽萧县葡萄上的消解方程分别为:y=0.840 3e-0.092x(2016)、y=0.999 9e-0.124x(2017);在河北辛集葡萄上的消解方程分别为:y=0.056 2e-0.089x(2016)、y=0.994 2e-0.087x(2017);半衰期分别为5.6~7.5d(2016~2017,安徽萧县)、7.8~8.0d(2016~2017,河北辛集)。咯菌腈在葡萄中的残留量随着时间的延长逐渐降低,且施药21d后,其残留量均降解85%以上。
2.5 咯菌腈在土壤上的消解动态 40%咯菌腈悬浮液在土壤中的消解动态结果显示:施药2h后,咯菌腈在2016年安徽萧县和河北辛集土壤上的的原始沉积量分别为:0.070、0.032mg/kg;在2017年安徽萧县和河北辛集土壤上的的原始沉积量分别为:1.019 6、0.228 6mg/kg。40%咯菌腈悬浮液在安徽萧县土壤上的消解方程分别为:y=0.054 3e-0.109x(2016)、y=0.388 4e-0.071x(2017);在河北辛集土壤上的消解方程分别为:y=0.030 9e-0.085x(2016)、y=0.202 7e-0.115x(2017);施药14d后,消解率在90%以上,安徽萧县土壤的半衰期为6.3~9.8d,河北辛集土壤的半衰期为6.0~8.1d。
2.6 咯菌腈在葡萄中和土壤中的最终残留量 2016~2017年安徽萧县和河北辛集两年两地葡萄和土壤的最终残留检测结果(表4)表明:40%咯菌腈悬浮液以低剂量133.3mg a.i./kg(制剂3 000倍液)和高剂量200mg a.i./kg(制剂2 000倍液)分别施药3、4次,咯菌腈的残留量与施药浓度、施药次数基本上呈正相关,施药浓度越高、次数越多,残留量越高;咯菌腈的残留量与采收间隔期呈负相关,采收时间距最后1次施药时间越长,残留量越低。

表4 2016~2017年安徽和河北葡萄和土壤中咯菌腈的最终残留量
3 结论
本研究建立了咯菌腈在葡萄和土壤中残留量的前处理和高效液相色谱上的检测方法,并进行了40%咯菌腈悬浮液在葡萄和土壤中的消解动态和最终残留试验。消解动态结果表明:咯菌腈在葡萄和土壤中的半衰期分别为5.6~8.0d和6.0~9.8d,最终残留量测定结果显示40%咯菌腈悬浮剂,用于防治葡萄灰霉病,施药剂量不超过133.3mg a.i./kg(制剂3 000倍液),最多施药3次,安全间隔期为7d。上述结果可为中国制定咯菌腈在葡萄上的MRL值提供参考。
