组合策略促进碱性果胶酶在毕赤酵母中高效表达
2019-04-25陈双全堵国成
陈双全 ,刘 松 ,堵国成 *,陈 坚
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122)
碱性果胶酶(EC 4.2.2.2,PGL)可在碱性条件下将果胶质裂解为不饱和的寡聚半乳糖醛酸,广泛应用于纺织、食品、造纸及环境领域[1-2]。为实现高效生产,PGL已在枯草芽孢杆菌[3]、大肠杆菌[4]及毕赤酵母(P.pastoris)[5]中表达。其中,重组大肠杆菌获得的PGL产量最高,达到4 478 U/mL[4]。然而,大肠杆菌表达PGL仍存在诸多问题,包括培养基成本高(蛋白胨类)、需添加价格昂贵的诱导剂(异丙基-β-d-硫代半乳糖苷)及易感染噬菌体等。对于工业生产,P.pastoris表达系统具有如下优势:目标基因整合于基因组表达,稳定性高;营养需求低;易于高密度培养;分泌系统强,胞外杂蛋白极少,目标蛋白易于分离纯化[6]。本团队前期研究中,成功实现了PGL在P.pastoris中的表达,产量达到863 U/mL,经补料策略优化可进一步提高[7]。
大量研究表明,外源蛋白在P.pastoris中高效表达受一系列因素影响[8-10]。首先,目标基因拷贝数将在基因转录水平上影响外源蛋白在P.pastoris中的表达[11]。其次,P.pastoris对密码子显示出偏好性也将在翻译阶段调控基因表达[12-13]。此外,外源蛋白的过量表达会引起未折叠蛋白效应(UPR),对外源蛋白的折叠和转运有重要作用。UPR包括大量的分泌辅助因子或分子伴侣,如:转录因子(HAC1)、蛋白二硫键折叠酶(PDI)、内质网中蛋白折叠氧化还原辅助因子(ERO1)、结合蛋白(BIP)、泛素共轭酶(UBC1)以及辅助转运及分泌过程的其他分子伴侣等[14-16]。因此,对基因拷贝数、密码子偏好性及UPR等因素的调控是促进PGL在P.pastoris中表达的重要策略。
本团队在前期研究中筛选得到的一株产PGL的Bacillussp.WSHB04-02菌株,经分子改造提高了其热稳定性及催化活性[17]。本研究以PGL高热稳定性突变体K314M为研究对象,通过密码子优化及过量表达分子伴侣ERO1及UBC1,以期提高PGL在P.pastoris中的分泌表达效率,并在3 L罐水平上考查了重组菌的发酵性能。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒编码Bacillussp.WSHB04-02 PGL高热稳定性突变体K314M基因的载体pET-22b(+)/pgl,由本研究室在前期工作中构建[17]。 表达载体pPIC9K及pGAPZA,表达宿主P.pastorisGS115(his-)及克隆宿主E.coliTOP10均购于Invitrogen公司(美国)。
1.1.2 主要试剂限制性内切酶EcoR I、NotI、SacI、BamH I、Bsp119 I、KpnI 和 AvrII 购 自ThermoFisher公司 (美国)。胶回收柱回收试剂盒、Prime STAR HS DNA聚合酶、酵母Total RNA提取试剂盒 (Yeast RNAiso Kit),反转录试剂盒(Prime Script RT reagent Kit with gDNA Eraser)及定量PCR试剂盒 (SYBR Premix Ex Taq TM Tli RNase H Plus)购自大连宝生物Takara公司。One Step Cloning Kit试剂盒购自南京诺唯赞生物科技有限公司。质粒提取试剂盒、G418、Zeocin、蛋白定量试剂购自生工生物工程(上海)有限公司。聚半乳糖醛酸购自Sigma公司(美国)。其他常用试剂及药品均为分析纯,进口分装或国产。
1.1.3 培养基YPD培养基(g/L):蛋白胨20、酵母提取物10、葡萄糖20。
BMGY 培养基(g/L):蛋白胨 20、酵母提取物10、甘油 40、YNB13.4、生物素 0.000 4,0.1 M 磷酸盐缓冲液,pH 6.0。
BMMY 培养基(g/L):蛋白胨 20、酵母提取物10、YNB13.4、 生物素 0.000 4,9%甲醇 (v/v),0.1 M磷酸盐缓冲液,pH 6.0。
PTM1 溶 液 (g/L):CuSO4·5H2O 6.0、KI 0.08、MnSO4·H2O 3.0、Na2MoO4·2H2O 0.2、H3BO30.02、CoCl20.5、ZnCl220.0、FeSO4·7H2O 65.0、生物素 0.2,H2SO45.0 mL/L。
1.2 方法
1.2.1 PGL及分子伴侣表达载体构建
1)PGL表达载体pPIC9K-PGL构建 研究发现不同物种对密码子使用频率不同,P.pastoris对密码子显示出偏好性,也将在翻译阶段调控基因表达[12-13]。基于P.pastoris密码子偏好性对PGL高热稳定性突变体K314M的基因优化,并克隆至宿主pUC57(金斯瑞生物科技有限公司)。以pUC57-PGL为模板,用引物PGL-F/R(表1)扩增PGL基因,PCR扩增条件:95℃预变性5 min;随后进行34个循环(95 ℃ 30 s,60 ℃ 30 s,72 ℃ 1.5 min), 最后 72 ℃保温10 min。载体pPIC9K用EcoR I及NotI双酶切,PCR片段及酶切后的载体柱回收,根据One Step Cloning Kit试剂盒说明书进行重组连接,连接产物转化E.coli TOP10,质粒提出得到PGL表达载体pPIC9K-PGL。未经密码子优化的K314M基因通过引物PGLN-F和PGLN-R从pET-22b (+)/pgl扩增得到,并克隆至pPIC9K中EcoR I-NotI位点,得到表达载体pPIC9K-PGLN。
2)内参基因载体pPIC9K-GAPDH构建 内参基因在各组织和细胞中表达相对恒定,常用做参照物,在测定基因转录水平及拷贝数时甘油醛-3-磷酸脱氢酶(GAPDH)(GenBank No:U62648.1)常用做内参基因[18-19],以P.pastorisGS115 cDNA为模板,用引物GAPDH-F/R(表1)扩增GAPDH基因,PCR扩增条件:95℃预变性5 min;随后进行34个循环(95 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min), 最后 72 ℃保温10 min。载体pPIC9K用EcoR I及NotI双酶切,PCR片段及酶切后的载体柱回收,根据One Step Cloning Kit试剂盒说明书进行重组连接,得到GAPDH载体pPIC9K-GAPDH。
3)分子伴侣共表达载体的构建 以P.pastorisGS115 cDNA为模板,分别用引物ERO1-F/R和UBC1-F/R (表 1) 扩 增 ERO1 (GenBank No:XM_002489600.1) 和 UBC1 (GenBank No:XM_002493814.1)基因。PCR扩增条件为:95℃预变性 5 min,随后进行34个循环(95℃ 30 s,60℃30 s,72℃ 1 min), 最后 72℃保温 10 min。 载体pGAPZA用Bsp119 I及KpnI双酶切,PCR片段及酶切后的载体柱回收,根据One Step Cloning Kit试剂盒说明书进行重组连接,分别得到ERO1和UBC1表达载体pGAPZA-ERO1及pGAPZAUBC1。利用BglII与BamH I为同尾酶效应,将构建好的pGAPZA-ERO1用BglII与BamH I双酶切,胶回收得到完整的GAP-ERO1-AOX(TT)表达框,再与用BamH I单酶切的pGAPZA-UBC1载体连接,得到共表达ERO1和UBC1的载体pGAPZERO1-UBC1。

表1 本研究中所用PCR引物Table 1 Primers used for PCR in this study
1.2.2 P.pastoris GS115转化与筛选为表达PGL基因,用SacI将质粒pPIC9K-PGL线性化,电转化至感受态P.pastorisGS115菌株。转化后涂布MD平板,30℃培养3~4 d,经MD/MM平板筛选Mut+/Muts菌株,再经YPD+1-4 mg/mL G418平板初步筛选基因拷贝数,挑选5~10个重组菌进行摇瓶发酵。
为共表达分子伴侣,用AvrII线性化pGAPZAERO1,pGAPZA-UBC1 及 pGAPZA-ERO1-UBC1,电转化至以第1次转化筛选得到的重组菌株GS115/PGL14#,涂布 YPD+100 μg/mL Zeocin 平板,30 ℃培养 3~4 d, 经 100~400 μg/mL Zeocin平板初步筛选基因拷贝数,挑选5~10个重组菌进行摇瓶发酵。
1.2.3 重组P.pastoris摇瓶发酵摇瓶培养条件:从固体培养基上挑取单菌落接种于YPD培养基中30℃,220 r/min培养14 h,以10%接种量转接于BMGY培养基中30℃,220 r/min培养24 h,收集菌体,生理盐水清洗2次,转接至BMMY培养基中22℃,220 r/min诱导PGL表达,每24 h补加1.5%甲醇(v/v)。
细胞生长情况及酶活每24 h取样测定,筛选得到的较优重组菌株通过荧光定量PCR准确测定其基因拷贝数。
1.2.4 3 L罐发酵从平板上挑取单菌落接种于YPD培养基中30℃,220 r/min培养24 h,以10%接种量接种于包含800 mL分批发酵培养基(85%磷酸 26.7 mL/L,CaSO40.93 g/L,K2SO418.2 g/L,MgSO4·7H2O 14.9 g/L,KOH 4.13 g/L,甘油 40.0 g/L,PTM14.35 mL/L)的3 L发酵罐(美国NBS公司)中,初始搅拌转速为500 r/min,通气量为2 vvm,50%氨水及30%磷酸控制pH5.5,生长期培养温度为30℃,当甘油耗尽溶氧反弹时以指数流加方式补加50%(w/v含 12 mL/L PTM2)甘油,待甘油再次耗尽溶氧反弹时,饥饿培养2 h,开始流加诱导培养基(100%甲醇含12 mL/L PTM2),同时温度降低至22℃,搅拌转速升高至900 r/min,诱导PGL表达。诱导培养基采用分阶段流加方式:0~8 h流速2 mL/h,8~90 h流速 9.6 mL/h,>90 h流速 2 mL/h[20]。 每隔 12 h取样一次,测定生物量、酶活、蛋白含量等参数。
1.2.5 指数流加指数流加是建立在对物料平衡及反应动力学两方面进行合理假设基础上的一种较为常见的前置流加控制法,可使限制性基质的供给与反应器中细胞量随时间的指数增加相适应。流加速率为
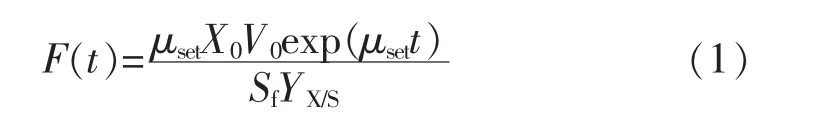
式中:F(t)为流加速率,L/h;X0为细胞密度,gcell/L;V0为初始体积,L;Sf代表补料液中甘油浓度,g/L;YX/S对底物细胞得率(gcell/gglycerol);μset为设定的比生长速率(h-1)。 其中 μset为 0.176 h-1,YX/S为 0.435 g/g,Sf为500 g/L[5]。
1.2.6 PGL蛋白纯化取发酵液于4℃,8 000 r/min离心10 min获得含PGL发酵上清,将发酵上清置于冰上,边搅拌边缓慢加入硫酸铵粉末,至终浓度40%~60%,离心得富集的粗PGL蛋白,粗蛋白用5 mL缓冲液A (20 mmol/L甘氨酸-NaOH溶液,pH 7.5)复溶,并置于A液中透析24 h,将样品用0.22 μmol/L微孔滤膜过滤,纯化使用AKTA纯化仪及5 mL 阳离子柱(HiTrapTM SP FF 2.5 cm,GE)。柱纯化条件如下:用5~10倍柱体积的缓冲液A平衡阳离子柱,之后以1 mL/min流速进样,进样结束以5个柱体积A液继续平衡柱子,流速改为2 mL/min,用洗脱缓冲液B(20 mmol/L甘氨酸-NaOH溶液,pH 7.5,1 mol/L NaCl)梯度洗脱,收集洗脱液,取测得PGL酶活的洗脱液在A液中透析过夜,样品4℃保存。
1.2.7 PGL活力测定酶活测定条件为:发酵液8 000 r/min离心10 min,胞外PGL即包含于发酵上清液之中,取一定量稀释做检测。PGL反应体系[21]:含0.2%聚半乳糖醛酸(底物)的甘氨酸-NaOH缓冲 液 (0.2 mol/L,0.44 mmol/L 的 CaCl2,pH 9.4)2 mL,待测样品20 μL,无活性的酶液为空白对照。PGL反应条件为:将反应体系置于45℃下水浴15 min,用 3 mL 磷酸溶液(0.03 mol/L)终止反应,在235 nm处测定吸光度值。单位酶活定义:单位时间(1 min)裂解聚半乳糖醛酸产生1 μmol的不饱和聚半乳糖醛酸所用的酶量。计算方法如下

式中:b为比色皿厚度,cm;4 600为不饱和PGA于235 nm处的摩尔吸光系数,L/mol/cm;t为酶促反应时间(在酶促反应线性范围之内),min。
1.2.8 荧光定量PCR目标基因拷贝数通过RTPCR 测定[18-19],定量 PCR 引物(表 1)。 20 μL反应体系包括 10 μL SYBR Premix Ex TaqII (Tli RNaseH Plus),0.8 μL RT-PCR F/R 引物 (10 μmol/L),2 μL DNA 模板(<100 ng),6.4 μL 灭菌蒸馏水。PCR 反应条件:95 ℃,30 s预变性;95 ℃,5 s,55 ℃,30 s,40个循环反应。40个循环后通过融解曲线分析特异性。以10倍梯度稀释的内参基因GAPDH及目标基因作为模板建立标准曲线,以重组菌株基因组作为RT-PCR的模板,通过双曲线法计算不同重组菌株中相关基因的拷贝数。
1.2.9 PGL去糖基化纯化后的PGL用去糖基化酶 Endo H(美国 NEB 公司)处理[22]:10 μL PGL 上清,加入 1 μL 10×Glycoprotein Denaturing Buffer混合,100 ℃反应 10 min,再加入 2 μL 10×GlycoBuffer 3,2.5 μL Endo H,加水补足至 20 μL,37 ℃反应 1 h。
1.2.10 PGL半衰期的测定重组PGL及突变体的热稳定性用55℃下酶活力半衰期(t1/2,min)来表示。将纯化后的PGL用20 mmol/L甘氨酸-氢氧化钠缓冲液(pH 7.5)稀释至 100 μg/mL,并在 55 ℃保温,间隔测定残余酶活,将残余酶活按照文献所述方式拟合并计算t1/2[23]。
1.2.11 SDS-PAGE分析样品与4×加样Buffer混合,72℃处理10 min,5%浓缩胶及12%分离胶购自Invitrogen公司(美国),操作参考产品说明书。

图1 密码子优化后的PGL基因序列Fig.1 Optimized PGL gene sequence
2 结果与分析
2.1 密码子优化对PGL表达的影响
P.pastoris对一些密码子显示出偏好性,从而影响编码基因的表达效率[13]。研究发现,密码子优化可使葡萄糖异构酶在P.pastoris中的表达效率提高2.4倍[24]。为提高PGL的转录及翻译效率,基于P.pastoris的密码子偏好性对Bacillussp.WSHB04-02来源的PGL基因进行优化(图1),使其密码子适应指数 (CAI) 由 0.63提高至 0.84[25],GC含量从46.64%降为42.41%。基因结构分析表明,不适宜的GC峰也被优化以延长mRNA的半衰期;影响mRNA稳定性及核糖体结合的茎环结构被破坏掉;消极的顺式位点也被成功修饰。
将Bacillussp PGL基因克隆至pPIC9K中的EcoR I-NotI位点,构建得到PGL表达质粒pPIC9K-PGL (图 2 (a)),转化P.pastorisGS115(his-)得到重组菌GS115/PGL转化子,经MD/MM平板筛选Mut+/Muts菌株,获得表型为Mut+的数十株菌株,再经不同浓度梯度G418平板筛选,从1~4 mg/mL平板上各挑取10个单菌落进行摇瓶发酵96 h。其中,菌株GS115/PGL 9#、14#和19#胞外酶活分别为256.35、301.32 U/mL和273.24 U/mL。重组菌株PGL基因拷贝数使用RT-PCR进行确定(表2),PGL拷贝数为3时重组菌株具有最佳的PGL表达能力。未经密码子优化的PGL基因克隆至pPIC9K中的EcoR I-NotI位点得到pPIC9K-PGLN,转化P.pastorisGS115(his-)得到含3个拷贝数PGL基因的重组菌GS115/PGLN。在相同拷贝情况下,GS115/PGL 14#较GS115/PGLN胞外PGL酶活提高25.1%,表明密码子优化能有效提高PGL在P.pastoris分泌表达。

图2 重组质粒示意图Fig.2 Schematic plot of recombinant plasmids

表2 重组菌生产性能及PGL基因拷贝数Table 2 Productivity of recombinant strains and copy numbers of PGL gene
2.2 共表达分子伴侣对PGL胞外表达的影响
共表达UPR相关分子伴侣可有效减缓未折叠蛋白效应,促进外源蛋白在P.pastoris中的表达[14-16]。ERO1可以辅助促进外源蛋白在内质网中的折叠,UBC1可以通过泛素化作用辅助错误折叠蛋白的降解,共表达ERO1及UBC1可有效促进外源蛋白正确折叠及错误折叠蛋白的快速降解,从而缓解细胞代谢压力,促进外源蛋白高效表达。为提高PGL胞外表达水平,在重组菌GS115/PGL 14#中分别共表达ERO1及UBC1。将ERO1及UBC1基因克隆至pGAPZA中的Bsp119 I-KpnI位点,构建得到表达质粒 pGAPZA-ERO1(图 2(b))和 pGAPZA-UBC1(图 2(c)),电转化 GS115/PGL 14#,得到 10 个转化子进行摇瓶发酵。经过96 h甲醇诱导发酵,PGL酶活达到最大值,其中重组菌GS115/PGL-ERO1 6#及GS115/PGL-UBC1 3#的PGL酶活分别达到408.27 U/mL 及 368.54 U/mL(图 3),较出发菌分别提高35.5%及22.3%。
为提进一步提高PGL产量,在重组菌GS115/PGL 14#中共表达 ERO1及 UBC1。将pGAPZAERO1用BglII与BamH I双酶切,得到GAPERO1-AOX(TT)表达框,克隆至BamH I单酶切的pGAPZA-UBC1载体,得到共表达载体pGAPZERO1-UBC1(图2d)。发酵结果显示,GS115/PGLERO1-UBC1 2#重组菌株其最大酶活达到450.12 U/mL,相比于出发菌株提高49.3%(图3)。

图3 重组菌摇瓶发酵过程曲线Fig.3 Fermentation process curve of the recombinant strains in shake flask
以GAPDH基因为内参,应用RT-PCR测定了重组菌中分子伴侣的基因拷贝数。结果显示,GS115/PGL-ERO1-UBC1 2#中ERO1与UBC1基因拷贝数分与GS115/PGL-REO1 6#和GS115/PGL-UBC1 3# 相同(表 3)。
2.3 3 L罐发酵培养
分批补料发酵是一种简单有效的发酵模式,可在短时间内增加P.pastoris菌体浓度来提高目的产物的产量以及生产强度。通过分批补料发酵及相关参数优化,目标产物的产量可以提高数倍之多[26-27]。本实验室前期研究PGL时,通过分批补料发酵策略提高了PGL的表达水平[5,7]。因此,比较了重组菌GS115/PGL 14#及GS115/PGL-ERO1-UBC1 2#在3 L罐中分批补料发酵。

表3 RT-PCR测定共表达基因拷贝数Table 3 Copy numbers of co-expressing gene detected by real-time PCR
发酵起始采取分批培养,在第19 h DO反弹初始甘油耗尽后,开始采用指数流加方式流加50%的甘油溶液,控制比生长速率(μset)为 0.176 h-1,指数流加19 h,当甘油耗尽DO再次反弹后,饥饿培养2 h后开始分阶段 (0~8 h流速2 mL/h,8~90 h流速9.6 mL/h,>90 h流速2 mL/h)流加诱导培养基,诱导重组菌生产PGL[20]。如图4所示,在20~40 h细胞生长较快,诱导发酵初期菌体依然缓慢生长,至发酵后期 (100~160 h)菌体量不再增加,此时重组菌GS115/PGL-ERO1-UBC1 2#的细胞干重可达120 g/L,组合共表达ERO1及UBC1的重组菌株GS115/PGL-ERO1-UBC1 2#在诱导96 h时PGL酶活达到最大值为1 362.31 U/mL,相比于未共表达分子伴侣的重组菌株GS115/PGL 14#的934.34 U/mL提高45.8%,且菌体生长更好。这些结果表明共表达分子伴侣ERO1及UBC1可有效促进菌体生长及外源蛋白表达。


图4 重组菌3 L罐分批补料发酵过程曲线Fig.4 Fermentation process curve of the recombinant strains during fed-batch fermentation in the 3 L fermentor
为进一步研究糖基化对PGL表达的影响,通过阳离子柱纯化方法从GS115/PGL-ERO1-UBC1 2#诱导96 h发酵上清中分离纯化得到PGL纯酶。图5中SDS-PAGE分析显示,纯化后的PGL蛋白条大小为47 kDa和49kDa,较PGL理论分子量43.5 kDa偏大。纯化的PGL经去糖基化酶Endo H处理后,PGL主要转化为43.5 kDa蛋白及其它未知低分子量蛋白,上述结果表明,PGL在P.pastoris表达后发生了糖基化。研究表明,糖基化对酶分子在酵母表达水平有重要作用[22,28]。在下一步工作中,将通过去糖基化修饰来进一步提高PGL的胞外表达水平。此外,GS115/PGL-ERO1-UBC1 2#生产的PGL 55℃下酶活力半衰期较野生酶提高81.3%,达到1.16 h,稳定性明显提升。
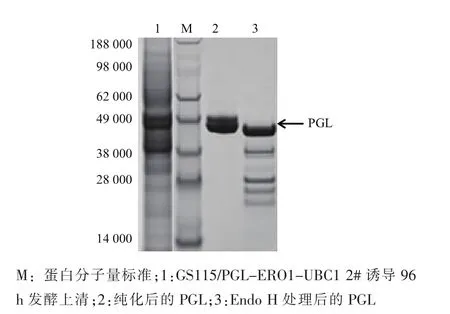
图5SDS-PAGE电泳分析Fig.5 SDS-PAGE analysis
3 结语
本研究表明系统性的密码子偏好性优化及共表达分子伴侣可显著促进宿主细胞生长及外源蛋白PGL的表达。单独共表达分子伴侣ERO1或UBC1对促进PGL的表达拥有较好效果,组合共表达ERO1-UBC1效果更加显著,也说明两个分子伴侣之间拥有积极的相互作用。在相同分批发酵条件下,改造后的重组菌GS115/PGL-ERO1-UBC1 2#胞外PGL酶活达到1 362.31 U/mL,较改造前PGL酶活 863 U/mL提高 57.9%[7]。此外,GS115/PGLERO1-UBC1 2#生产的PGL55℃下酶活力半衰期较野生酶提高81.3%,达到1.16 h,稳定性明显提升。研究结果对促进PGL产量的提升及其应用具有重要现实意义。
