耐热赖氨酸氨肽酶的原核表达及特性表征
2019-04-24周楠迪田亚平
黄 浩 , 周楠迪 , 田亚平 *
(1.江南大学 生物工程学院,江苏 无锡214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122)
氨肽酶(Aminopeptidases,简称 AP)是一类能够水解多肽N末端附近肽键释放出游离氨基酸的外切蛋白酶[1]。对于蛋白质水解物苦味的去除[2]、提高营养价值以及深加工等方面具有良好的作用,可应用于乳制品、肉制品行业促进食品风味;此外在医疗行业,氨肽酶检测也可作为一项疾病诊断指标[3]。氨肽酶广泛存在于动植物和微生物中[4],根据不同的标准可以分成很多种类。赖氨酸氨肽酶是指切割多肽链N末端赖氨酸残基效率最高的一类氨肽酶[5],水解释放出的游离赖氨酸是人和动物的必需氨基酸,对于人体代谢水平的调节、钙离子的吸收和积累及增强体质等方面具有重要作用[6]。因此,赖氨酸氨肽酶在食品工业领域具有广泛的应用价值。
耐热酶是一类能够在高温下保持活性的酶,在工业领域具有降低制备成本、提高反应速率、生产工艺简化等优势,应用前景广阔[7-8]。因此自从70年代发现产生耐热酶的嗜热菌以来,耐热酶迅速成为一个重要的研究领域[9]。目前,大多数研究仍集中在耐热酶产生菌的筛选及分离纯化上[10-11],由于野生嗜热菌的培养条件严格、生长速度较慢,实现耐热酶在常温宿主中的表达成为一个新的研究方向。
作者在筛选得到一株耐热赖氨酸氨肽酶产生菌P.sdfdsafda的基础上[12],克隆得到该耐热酶的编码基因,构建重组基因并实现了重组酶在原核宿主E.coil中的异源表达,纯化得到电泳纯的酶液并初步研究了其特性表征,为进一步研究实现耐热赖氨酸氨肽酶的工业化应用奠定了基础。
1 材料与方法
1.1 实验材料
1.1.1 菌株和质粒 Pseudomonas aeruginosa NJ-814:实验室筛选与保藏;菌株E.coil JM109、E.coil BL21(DE3):Novagen 公司产品;质粒 pET-42a(+):大连宝生物公司产品。
1.1.2 主要试剂 胰蛋白胨、酵母粉:英国oxoid公司产品;基因组提取试剂盒:天根生化科技公司产品;质粒抽提试剂盒、DNA纯化试剂盒、硫酸卡那霉素:上海生工公司产品;限制性内切酶、DNA marker、T4 DNA连接酶:大连宝生物公司产品;SDS-PAGE凝胶配制试剂盒:碧云天生物技术研究所产品。
1.1.3 培养基 LB液体培养基(g/dL):1胰蛋白胨,0.5 酵母粉,1NaCl;自然 pH。
TB液体培养基 (g/dL):1.2胰蛋白胨,2.4酵母粉; 体积分数 0.5%甘油,72mmol/L K2HPO4·3H2O,17mmol/L KH2PO4。
LBK、TBK培养基:分别对应在LB液体培养基、TB液体培养基中添加终质量浓度为50 μg/mL过滤除菌的硫酸卡那霉素(Kan)。
固体培养基即在对应液体培养基基础上添加1.5 g/dL的琼脂粉。
1.2 赖氨酸氨肽酶基因的获取
1.2.1 P.aeruginosa基因组的提取 实验室前人从土壤中筛选得到一株氨肽酶产生菌铜绿假单胞菌NJ-814(Pseudomonas aeruginosa NJ-814)。取甘油冷冻保藏的P.aeruginosa NJ-814,划线于LB平板37℃活化培养,挑取活化好的单菌落转接到LB液体培养基,37℃、220 r/min振荡过夜培养。取适量培养液,根据细菌基因组DNA提取试剂盒操作方法提取Pseudomonas aeruginosa基因组。
1.2.2 编码基因的克隆 根据NCBI公布的铜绿假单胞菌Pseudomonas aeruginosa GF31氨肽酶基因序列设计引物:lap-s:5'CCGgaattcATGGTCAGCACCC CGCTTGGCCTGCCGC 3'(小写字母表示EcoRⅠ酶切位点);lap-a:5'CCGctcgagTTACTTGATGAAGTC GTGACC 3'(小写字母表示XhoⅠ酶切位点)。利用1.2.1中提取的基因组作为模板,PCR扩增lap基因。 PCR 反应体系(50 μL):模板 2 μL,lap-s 2 μL,lap-a 2 μL,ddH2O 19 μL,PrimeSTAR MAX 25 μL。PCR反应条件:95℃5 min预变性;95℃15 s变性,55℃30s退火,72℃90s延伸,循环35次;72℃ 5 min后延伸。
1.3 重组菌的构建与表达
1.3.1 基因的连接与转化 PCR产物通过纯化试剂盒纯化,与质粒pET-42a(+)用限制性内切酶EcoRⅠ、XhoⅠ同条件双酶切,酶切产物经过琼脂糖凝胶电泳后进行胶回收,胶回收产物通过T4 DNA连接酶于16℃过夜连接,连接液42℃热击转化E.coil JM109感受态细胞,涂布到LBK平板上37℃过夜培养,筛选出具有Kan抗性的转化菌株。菌落PCR筛选阳性转化子,培养后用质粒抽提试剂盒提取重组质粒,双酶切验证并送检上海生工测序。
1.3.2 重组酶的诱导表达与检测 重组质粒转化E.coil BL21(DE3)感受态细胞获得重组菌BLAP。挑取单菌落接种于5 mL LBK液体培养基,37℃、220 r/min振荡过夜培养,再以1%的接种体积分数转接到50 mL TBK液体培养基中培养至OD600达到0.6左右,加入终浓度为0.5 mmol/L的诱导剂IPTG,16℃低温诱导36h。诱导培养结束后,取发酵液离心得到发酵液上清和菌体沉淀,沉淀用 Tris-HCl(50 mmol/L,pH 7.5)缓冲液漂洗后超声破碎,破碎液离心收集上清液。
通过LNA比色法[13]测定发酵液上清中的胞外氨肽酶酶活和破碎液上清中的胞内氨肽酶酶活。2 mL Tris-HCl(50 mmol/L,pH 9.0)缓冲液加入 1 mL底物亮氨酸对硝基苯胺(L-Leu-pNA)和1 mL适量稀释的上清液,80℃水浴条件反应10 min,405 nm波长下比色测定吸光值。
取发酵液上清和破碎液上清作为实验组进行SDS-PAGE电泳,以未连接lap的质粒pET-42a(+)转化E.coil BL21(DE3)后经过同条件处理作为对照组,验证重组酶的表达情况。
1.4 重组酶的纯化与酶学性质
通过Ni-NTA亲和层析对重组酶进行纯化分离并进行SDS-PAGE电泳验证。
初步研究了纯化后的重组酶的酶学性质。
1.5 酶活定义
在80℃水浴条件下每分钟分解亮氨酸对硝基苯胺(L-Leu-pNA)产生1 μmol对硝基苯胺所需的酶量,即为1个酶活单位。
2 结果与讨论
2.1 重组菌的构建
根据NCBI公布的Pseudomonas aeruginosa GF31氨肽酶DNA序列设计引物,以Pseudomonas aeruginosa NJ-814基因组为模板,PCR扩增出大小约1.5 kb的DNA条带。纯化的PCR产物与质粒pET-42a(+)经过 EcoRⅠ和 XhoⅠ双酶切,成为两端带有相同粘性末端的基因片段,在T4 DNA连接酶的作用下部分连接形成重组质粒。重组质粒转化进入E.coil感受态细胞后能使转化子在含有卡那霉素的LB平板上长出单菌落,通过菌落PCR进一步将阳性转化子从空载质粒转化菌株中筛选出来,能够扩增出目标条带的即对应构建成功的重组菌BLAP。
BLAP经过培养提取重组质粒进行双酶切验证。重组质粒在上海生工测序后得到lap基因的DNA序列,通过DNAMAN翻译出其所对应的氨基酸序列,如图1所示。该基因长度为1 461 bp,与凝胶电泳结果相符,共编码486个氨基酸,通过分析软件ExPASy预测其相对分子质量大小约为54×103。将序列提交到NCBI通过Blast比对,确认PCR扩增得到的目的基因为编码Pseudomonas aeruginosa氨肽酶的DNA。

图1 lap基因的核酸序列和氨基酸序列Fig.1 Nucleotide and amino acid sequences of gene lap
2.2 重组酶的表达
BLAP按1.3.2所述条件诱导培养后,测得胞内氨肽酶酶活约2.5 U/mL,胞外未测到氨肽酶酶活。已知重组酶相对分子质量大小约为54×103,同时载体质粒pET-42a(+)上GST标签能够表达出约26×103的融合蛋白,共80×103左右,SDS-PAGE对重组酶表达情况的验证结果见图2,可以观察到破碎液上清电泳在66.4×103与97.2×103之间出现一条对照组没有的条带,可以证明重组酶的成功表达。
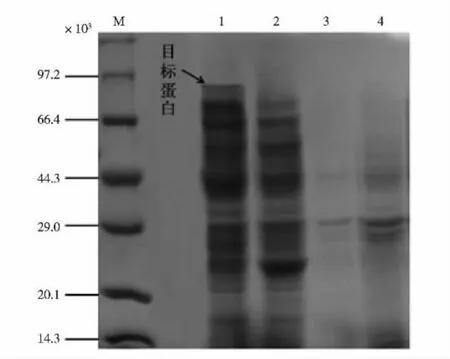
M:蛋白质相对分子质量标准;1:实验组破碎液上清液;2:对照组破碎液上清液;3:实验组发酵液上清;4:对照组发酵液上清液
2.3 重组酶的纯化
载体质粒pET-42a(+)带有His-tag,使得表达的重组酶能够通过镍柱亲和层析进行分离纯化,纯化结果如表1所示,重组酶纯化倍数为4.7倍,回收率为83.5%。纯化后的酶液进行SDS-PAGE分析得到电泳纯,见图3。

表1 重组酶镍柱纯化结果Table 1 Ni-NTA purification results of the recombinant
2.4 重组酶的酶学性质
2.4.1 最适反应pH和pH稳定性 室温条件下配制不同pH(3.0~11.0)的缓冲液,测定重组酶在各缓冲液体系中的酶活,如图4,以pH值为横坐标、相对酶活为纵坐标,确定该酶的最适反应pH为8.3;将酶液置于不同pH条件下,30℃水浴保温1 h后,测定其残留酶活,由图5可知该酶在pH 6.5~9.5之间具有较好的稳定性。与课题组报道的野生菌所产氨肽酶最适pH为9.0、在pH 7.5~10.5之间具有稳定性[14]是一致的。
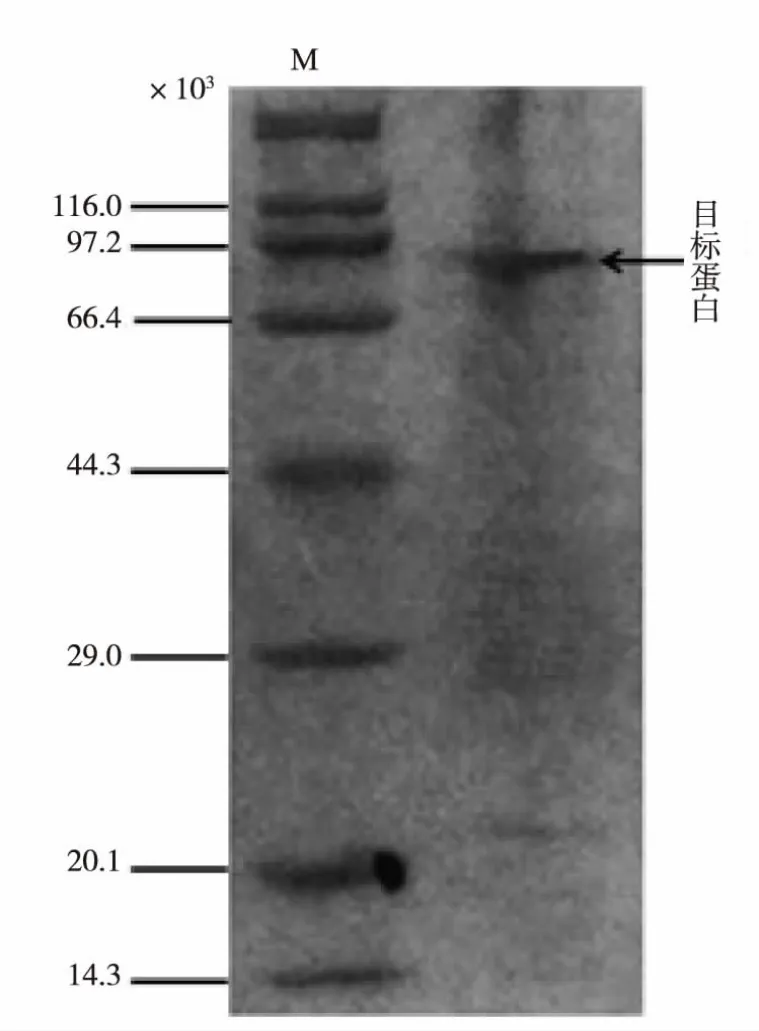
图3 镍柱纯化后的重组酶SDS-PAGE验证Fig.3 SDS-PAGE identification of the Ni-NTA purified recombinant enzyme
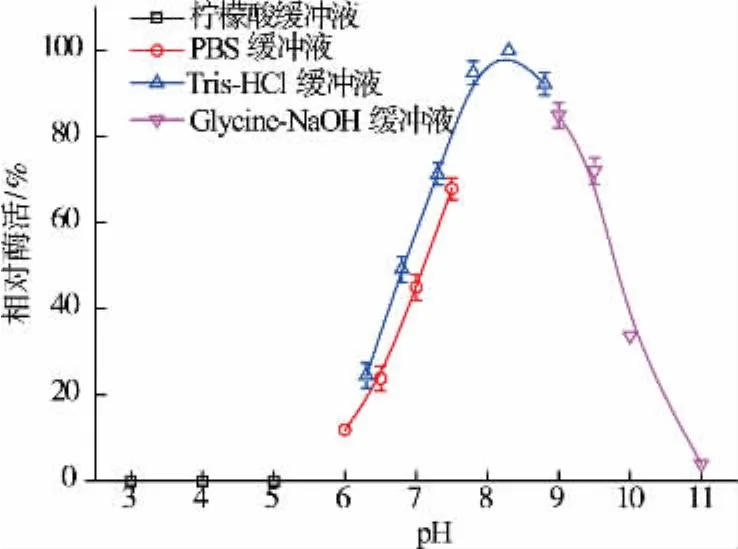
图4 重组酶最适反应pH Fig.4 Optimal reaction pH of the recombinant enzyme

图5 重组酶pH稳定性Fig.5 pH stability of the recombinant enzyme
2.4.2 最适反应温度和温度稳定性 将重组酶与底物置于不同温度条件下反应测定酶活,根据图6可知80℃为最适反应温度。将酶液于梯度温度中分别水浴1 h,再按照标准方法测定处理后的剩余酶活,以4℃酶液保存温度下的酶活作为对照,如图7所示,该重组酶经过70℃热处理1 h能保留60%以上的酶活性,与野生菌所产氨肽酶经过70℃热处理2 h后保留约70%酶活[12,15]相比,热稳定性略有降低,但仍比多数常温酶具有更好的耐热性。

图6 重组酶最适反应温度Fig.6 Optimal reaction temperature of the recombinant enzyme

图7 重组酶温度稳定性Fig.7 Temperature stability of the recombinant enzyme
2.4.3 底物特异性、动力学分析
分 别 用 Ala-pNA、Arg-pNA、Ile-pNA、LeupNA、Lys-pNA、Met-pNA、Pro-pNA、Val-pNA 作为底物,考察重组酶的底物特异性,如图8所示,该酶能够水解Arg-pNA、Leu-pNA和Lys-pNA,对LyspNA的水解能力分别是Arg-pNA的6.6倍、LeupNA的2.4倍。
以不同浓度 (0.2~1.4 mmol/L)的Leu-pNA和Lys-pNA作为底物,采用Lineweaver-Burk双倒数作图法,见图9-图10,算得以Leu-pNA为底物的米氏常数Km为15.07 mmol/L、最大反应速率Vmax为12.77 μmol/(L·min), 以 Lys-pNA 为底物的Km和Vmax分别为 4.86 mmol/L、8.76 μmol/(L·min)。
结果表明该重组酶对Lys-pNA亲和性更强,与野生菌所产的酶表现出相似的底物特异性,同属赖氨酸氨肽酶。

图8 重组酶底物特异性Fig.8 Substrate specificity of the recombinant enzyme
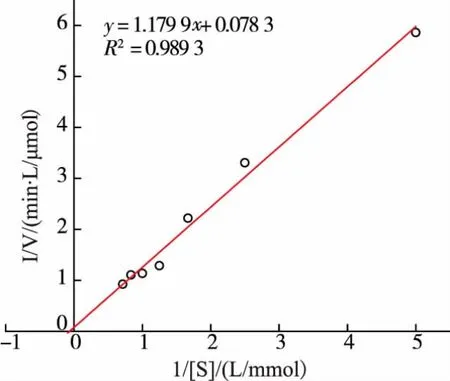
图9 Leu-pNA底物的重组酶双倒数图Fig.9 Lineweaver-Burk plot of the recombinant enzyme with Leu-pNA as substrate

图10 Lys-pNA底物的重组酶双倒数图Fig.10 Lineweaver-Burk plot of the recombinant enzyme with Lys-pNA as substrate
3 结 语
论文从野生菌Pseudomonas aeruginosa中克隆出编码一种氨肽酶的基因lap,利用该基因构建的重组质粒pET-42a-lap转化到异源宿主E.coil BL21(DE3)中,形成能够表达重组氨肽酶的工程菌BLAP。重组酶经过Ni-NTA分离纯化后得到氨肽酶纯酶液。对重组酶的酶学性质研究发现,该酶和野生菌所产酶一样都属于赖氨酸氨肽酶,在碱性条件下表现出活性,并且具有良好的热稳定性。为进一步研究该重组酶的高效分泌表达和热稳定性氨肽酶的构效及进一步的应用奠定了基础。
