乙酰氨基葡萄糖合成关键酶氨基葡萄糖-6-磷酸乙酰转移酶的筛选及酶学性质分析
2019-04-24徐小芳刘延峰李江华堵国成
徐小芳 , 刘延峰 , 李江华 *, 刘 龙 , 堵国成 , 陈 坚
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122)
N-乙酰氨基葡萄糖 (N-acetylglucosamine,GlcNAc)是氨基葡萄糖(Glucosamine,GlcN)的 衍生物,具有重要的生理功能,在食品、医药及化妆品领域具有广泛应用[1],如可以提高关节抗炎活性和蛋白活性[2];食品方面的添加剂和抗氧化剂[3];可作为天然的保鲜剂和抗菌剂广泛应用于食品保藏[4];最近研究表明,GlcNAc能够提高内质网蛋白质内稳态,从而起到延长细胞寿命的作用[5]。
GlcNAc的生产方法可分为3种:甲壳素水解法、生物转化法和微生物发酵法[6-8]。发酵法生产GlcNAc利用的生产菌株主要有真菌和大肠杆菌(Escherichia.Coli,E.coli)[9-10]。目前本实验室采用枯草芽孢杆菌(Bacillus.subtilis,B.subtilis)发酵生产GlcNAc[8,11],B.subtilis 已被广泛应用于发酵工业,其产品被认定为是食品安全级[12],且遗传背景清晰、基因操作技术成熟、发酵工艺成熟并且不易被噬菌体污染,是生产GlcNAc的理想宿主[13]。
氨基葡萄糖-6-磷酸乙酰转移酶(glucosamine-6-phosphate N-acetyltransferase 1,Gna1,EC 2.3.1.4)作为合成GlcNAc代谢途径上的关键酶是GCN5相关的GNAT蛋白质超家族中的一员[14],是一组参与相关天冬酰胺连接型(N-)聚糖合成与加工的重要酶类,能够催化生成GlcNAc-6P,将Acetyl-CoA中的乙酰基转移到GlcN-6P的氨基上[15-16],生成的GlcNAc-6P进一步在胞内转化为GlcNAc并被转移到胞外。目前GNA的三级结构在人类、酵母、人类、秀丽隐杆线虫、烟曲霉及布氏椎虫中有所报道[16-21]。许多物种包括白假丝酵母、酿酒酵母(Saccharomyces cerevisiae,S.cerevisiae)、布氏椎虫、小鼠等GNA缺失后,均引起致死表型[15,20-22]。然而前期研究GNA表达相关内容仅集中于调控不同表达元件优化GNA表达量,因此,找到一种能够提高目标产物GlcNAc产量氨基葡萄糖乙酰转移酶并且对其酶学性质进行系统研究对提高发酵法生产GlcNAc具有重要意义。
本研究首先异源表达7种不同来源的GNA,筛选出秀丽隐杆线虫来源的Cegna1能够更有效的积累乙酰氨基葡萄糖。其次,考察了7株重组酶的动力学参数米氏常数Km与Kcat/Km发现重组Cegna1相比较其他6种重组酶均对GlcN-6P和Ac-CoA有较高的亲和力和催化效率。最后发现底物GlcN-6P对重组Cegna1的抑制作用明显,下一步可采用定向进化策略改造Cegna1,解除底物GlcN-6P对重组Cegna1的抑制作用。本研究结果筛选到的Cegna1可用于GlcNAc合成途径的优化,同时为应用定向进化策略改造GNA提供理论依据和指导。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒 本文所用的菌株、质粒及引物见表1和表2,出发菌株为重组BSGN6-PxylA-glmS,为本实验室所改造[11],出发菌株在野生型菌株B.subtilis 168基础上进行改造得到。质粒pP43NMK由张晓舟博士惠赠 (美国弗吉尼亚理工大学,生物系统工程学院)。表达氨基葡萄糖乙酰化酶7种不同来源基因Cegna1(Caenorhabditis elegans,NCBIGenBank:AB017628.1)、Tbgna1 (Trypanosoma brucei,NCBI GenBank:FR715998.1)、Scgna1 (S.cerevisiae,NCBI GenBank:NM_001179949.1)、Cagna1(Candida albicans,NCBI GenBank:XM_715990.1)、Afgna1(Aspergillusfumigatus Af293 ,NCBI GenBank:XM_742738.1)、Dfgna1(Dictyostelium fasciculatum,NCBI GenBank:XM_004367264.1)、Osgna1(Oryza sativa,NCBI GenBank:AY772189.1)进行枯草密码子优化后借由上海生工生物工程技术服务有限公司合成,见表3。

表1 本论文中使用的菌株和质粒Table 1 Strains and plasmids used in this chapter

表2 本研究所使用的引物Table 2 Oligonucleotides used in this study

表3 氨基葡萄糖乙酰化酶7种不同来源基因经枯草密码子优化优化后序列总表Table 3 Sequence table of glucosamine acetylase with 7 different source genes after codon optimization

续表3
1.1.2 试剂 常用试剂及试剂盒,均购于TaKaRa生物工程有限公司;玉米浆和酵母粉,分别购自山东西王食品和上海一品鲜生物科技有限公司。基因与引物合成、DNA测序等,由上海生工生物工程有限公司完成。
1.1.3 培养基与培养条件 发酵培养基成分为(g/L):玉米浆干粉 20,酵母粉 20,K2HPO4·3H2O 12.5,KH2PO42.5,CaCO35,微量元素 15 ml/L;pH7.5;微量元素溶液按 g/L 计含有:MnSO4·5H2O 1.0,CoCl2·6H2O 0.4,NaMoO4·2H2O 0.2,ZnSO4·7H2O 0.2,AlCl3·6H2O 0.1,CuCl2·H2O 0.1,H3BO40.05,含 5 mol/L HCl。
1.2 实验方法
1.2.1 菌株构建 分别使用相对引物扩增由上海生工生物工程有限公司合成的目的基因(如使用引物CeGna1-F和 CeGna1-R扩增出CeGna1基因)获得相应的目的片段,分别插入pP43NMK质粒中,获得重组质粒。重组质粒在Escherichia.coli JM109中扩增后转入目的菌株BSGN6-PxylA-glmS,获得重组菌株。通过菌落PCR验证筛选出阳性菌株,挑选的阳性菌株在含有100 μg/mL氨苄青霉素的LB培养基中37℃培养过夜,最后提取质粒进行酶切验证及测序鉴定。
1.2.2 3 L发酵罐补料分批发酵 将种子液以体积分数4%的接种量转接至装液量为1.5 L的3 L发酵罐中,通气量为1.5 vvm在37℃条件下培养,pH使用体积分数25%氨水和3 mol/L盐酸调节维持在7.4,发酵罐初始的搅拌转速为600 r/min,使用木糖其终质量浓度为5 g/L进行诱导在菌体OD600达到0.4时。培养基中含20 μg/mLKana,葡萄糖初质量浓度为20 g/L,葡萄糖发酵后8 h后开始流加,其质量浓度控制在5 g/L,每隔4 h取样分析。
1.2.3 蛋白质浓度测定 采用Bradford法测定蛋白质浓度,具体步骤详见蛋白浓度测定试剂盒说明书。
1.2.4 乙酰氨基葡萄糖HPLC测定方法 GlcNAc通过高效液相色谱法测定。高效液相色谱条件:检测器为示差折光检测器(RID);色谱柱为Aminex®HPX-87H,300 mm×7.8 mm 柱(250 mm×4.6 mm,5 μm),柱温为35℃;流动相为5 mmol/L硫酸;流速为0.6 mL/min;进样体积为10μL。样品处理方法:发酵液经12000 r/min离心4 min后,取适量上清液用超纯水稀释一定倍数,再将该样品稀释液用0.22 μm滤膜过滤。
1.2.5 重组氨基葡萄糖转移酶的分离与纯化 将重组菌株的单菌落分别接种于含相应抗性的LB培养基中,在37℃、200 r/min的条件下培养到OD600值为0.6,加入木糖(终质量浓度5 g/L)诱导后培养4 h。菌液在4℃ 下8 000 r/min离心后弃上清液,沉淀用100 mmol/L PBS(pH 7.5)洗涤3次,经750 W超声破碎 (工作强度60%)后离心收集上清液。
镍柱纯化操作方法:采用AKTA蛋白纯化仪,先用缓冲液 A (pH 7.4,20 mmol/L PBS,20 mmol/L咪唑,500 mmol/L NaCl)平衡镍柱,然后以1 mL/min流速进行上样;再用缓冲液A以1mL/min流速冲洗掉镍柱中没有结合蛋白质;最后,用缓冲液B(pH 7.4,20 mmol/L PBS,500 mmol/L 咪唑,500 mmol/L NaCl)以流速为1 mL/min进行梯度洗脱。纯化后通过酶活测定和SDS-PAGE鉴定重组目的蛋白质;纯化后的目的蛋白质用透析袋在20 mmol/L PBS(pH 7.4)中透析过夜,纯化后的重组酶保存于-80℃冰箱。
步入21世纪的中国,面临新的发展机遇和挑战。这十年是极不平凡的十年:战胜了2003年非典、2008年汶川地震等自然灾害等,经受了2008年金融危机考验,举办了第29届奥运会、第41届世博会。这十年也是中国成长的十年,一次次的经历增强了中华民族的凝聚力,同时也提升了中国的国际影响力。这期间党中央召开了十六大、十七大,更加坚定了改革开放的步伐。党的十六大向世人昭示了新世纪的中国举什么旗、走什么路、实现什么样的目标等重大问题,并围绕这些问题做了全方位的部署,大踏步向全面建成小康社会的目标迈进。党的十七大总结了改革开放的历史进程和经验,对深入贯彻科学发展观提出明确要求,将改革开放不断深入推进。
1.2.6 酶活测定 乙酰氨基葡萄糖合成酶酶活的检测具体方法如下[15]:50 μL反应体系包含50 mmol/L Tris-HCl (pH 7.5), 200 μmol/L GlcN-6-P,5 mmol/L MgCl2, 体积分数 10%甘油,200 μmol/L Ac-CoA 和10 μL样品 30°C反应 10 min后加入50 μL终止溶液,包括50mmol/LTris-HCl(pH7.5)及 6.4 mol/L盐酸胍;最后加入50 μL测量溶液,包括50 mmol/L Tris-HCl(pH 7.5),1 mmol/L EDTA 以及 5,5-二硫代双-2-硝基苯甲酸,产物可通过412 nm下的吸光度进行检测,从而计算乙酰氨基葡萄糖合成酶酶活。
氨基葡萄糖乙酰化酶酶活单位的定义为:在30℃下,每分钟催化合成1 μmol乙酰氨基葡萄糖所需的酶量定义为1个酶活单位,酶活单位为U/mL或U/mg。
1.2.7 实验数据分析方法 菌体比生长速率(specific growth rate)通过Origin软件模拟获得;底物GlcN-6P对重组酶Cegna1的抑制曲线由软件Graph Pad模拟获得,并得到抑制常数Ki;重组酶的米氏常数Km和催化常数Kcat的值通过Graph Pad模拟获得。
酶双底物反应机制分析方法:分别固定某一底物几个不同浓度(底物浓度不饱和),研究每个不同浓度下另一种底物对合成GlcNAc-6P含量的影响。如分别固定 Acetyl-CoA底物浓度为 50、100、500 mmol/L,测定这3个浓度下GlcN-6P底物浓度对合成GlcNAc-6P的影响。如果分别得到3条平行线则为乒乓反应机制,如果3条直线相交于一点,则为序列机制。所有数据由3次平行实验获得。
2 结果与分析
2.1 表达不同来源GNA对B.subtilis重组菌生产GlcNAc的影响
参照1.2.1步骤,获得重组质粒pP43-CeGna1、pP43-CaGna1、pP43-ScGna1、pP43-DfGna1、pP43-AfGna1、pP43-OsGna1、pP43-TbGna1。 重组质粒在E.coli JM109中扩增后转入出发菌株BSGN6-PxylA-glmS, 获得重组菌株 CeBSGN、CaBSGN、ScBSGN、DfBSGN、AfBSGN、OsBSGN和TbBSGN。如表1所示,上述菌株分别表达来源于Caenorhabditis elegans、Candida albicans 、S.cerevisiae、Dictyostelium fasciculatum、AspergillusfumigatusAf293、Oryzasativa、Trypanosoma brucei。
将7株重组菌进行摇瓶发酵,并检测GlcNAc的产量,摇瓶发酵48 h,各重组菌株发酵产乙酰氨基葡萄糖的情况如图1所示。重组菌株CeBSGN中GlcNAc 的 产 量 比 CaBSGN、ScBSGN、DfBSGN、AfBSGN、OsBSGN和 TbBSGN,分别高 26.23%、25.43%、53.32%、83.37%、110.39%、92.19%。 综上所述,重组菌CeBSGN6对目的产物GlcNAc的合成效果最佳。重组菌株CeBSGN中GlcNAc的产量最高,达到7.31 g/L。

图1 不同重组菌株摇瓶发酵产GlcNAc产量比较Fig.1 Comparison of different recombinant strains for GlcNAc shaking flask fermentation production
将7株重组菌进行摇瓶发酵培养,每4 h取一次样并检测残糖质量浓度,摇瓶发酵48 h,各重组菌株发酵残糖情况如图2所示。摇瓶发酵初始葡萄糖质量浓度为20 g/L,在整个发酵过程中,葡萄糖被迅速消耗,重组7株菌株均在16 h左右将葡萄糖耗光,平均耗糖速率为1.25 g/L。从图2中可以发现7株重组菌株在对碳源葡萄糖的消耗上情况较为一致。
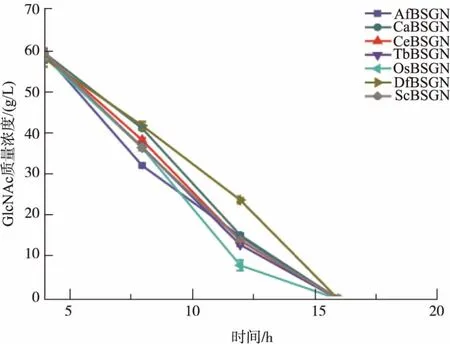
图2 不同重组菌株葡萄糖消耗情况比较Fig.2 Comparison of different recombinant strains for glucose consumption
7株重组菌摇瓶发酵细胞生长情况如图3所示。从图3(a)中可以看出,在整个发酵过程中,重组7株菌株细胞干重在0~16 h增长趋势较快,16 h后随着葡萄糖的耗尽,细胞干重开始下降。7株重组菌株细胞干重均在16 h左右达到最大值。经计算,7株重组菌株中CeBSGN目标产物GlcNAc对细胞得率(YGlcNAc/X)最高,最大值为 1.12。
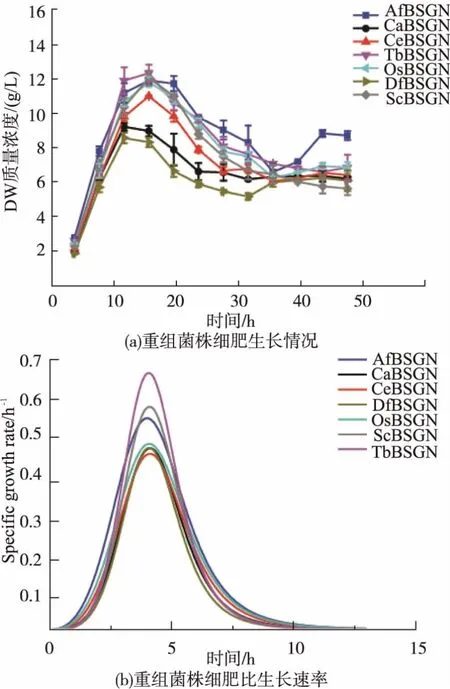
图3 不同重组菌株细胞生长情况和比生长速率Fig.3 Cell growth and specific growth rate for different recombinant strains
7株重组菌株在对碳源葡萄糖的消耗上情况较为一致,虽然重组菌株CeBSGN相比较6株菌株,发酵生产CeBSGN的产量最大,产物GlcNAc对细胞得率最高,但是从图3(b)中可发现,在细胞生长对数期菌株CeBSGN的比生长速率相比较却低于其他6种重组菌株。很多微生物的目标代谢产物一般都是在进入稳定期后才开始大量的合成与分泌,比生长速率与微生物的生命活动有关,如果菌体在对数期比生长速率过大,菌体量增加过多,代谢向菌体合成的方向发展,反而不利于目的产物的累积[23]。由此可以推断,在相同碳源利用率的情况下,重组菌株CeBSGN比生长速率相对较小,目标产物GlcNAc对细胞得率较高,代谢更易于向目标产物GlcNAc合成的方向发展,从而更有利于产物的合成。
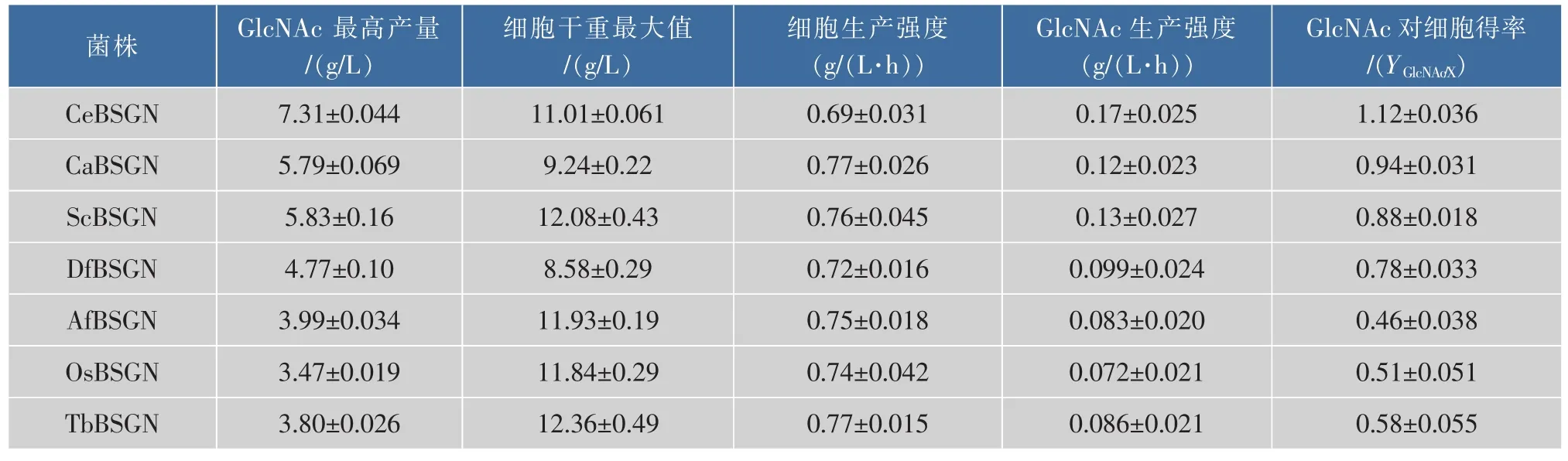
表4 7株重组菌株生产GlcNAc的摇瓶发酵动力学参数比较Table 4 Comparison of GlcNAc shaking flask fermentation parameters on seven recombinant strains
进一步对7株重组菌株的发酵动力学参数进行测定,结果如表4所示,重组菌株CeBSGN的葡萄糖最高产量出现在45 h左右,最高产量为19.43 g/L,重组菌株CeBSGN6乙酰氨基葡萄糖最高产量出现在35 h,最高产量为24.23 g/L,较对照菌株提高了24.69%。GlcNAc生产强度和GlcNAc对细胞得率均高于其他6株菌株;但是对比细胞生产强度,重组菌株CeBSGN却低于其他菌株。上述数据分析进一步验证了重组菌株CeBSGN葡萄糖的消耗较其他六株重组菌株更多的用于产物GlcNAc的合成而非菌体量的增加,再一次验证了重组菌CeBSGN6能够更好地合成目的产物GlcNAc。
在摇瓶上进行初步筛选,获得重组菌株CeBSGN最高GlcNAc产量达到7.31 g/L,为进一步验证GlcNAc的产量,将重组菌株CeBSGN和对照菌株ScBSGN在3 L罐进行上补料分批发酵,发酵过程曲线如图4所示。对照菌株ScBSGN6乙酰氨基

图4CeBSGN6和ScBSGN6 3 L罐GlcNAc产量比较Fig.4 Comparison of CeBSGN and ScBSGN for GlcNAc production in 3 L fermentor
在维持葡萄糖质量浓度为5 g/L不变的情况下进行补料分批发酵,重组菌株CeBSGN和对照菌株ScBSGN发酵动力学参数如表5所示,重组菌株CeBSGN的细胞生产强度是对照菌株ScBSGN的3.82倍、GlcNAc生产强度是对照菌株ScBSGN的1.69倍、GlcNAc对细胞得率是对照菌株ScBSGN的2.53倍。综上所述,表达了重组酶Cegna1的重组菌株CeBSGN能够更好的利用葡萄糖合成目的产物GlcNAc。
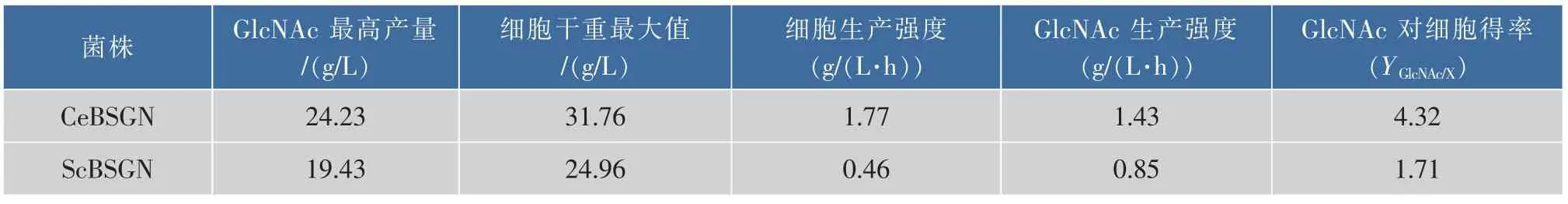
参数 表5 7株重菌株组菌株CeBSGN6和ScBSGN6生产GlcNAc的上罐发酵动力学参数比较Table 5 Comparison of GlcNAc shaking flask fermentation parameters on recombinant CeBSGN and ScBSGN
2.2 重组氨基葡萄糖乙酰转移酶的分离纯化及动力学分析
按1.2.4的方法对重组氨基葡萄糖乙酰转移酶进行分离与纯化,将纯化后的蛋白按1.2.5的方法进行酶活测定,情况如图5,重组菌株菌株CeBSGN的 Cegna1比酶活为 208.33 U/mg,比 CaBSGN、ScBSGN、Df BSGN、AfBSGN、OsBSGN、TbBSGN 分别高了 31.56%、28.29%、137.68%、198.08%、338.87%、344.20%。综上,重组菌CeBSGN6中的重组酶Cegna1的催化效率最佳。
重组氨基葡萄糖乙酰转移酶具体动力学参数如表6所示,Cegna1米氏常数Km相对小于其他6株重组菌株,而对应的催化效率Kcat/Km却相对高于其他6株菌株。Helge C.Dorfmueller等人[17]已解析Cegna1的晶体结构,并发现Cegna1的空间位阻较小,底物更容易和酶的催化活性中心结合,并且2个底物GlcN-6P和Ac-CoA与活性中心形成多个氢键,更容易结合到活性中心。因此,重组Cegna1相比较其他六种重组酶均对GlcN-6P和Ac-CoA有较高的亲和力和催化效率。

图5 重组菌株GNA比酶活对比Fig.5 Comparison of recombinant strains GNA enzyme activity
对7株表达不同来源GNA的B.subtilis重组菌株进行筛选,发现表达了重组酶Cegna1的重组菌株CeBSGN能够更好的利用葡萄糖合成目的产物GlcNAc,并且重组Cegna1相比较其他6种重组酶对GlcN-6P和Ac-CoA有较高的亲和力和催化效率。因此,我们对筛选出的重组酶Cegna1进行酶学性质分析,以便为应用定向进化策略改造GNA的实现提供了理论依据。
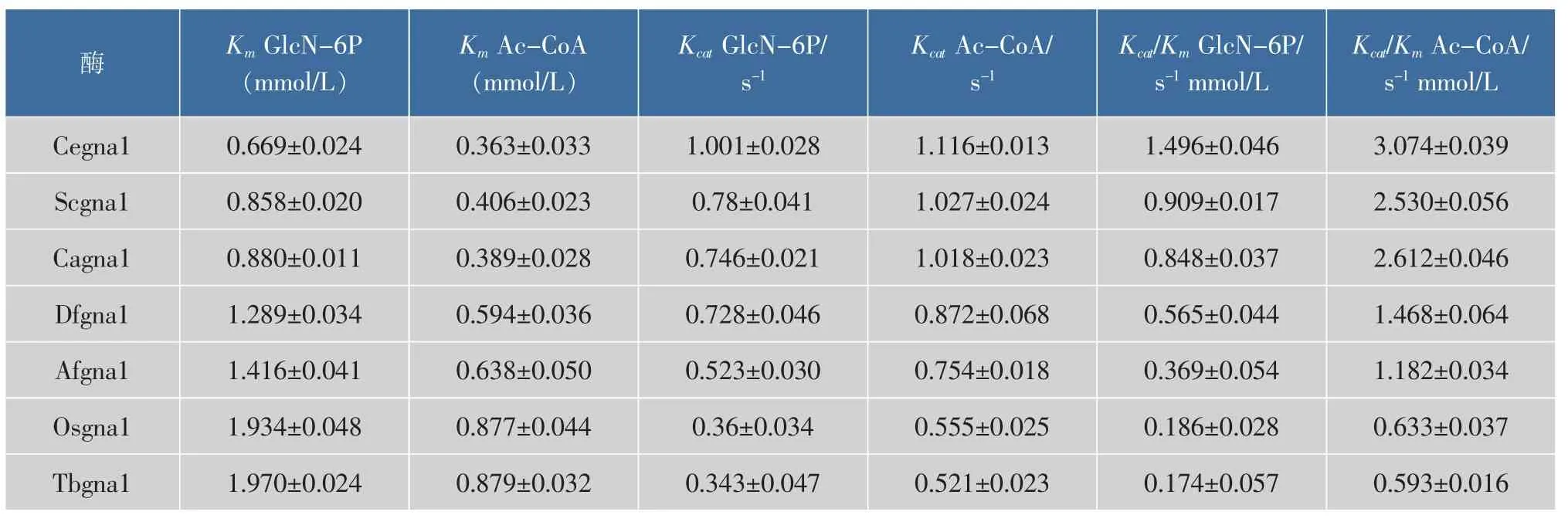
表6 重组菌株GNA动力学参数Table 6 Kinetic parameters of recombinant strains GNA
2.3 重组Cegna1酶学性质
2.3.1 重组Cegna1最适反应时间 50 mmol/L Tris缓冲液(pH 7.5)中,测定Cegna1在酶活反应0~10 min之间催化酶活力,以反应时间为5 min时的酶活力为相对酶活100%。由图6可知,在反应0~2 min,酶活随时间延长而迅速升高,在5~6 min,Cegna1催化效率最大,相对酶活可达到103%,在6~10 min,催化效率略有下降,基本能保持稳定。

图6 重组Cegna1酶活随反应时间的变化Fig.6 Influence of reaction time on enzyme activities of recombinant Cegna1
2.3.2 重组Cegna1最适反应温度 50 mmol/L Tris缓冲液(pH 7.5)中,测定Cegna1在10~90℃之间催化酶活力,以初始温度30℃时的酶活力为相对酶活100%。从图7可得:当温度低于37℃时,催化效率随温度的升高而快速增加;当反应温度为37℃时,催化效率最大;当温度在37~50℃时,催化效率迅速降低;当反应温度在50~90℃时,酶活基本维持在65%。
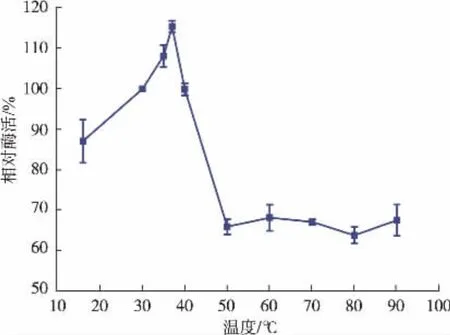
图7 重组Cegna1酶活随反应温度的变化Fig.7 Influence of reaction temperature on enzyme activities of recombinant Cegna1
2.3.3 重组Cegna1最适反应PH 以不同pH的缓冲液 (pH 3~10,50 mmol/L Tris缓冲液)稀释Cegna1酶液与底物至设定 pH,测定Cegna1催化活力,以初始PH 7.5时的酶活力为相对酶活100%。由图8可知,在PH值3~10的范围内,重组Cegna1均能保持75%以上的活性,具有较宽的PH适应范围,最适反应PH为7。在酸性条件下,催化效率随着PH值下降而迅速降低;在碱性条件下,催化效率随PH值升高而下降较缓,PH为10时,仍保留着较高酶活,表明重组Cegna1相对酸性环境在碱性环境中更加稳定。

图8 重组Cegna1酶活随反应PH的变化Fig.8 Influence of reaction PH on enzyme activities of recombinant Cegna1
2.3.4 重组Cegna1热稳定性分析 将酶液在不同温度下保温不同时间,迅速冷却,pH 7.5,30℃测定残余Cegna1酶活,以未保温的酶活力为相对酶活100%,计算相对酶活力。由图9可知,在4℃和30℃条件下Cegna1具有最大的催化活性,低温下仍能保持较高酶活热稳定均没有什么明显变化;当温度超过30℃时,催化效率随温度的升高而迅速降低。40℃,100 min内Cegna1能保持 80%以上的活性,而在 60℃条件下,100 min内 Cegna1仍能保持45%以上的酶活。
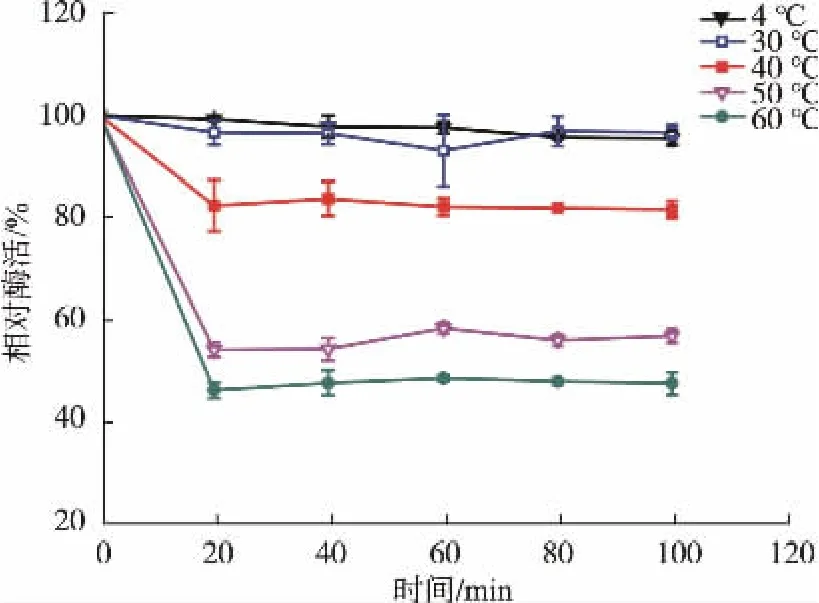
图9 重组Cegna1热稳定性Fig.9 thermostability on enzyme activities of recombinant Cegna1
2.3.5 Cegna1的反应动力学的研究 为了研究重组Cegna1的反应动力学,分别以Acetyl-CoA和GlcN-6P为底物,固定一种底物浓度(如Acetyl-CoA)的情况下研究不同浓度的另一种底物(如GlcN-6P)对GlcNAc合成的影响。通过不同底物浓度测定重组Cegna1的酶活,最终获得Lineweaver-Burk双倒数(图10所示)。从图中可以看出,固定不同浓度的一种底物的情况下,不同浓度的另一底物的倒数为横坐标,对应的GlcNAc合成速率倒数为纵坐标,拟合得到的直线相交于一点,进一步进行数据拟合,发现其符合序列机制的底物动力学方程1,双底物反应机制为序列反应。
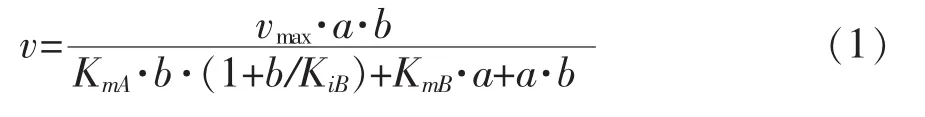
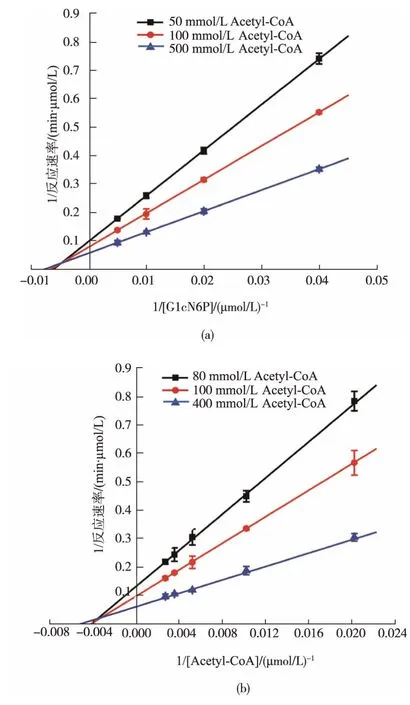
图10 重组Cegna1催化生产GlcNAc-6P的Lineweaver-Burk双倒数曲线Fig.10 Lineweaver-Burk plots of the GlcNAc-6P biosynthesis by the recombinant Cegna1
2.3.6 底物与产物对重组Cegna1抑制分析 为了研究底物Acetyl-CoA和 GlcN-6P与产物GlcNAc对的抑制情况,固定Acetyl-CoA和GlcN-6P底物浓度为200 μmol/L,分别向反应体系中加入0~60 mmol/L的添加物Acetyl-CoA、GlcN-6P和GlcNAc,结果如图 11所示。 由图11(a)可得,GlcNAc和Acetyl-CoA对重组Cegna1无明显抑制作用;由图11(b)可得,底物GlcN-6P对重组Cegna1的抑制作用明显,5 mmol/L GlcN-6P已可对重组Cegna1的造成明显抑制作用,采用GraphPad Prism计算抑制常数Ki值,求得重组Cegna1 对 GlcN-6P 的 Ki值为(1.880±0.472) mmol/L,下一步可采用定向进化策略改造Cegna1,解除底物GlcN-6P对重组Cegna1的抑制作用。

图 11 GlcNAc、Acetyl-CoA(a)及 GlcN-6P (b)对重组Cegna1的抑制情况Fig.11 Inhibition of Cegna1 activity with increasing concentrations of GlcNAc,Acetyl-CoA (a)and GlcN-6P(b).
3 结 语
本文通过在枯草芽孢杆菌中异源表达7种不同来源的氨基葡萄糖乙酰化酶,筛选出秀丽隐杆线虫来源的氨基葡萄糖乙酰化酶(Cegna1)能够更有效的积累乙酰氨基葡萄糖摇瓶水平上产量达到7.31 g/L,相较于过量表达来源于酿酒酵母的氨基葡萄糖乙酰化酶编码基因的对照菌株,GlcNAc的产量提高了24.51%。在3 L发酵罐中,GlcNAc产量达到24.23 g/L,相较于对照菌株GlcNAc的产量提高了24.69%。进一步研究7株重组酶的动力学参数米氏常数Km与 Kcat/Km发现重组Cegna1相比较其他6种重组酶均对GlcN-6P和Ac-CoA有较高的亲和力和催化效率。对筛选出的重组Cegna1酶学性质进行研究发现重组Cegna1最适反应时间为5~6 min,最适反应温度为37℃,最适反应PH为7,热稳定性良好,双底物反应机制为序列反应。最后发现底物GlcN-6P对重组Cegna1的抑制作用明显,下一步可采用定向进化策略改造Cegna1,解除底物GlcN-6P对重组Cegna1的抑制作用。
