靶向TLR4的siRNA慢病毒感染减少过氧化氢诱导的心肌H9C2细胞凋亡及氧化损伤
2019-04-12孙红梅
李 飞 周 静 孙红梅 赵 莉 张 鹏 高 峰
(延安大学附属医院心内科,延安716000)
缺氧缺血心脏疾病已经成为威胁人类生命健康的主要因素之一,其主要是由动脉狭窄、动脉阻塞等引起的,其发病机制与心肌细胞氧化损伤有关。在缺氧缺血心脏疾病发生时,心肌细胞产生大量的氧自由基,同时细胞中抗氧化酶活性降低,导致细胞膜上的脂质发生过氧化,引起细胞膜通透性的改变,引起细胞功能和结构的破坏,诱导细胞凋亡的发生[1-3]。Toll样受体4(Toll-like receptor-4,TLR4)作为一种模式识别受体,其与配体结合以后可以激活下游信号通路,调控细胞的多种生物学特性,其在淋巴细胞、上皮细胞等几乎所有细胞中都有表达,参与过敏性疾病、心血管系统等疾病的发生[4]。有研究表明,TLR4参与缺氧缺血心脏疾病的发生,在缺氧缺血心肌组织中表达异常升高[5,6]。本实验用心肌H9C2细胞作为体外研究对象,通过用H2O2处理构建心肌H9C2细胞氧化损伤模型,通过慢病毒感染沉默心肌H9C2细胞中TLR4的表达,探讨TLR4对氧化应激条件下的心肌H9C2细胞凋亡、氧化损伤及炎症因子释放水平的影响,以期为明确TLR4在缺氧缺血心脏疾病中的作用提供依据。
1 材料与方法
1.1材料 绿色荧光蛋白和嘌呤霉素标记的siRNA 阴性对照慢病毒、TLR4 siRNA慢病毒由上海吉凯合成,TLR4 siRNA 序列为:CCCTCCATAGACTTCAATTAT;丙二醛(Malonaldehyde,MDA)含量测定试剂盒、IL-6含量测定试剂盒、超氧化物歧化酶 (Superoxide orgotein dismutase,SOD)活性检测试剂盒为碧云天产品;肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)含量测定试剂盒、乳酸脱氢酶(Lactate dehydrogenase,LDH)含量测定试剂盒,活性氧(Reactive oxygen species,ROS)含量测定试剂盒为南京建成生物研究所产品;剪切型Caspase-3(Cleaved Caspase-3)抗体、TLR4抗体、Bcl-2相关X蛋白(Bcl-2 Associated X Protein,Bax)抗体购自美国Abcam。
1.2方法
1.2.1细胞分组处理 心肌H9C2细胞用含有10%胎牛血清的DMEM培养,培养液中含有100 U/ml的青霉素及100 μg/ml的链霉素,细胞放在37℃,5%CO2培养箱中培养。心肌H9C2细胞用含有200 μmol/L 的H2O2溶液培养12 h作为H2O2组,同时将TLR4 siRNA慢病毒感染后的心肌H9C2细胞以200 μmol/L的H2O2溶液培养12 h作为si-TLR4组,把siRNA 阴性对照慢病毒感染后的心肌H9C2细胞以200 μmol/L的H2O2溶液培养12 h作为si-NC组,把未经处理的正常培养的心肌H9C2细胞作为Control组。慢病毒感染方法如下:心肌H9C2细胞接种到6孔细胞培养板内,每个孔中加入105个细胞,细胞融合度为60%时,分别用siRNA 阴性对照慢病毒、TLR4 siRNA慢病毒以MOI=60感染细胞,24 h以后,换液,用嘌呤霉素筛选沉默TLR4的细胞株,继续培养3 d。荧光显微镜下观察细胞感染效率超过85%。
1.2.2qRT-PCR检测TLR4在H2O2处理以后的心肌H9C2细胞中的表达 取H2O2组、Control组心肌H9C2细胞,按照上述方法处理以后,用PBS将各组细胞洗涤2次。加入Trizol提取细胞中的总RNA。用DEPC水将RNA溶解以后,进行逆转录。逆转录条件为:37℃,15 min;85℃,5 s;4℃ 10 min。取各组cDNA,进行qRT-PCR,PCR程序为:95℃,15 s;60℃,60 s;共40个循环,以β-actin作为内参。引物序列如下:TLR4上游5′-ACCTGTCCCTGAACCC-TATGAA-3′,下游5′-CTTCTAAACCAGCCAGACC-TTG-3′。β-actin上游5′-ACCACAGTCCATGCCAT-CAC-3′,下游5′-TCCACCACCCTGTTGCTGTA-3′。
1.2.3Western blot检测TLR4在H2O2处理以后的心肌H9C2细胞中的表达 取H2O2组、Control组心肌H9C2细胞,提取细胞中的总蛋白,保存在-80℃。蛋白样品用BCA法测定浓度。蛋白电泳:10%分离胶、5%积层胶,蛋白样品同等体积的2×Loading Buffer混匀,放置在100℃反应5 min,每个泳道中添加40 μg蛋白样品,电压为90 V,电泳约2.5~3 h,直到溴酚蓝到达底部边缘1 cm后,停止电泳。将蛋白凝胶取出以后,调整200 mA电流进行转膜,时间约为80 min。取出NC膜,用5%牛血清白蛋白置于室温条件下孵育1.5 h。再将膜置于含有1∶800 稀释的TLR4一抗、1∶1 000稀释的β-actin一抗中,置于4℃摇晃过夜。NC膜再与1∶3 000稀释的二抗在室温摇晃孵育2 h以后,ECL发光。以Quantity One软件分析各个条带灰度值,用目的条带灰度值与β-actin灰度值的比值记为目的蛋白表达水平。
1.2.4qRT-PCR和Western blot检测慢病毒感染后心肌H9C2细胞中TLR4表达 取H2O2组、si-NC组、si-TLR4组细胞,依照上述方法处理以后,用qRT-PCR和Western blot检测细胞中TLR4表达水平,检测慢病毒对H2O2处理以后心肌H9C2细胞中TLR4沉默效果。步骤同1.2.2和1.2.3。
1.2.5流式细胞术检测心肌H9C2细胞凋亡 Control组、H2O2组、si-NC组、si-TLR4组细胞按照上述方法处理以后,收集细胞,用4℃预冷的PBS将细胞洗涤2次以后,在细胞沉淀中加入400 μl的结合缓冲液重悬细胞,再加入5 μl碘化丙啶(Propidium iodide,PI)、5 μl膜联蛋白 V-FITC(Annexin V-FITC),将细胞置于避光中反应20 min,再添加100 μl缓冲液,立即用流式细胞仪检测细胞凋亡。
1.2.6Western blot检测细胞中Bax、Cleaved Caspase-3蛋白水平 Control组、H2O2组、si-NC组、si-TLR4组细胞按照上述方法处理以后,用Western blot检测细胞中Bax、Cleaved Caspase-3蛋白水平,步骤同1.2.3。
1.2.7MDA、SOD、LDH、ROS水平检测 Control组、H2O2组、si-NC组、si-TLR4组细胞按照上述方法处理以后,收集培养液上清及细胞,用硫代巴比妥酸法检测细胞中MDA水平,黄嘌呤氧化法检测细胞中SOD活性,二硝基苯肼显色法检测上清中LDH含量,二氯二氢荧光素-乙酰乙酸酯(DCFH-DA)法检测ROS水平,步骤同试剂盒说明书。
1.2.8细胞培养液中TNF-α、IL-6水平检测 Control组、H2O2组、si-NC组、si-TLR4组细胞按照上述方法处理以后,收集培养液上清,用ELISA法检测培养液上清中TNF-α、IL-6水平,步骤同试剂盒说明书。
2 结果
2.1H2O2诱导心肌H9C2细胞中TLR4表达 Control组、H2O2组细胞中TLR4 mRNA水平依次为:1.00、2.64±0.28,TLR4蛋白水平依次为:0.25±0.03、0.63±0.05。H2O2处理以后的心肌H9C2细胞中TLR4 mRNA和蛋白水平均明显升高,H2O2诱导心肌H9C2细胞中TLR4的表达和转录。见表1和图1。
2.2TLR4 siRNA慢病毒感染降低H2O2处理后的心肌H9C2细胞中TLR4的表达 H2O2组、si-NC组、si-TLR4组细胞中TLR4 mRNA水平依次为:1.00、1.00±0.12、0.10±0.06,TLR4蛋白水平依次为:0.71±0.08、0.72±0.06、0.15±0.03。心肌H9C2细胞感染TLR4 siRNA慢病毒以后,经H2O2诱导,细胞中TLR4 mRNA和蛋白水平均明显降低,说明TLR4 siRNA慢病毒感染成功下调了心肌H9C2细胞中TLR4的表达水平。见表2和图2。
2.3沉默TLR4减少H2O2诱导的心肌H9C2细胞凋亡 Control组、H2O2组、si-NC组、si-TLR4组细胞凋亡率依次为:(4.13±0.52)%、 (28.32±2.31)%、(27.96±3.45)%、(20.14±1.58)%,Cleaved Casp-ase-3蛋白水平依次为:0.15±0.02、0.36±0.03、0.35±0.06、0.23±0.04,Bax蛋白水平依次为:0.25±0.03、0.47±0.05、0.49±0.06、0.38±0.04。H2O2处理以后的心肌H9C2细胞中Bax蛋白、Cleaved Caspase-3蛋白和细胞凋亡率明显升高,H2O2诱导心肌H9C2细胞凋亡。沉默TLR4可以减少H2O2条件下心肌H9C2细胞中Bax蛋白、Cleaved Caspase-3蛋白表达,降低细胞凋亡率,提示沉默TLR4可以减少H2O2诱导的心肌H9C2细胞凋亡。见表3和图3。

表1 H2O2处理后的心肌H9C2细胞中TLR4表达变化
Note:Compared with Control,1)P<0.05.
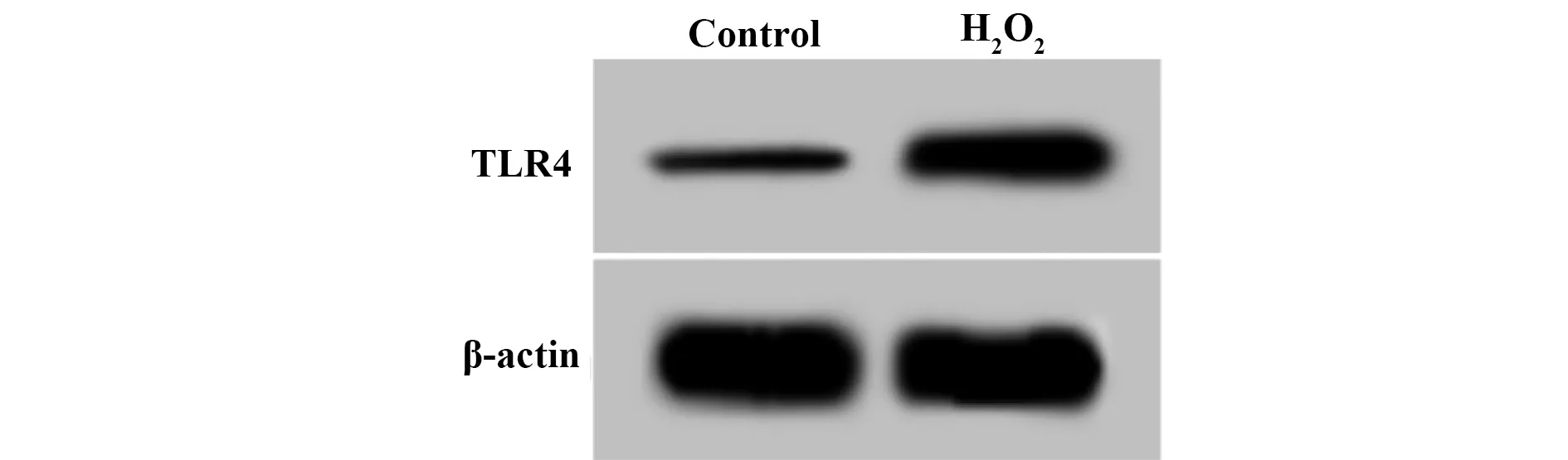
图1 Western blot测定H2O2处理后的心肌H9C2细胞中TLR4的表达Fig.1 Western blot determination of TLR4 expression in cardiac myocytes after H2O2 treatment

表2 各组心肌H9C2细胞中TLR4表达变化
Note:Compared with H2O2,1)P<0.05.
2.4沉默TLR4抑制H2O2诱导的心肌H9C2细胞氧化损伤 Control组、H2O2组、si-NC组、si-TLR4组细胞MDA水平依次为:(10.59±1.36)、(17.82±1.23)、(17.22±1.63)、(13.54±1.05)μmol/mg,SOD水平依次为:(41.36±3.28)、(26.58±2.69)、(26.74±3.26)、(34.16±2.17)U/ml,LDH水平依次为:(85.46±8.73)、(145.37±12.98)、(145.72±10.87)、(120.86±11.64)U/L。H2O2处理以后的心肌H9C2细胞中MDA水平升高,同时细胞中SOD活性下降,细胞培养液中的LDH水平明显升高,提示H2O2可以诱导心肌H9C2细胞脂质过氧化,造成细胞氧化损伤。沉默TLR4后的心肌H9C2细胞经H2O2诱导处理以后,细胞中MDA水平降低,SOD活性升高,细胞培养液中LDH水平降低,提示沉默TLR4可以减轻H2O2诱导的心肌H9C2细胞氧化损伤。见表4。
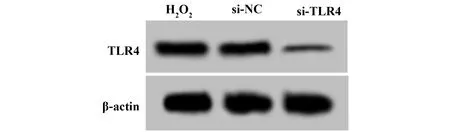
图2 Western blot检测TLR4 siRNA对心肌H9C2细胞中TLR4蛋白表达影响Fig.2 Western blot to detect effect of TLR4 siRNA on expression of TLR4 protein in cardiac myocytes

表3 各组心肌H9C2细胞凋亡率和Bax、Cleaved Caspase-3蛋白水平变化
Note:Compared with Control,1)P<0.05;compared with H2O2,2)P<0.05.
2.5沉默TLR4减少H2O2诱导的心肌H9C2细胞中ROS积累 Control组、H2O2组、si-NC组、si-TLR4组ROS水平依次为:9.65±0.82、32.74±2.98、32.11±2.56、18.52±1.71。H2O2处理以后的心肌H9C2细胞ROS水平升高,提示H2O2可以诱导心肌H9C2细胞中ROS的积累。沉默TLR4后的心肌H9C2细胞经H2O2诱导处理以后,细胞中ROS水平降低,提示沉默TLR4可以减少H2O2诱导的心肌H9C2细胞中ROS的积累。见表5。
2.6沉默TLR4减少H2O2诱导心肌H9C2细胞分泌TNF-α、IL-6 Control组、H2O2组、si-NC组、si-TLR4组TNF-α水平依次为:(1.45±0.12)、(2.96±0.31)、(2.94±0.25)、(2.15±0.15)μg/L,IL-6水平依次为:(54.26±4.17)、(142.01±12.36)、(140.58±13.86)、(99.75±10.25)pg/ml。H2O2处理以后的心肌H9C2细胞培养液中TNF-α、IL-6水平升高,提示H2O2可以诱导心肌H9C2细胞分泌炎症因子。沉默TLR4后的心肌H9C2细胞经H2O2诱导处理以后,细胞培养液中TNF-α、IL-6水平降低,提示沉默TLR4可以减少H2O2诱导的心肌H9C2细胞分泌炎症因子。见表6。
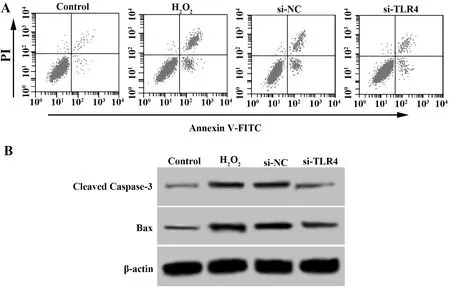
图3 沉默TLR4减少 H2O2诱导的心肌H9C2细胞凋亡Fig.3 Silencing TLR4 reduces H2O2 induced cardiomyo-cyte apoptosisNote: A.Flow cytometry was used to detect the apoptosis of cardiac myocytes;B.Detection of apoptosis related protein Bax and Cleaved Caspase-3 protein in cardiac myocytes by Western blot.

表4 各组心肌H9C2细胞中MDA、SOD及培养液中LDH水平变化
Note:Compared with Control,1)P<0.05;compared with H2O2,2)P<0.05.

表5 各组心肌H9C2细胞中ROS水平变化
Note:Compared with Control,1)P<0.05;compared with H2O2,2)P<0.05.

表6 各组心肌H9C2细胞分泌TNF-α、IL-6变化
Note:Compared with Control,1)P<0.05;compared with H2O2,2)P<0.05.
3 讨论
TLR4是被第一个发现的TLR相关蛋白,参与机体的固有免疫应答,其在病原体识别、细胞程序性死亡分子结构识别等过程中具有重要作用,TLR4的分布极为广泛,在巨噬细胞、内皮细胞等中均有表达,参与肿瘤、缺血再灌注、免疫相关疾病等的发生[7-10]。很多研究表明,TLR4在缺血再灌注心肌组织中高表达,参与缺血再灌注早期和晚期炎症损伤和心肌细胞功能损伤,其可以促进心肌细胞炎症反应,阻碍心肌组织正常功能的发挥[11,12]。基因敲除TLR4后的小鼠心肌梗死的面积明显减小,TLR4基因敲除的小鼠较野生型的小鼠心功能改善程度较好,这些研究结果均提示,TLR4参与缺血缺氧心脏损伤[13,14]。
缺血缺氧心脏损伤的发病机制与氧化应激有关,缺血缺氧可以诱导心肌组织中产生大量的氧自由基,这些氧自由基过度积累导致细胞中脂质发生过氧化,引起细胞膜的通透性发生改变,使得原本存在于细胞内的LDH外漏至细胞外[15]。脂质发生过氧化的产物之一是MDA,检测MDA水平可以间接反映细胞中脂质发生过氧化的程度[16]。SOD是细胞中的氧自由基清除剂,其可以清除细胞中过量的氧自由基,维持细胞氧化平衡[17]。本次研究表明,H2O2诱导心肌H9C2细胞中MDA水平和细胞培养液中LDH水平升高,降低细胞中SOD活性,促进细胞中ROS合成,而沉默TLR4可以逆转H2O2对心肌H9C2细胞的上述作用,TLR4沉默可以减轻心肌H9C2细胞氧化损伤,提高抗氧化酶活性,TLR4可能参与心肌H9C2细胞氧化损伤过程。
心肌细胞过度凋亡与缺血缺氧心脏疾病发生有关,缺氧缺血诱导心肌细胞凋亡。研究表明,细胞内过量的ROS可以激活细胞内凋亡信号的传导,诱导细胞中Caspase-3的活化,促进心肌细胞中Bax的表达,促进细胞凋亡的发生[18,19]。缺氧缺血心脏疾病还与炎症反应有关,细胞受到氧化损伤又可以诱导细胞释放炎症因子,TNF-α、IL-6是重要的免疫调节因子,参与细胞炎症反应,在缺氧缺血心脏损伤中含量增加[20-22]。TLR4参与细胞凋亡、炎症反应等过程,在肾小管上皮细胞、巨噬细胞、血管内皮细胞中均已证实[23-25]。本实验的结果显示,沉默TLR4可以减少H2O2诱导的心肌H9C2细胞凋亡,降低细胞中Bax、Cleaved Caspase-3蛋白水平和细胞分泌炎症因子,沉默TLR4可能通过抑制细胞凋亡和炎症减轻心肌H9C2细胞氧化损伤。
TLR4参与氧化应激条件下的心肌H9C2细胞功能发挥,沉默TLR4可以减轻心肌H9C2细胞氧化损伤,减少细胞炎症反应和细胞凋亡,本实验明确了TLR4在氧化应激条件下心肌H9C2细胞凋亡、炎症反应、氧化损伤中的作用,为以后研究缺氧缺血心肌损伤提供了坚实基础,其调控细胞凋亡、炎症等的具体作用机制还需要在以后的实验中继续探索。