三药联合方案治疗晚期转移性结直肠癌的疗效和安全性比较
2019-04-11张音洁王晰程李健张小田陆明龚继芳高静鲁智豪周军彭智齐长松李艳艳沈琳
张音洁 王晰程 李健 张小田 陆明 龚继芳 高静 鲁智豪 周军 彭智 齐长松 李艳艳 沈琳
结直肠癌是消化系统常见恶性肿瘤之一,其发病率和死亡率在全球分别位于第3位和第2位,在中国亦呈逐年上升趋势[1]。对于晚期转移性结直肠癌(metastatic colorectal cancer,mCRC)患者,主要的治疗手段是全身化疗。5-氟尿嘧啶(5-FU)是结直肠癌的基础化疗药物,在此基础上联合伊立替康或奥沙利铂成为该病的一线标准方案,其客观缓解率(objective response rate,ORR)为39%~57%,无疾病进展时间(progression-free survival,PFS)为6.7~8.7个月,总生存(overall survival,OS)为15.6~22 个月。为进一步提高疗效及延长患者生存,国外研究开始使用5-FU/亚叶酸(leucovorin,LV)联合奥沙利铂和伊立替康的三药化疗(FOLFOXIRI)方案。几项比较FOLFOXIRI方案与标准两药化疗的Ⅲ期临床试验显示前者具有更高的ORR,显著提高了PFS及OS,且不良反应在可控范围内[2]。但FOLFOXIRI 方案主要缺点是必须每2 周连续输注5-FU,持续静脉给药会增加静脉炎及中心静脉置管相关并发症发生。卡培他滨是一种口服5-FU 前体药物,用于模拟5-FU 持续输注,在mCRC的一线治疗中与输注5-FU/LV疗效相当,具有优异的安全性,且使用方便。因此,采用卡培他滨替代输注5-FU 的CAPRINOX 方案可以减少FOLFOXIRI方案中使用的中心静脉导管相关并发症。此前有多项Ⅰ/Ⅱ期CAPRINOX 方案的临床研究提示,其作为不可切除mCRC 的一线治疗具有可行性和有效性[3-6]。但是,关于三药的临床研究大都针对西方人群,在亚洲人群中研究报道较少。因此,为探讨最佳治疗模式,进一步探索三药联合方案在临床中应用更加安全可行,本研究回顾性分析采用FOLFOXIRI方案对比CAPRINOX 方案治疗mCRC 的临床疗效和安全性。
1 材料与方法
1.1 临床资料
纳入标准:1)经病理确认、外科认为不可切除的mCRC;2)年龄18~75岁;3)美国东部肿瘤协作组(ECOG)评分≤2分;4)具备实体瘤的疗效评价标准(RECIST)1.1标准中的可测病灶;5)预计生存期>3个月;6)骨髓、心脏、肝脏及肾脏功能尚可。排除标准:1)此前已接受过姑息治疗;2)辅助放、化疗结束时间≤12个月;3)炎症性肠病及全结肠切除。研究纳入北京大学肿瘤医院2013年1月至2018年11月收治患者共73例。其中45例采用FOLFOXIRI方案治疗,包括男性30例、女性15例;年龄30~65 岁,平均年龄(50.7±9.3)岁,中位年龄53岁。28例采用CAPRINOX方案进行化疗,包括男性13例、女性15例;年龄28~66岁,平均年龄(54.7±10.5)岁,中位年龄56.5岁。两组患者一般资料比较,差异均无统计学意义(P>0.05,表1)。
1.2 方法
1.2.1 基因检测 73 例患者中有69 例接受KRAS、NRAS、BRAF 基因检测,所有患者均接受UGT1A1 基因检测。
1.2.2 治疗方法 FOLFOXIRI 组:第1 天,伊立替康150 mg/m2溶于250 mL 的0.9%生理盐水中静滴大于1 h;续接奥沙利铂85 mg/m2溶于5%葡萄糖溶液250 mL;LV 200 mg/m2溶于5%葡萄糖溶液250 mL,通过三通管持续静脉滴注2 h;续接5-FU 2 800 mg/m2,从第1天起持续静脉泵入48 h。该组有1例患者联用贝伐珠单抗,第1天,5 mg/kg溶于0.9%生理盐水100 mL中静滴。

表1 两组基线特征的比较 例(%)
CAPRINOX组:第1天,伊立替康150 mg/m2溶于250 mL的0.9%生理盐水中静滴大于1 h;续接奥沙利铂85 mg/m2溶于5%葡萄糖溶液250 mL;卡培他滨1 000 mg/m2,每天口服2次,第1~7 天。该组有9 例患者联用贝伐珠单抗,第1天,5 mg/kg溶于0.9%生理盐水100 mL中静滴。
以上治疗方案均为每2 周重复1 次,上限为9 个周期。如果疾病进展、出现无法耐受的不良反应或者患者拒绝,则停止治疗。
1.2.3 疗效及不良反应评估 治疗前评估包括:详细病史及体格检查、体力状态评分、全血细胞分类计数、血生化检测、癌胚抗原(carcinoembryonic antigen,CEA)、心电图、胸部CT、腹部及盆腔CT/MRI 检查。影像学评估每6~8 周进行1 次。在治疗过程中,体格检查每2 周进行1 次,每周至少进行1 次全血细胞分类计数、生化检验。每周检测1 次不良反应,并根据不良反应常见术语标准(CTCAE)4.0进行分级。由1 名专业影像科医师进行肿瘤的测量。临床医师根据RESIST 1.1 标准进行疗效评估。
疗效评定根据RECIST 1.1分为完全缓解(complete remission,CR):所有目标病灶消失;部分缓解(partial response,PR):基线病灶长径总和缩小≥30%;病情进展(progressive disease,PD):基线病灶长径总和增加≥20%或出现新病灶;病情稳定(stable disease,SD):基线病灶长径总和有缩小但未达PR或有增加但未达PD。ORR为CR+PR 病例占可评价病例的百分数,疾病控制率(disease control rate,DCR)为CR+PR+SD病例占可评价病例的百分数,CR或PR患者需经4周后再证实。按CTCAE4.0将常见不良反应分为4级。
1.3 统计学分析
采用SPSS 21.0软件进行统计学分析。计量资料以均数±标准差()表示,行t检验;计数资料以率表示,行χ2检验;等级资料的比较采用秩和检验;PFS采用Kaplan-Meier 法分析并绘制生存曲线图。P<0.05为差异具有统计学意义。
2 结果
2.1 疗效评估
所有患者均进行疗效评估,未观察到CR 病例。其中,FOLFOXIRI 组27 例(60%)患者获得PR,17 例(37.8%)SD,1例(2.2%)PD,45例患者的ORR 和DCR分别为60%和97.8%。CAPRINOX组16例(57.1%)患者获得PR,9 例(32.1%)SD,3 例(10.7%)PD,28 例患者的ORR 和DCR 分别为57.1%和89.3%。经过多学科讨论后,FOLFOXIRI 组中11 例(24.4%)患者进行R0 切除,CAPRINOX 组中5 例(17.9%)进行R0 切除。两组ORR、DCR及R0切除转化率比较差异均无统计学意义。由于两组中有部分患者同时联合使用贝伐珠单抗,故将联合及未联合靶向治疗的患者疗效结果单独分析,FOLFOXIRI 组单纯化疗的44 例患者ORR及DCR分别为61.4%和97.7%,联合贝伐珠单抗的1例患者最佳疗效为SD。而CAPRINOX 组单纯化疗的19 例患者ORR 及DCR 分别为55.6%和84.2%,联合贝伐珠单抗的9例患者ORR及DCR分别为66.7%及100%(表2)。两组单纯化疗的ORR 及DCR比较差异无统计学意义(均P>0.05)。
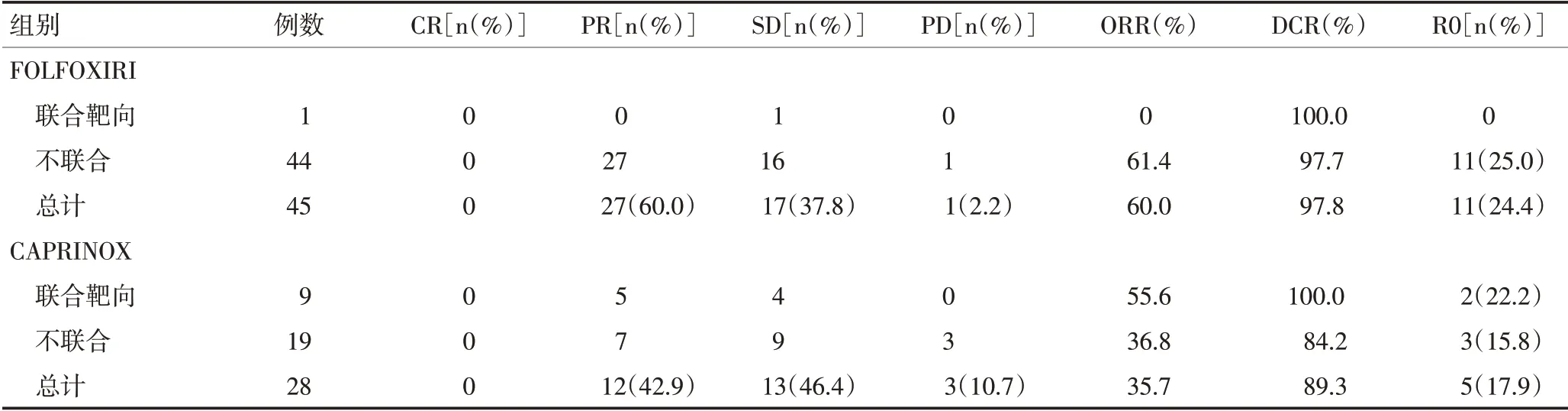
表2 两组患者临床疗效比较
2.2 抗肿瘤活性及与RAS和BRAF状态的关系
73 例患者中有69 例患者接受KRAS、NRAS 及BRAF基因检测,FOLFOXIRI组中18例患者存在RAS或BRAF 基因突变,其ORR 为50%,而RAS/BRAF 野生型的患者ORR 为76%;而CAPRINOX 组中18 例患者为RAS/BRAF 突变,其ORR 为50%,而RAS/BRAF野生型患者ORR为87.5%(表3)。

表3 按照RAS/BRAF 基因状态分层后接受FOLFOXIRI 或CAPRINOX方案患者的初步疗效
2.3 生存期
由于本研究观察时间较短,目前尚未达到OS。FOLFOXIRI组的中位PFS(median PFS,mPFS)为7.7个月,CAPRINOX 组为9.6个月,差异无统计学意义(P=0.585,图1)。两组排除联合贝伐珠单抗进行生存分析显示,FOLFOXIRI组mPFS为7.7个月,CAPRINOX组为7.4个月,差异无统计学意义(P=0.732)。
2.4 不良反应
所有患者均未出现药物毒性相关的死亡。两组的各项不良反应发生率详见表4及表5。两组常见的不良反应有白细胞减少、中性粒细胞下降、恶心、呕吐、腹泻、脱发、疲乏、转氨酶升高和周围神经毒性,以1~2级多见,差异均无统计学意义(P>0.05,表6)。
本研究对所有患者UGT1A1*6 及UGT1A1*28 两个位点的多态性进行探索性分析。在基因表型上,FOLFOXIRI 组有23 例(51.1%)患者为UGT1A1*6*28全野生型,CAPRINOX组有13例(46.4%)。

图1 两组患者PFS比较

表4 FOLFOXIRI组不良反应发生率统计表 n(%)
3 讨论
对于晚期结直肠癌患者,5-FU及其衍生物、伊立替康和奥沙利铂是目前公认有效的细胞毒性药物。结直肠癌患者通常可选择两药化疗联合靶向药物作为治疗方案。尽管分子靶向药物如贝伐珠单抗、西妥昔单抗等在mCRC 的治疗中极大地延长了患者生存,但是目前仍有很多医院无法常规进行RAS/BRAF基因检测,因此表皮生长因子受体(epidermal growth factor receptor,EGFR)抗体类靶向药物难以短时间内在临床普遍应用。如果临床上有部分mCRC 患者肿瘤负荷较大,或者转移病灶有潜在切除可能的患者需行转化治疗,那么另一个治疗策略的选择就是三个细胞毒性药物的联合使用。三药化疗理论上ORR较高,从而达到降低肿瘤负荷或在进行根治性手术前达到转化治疗的目的。
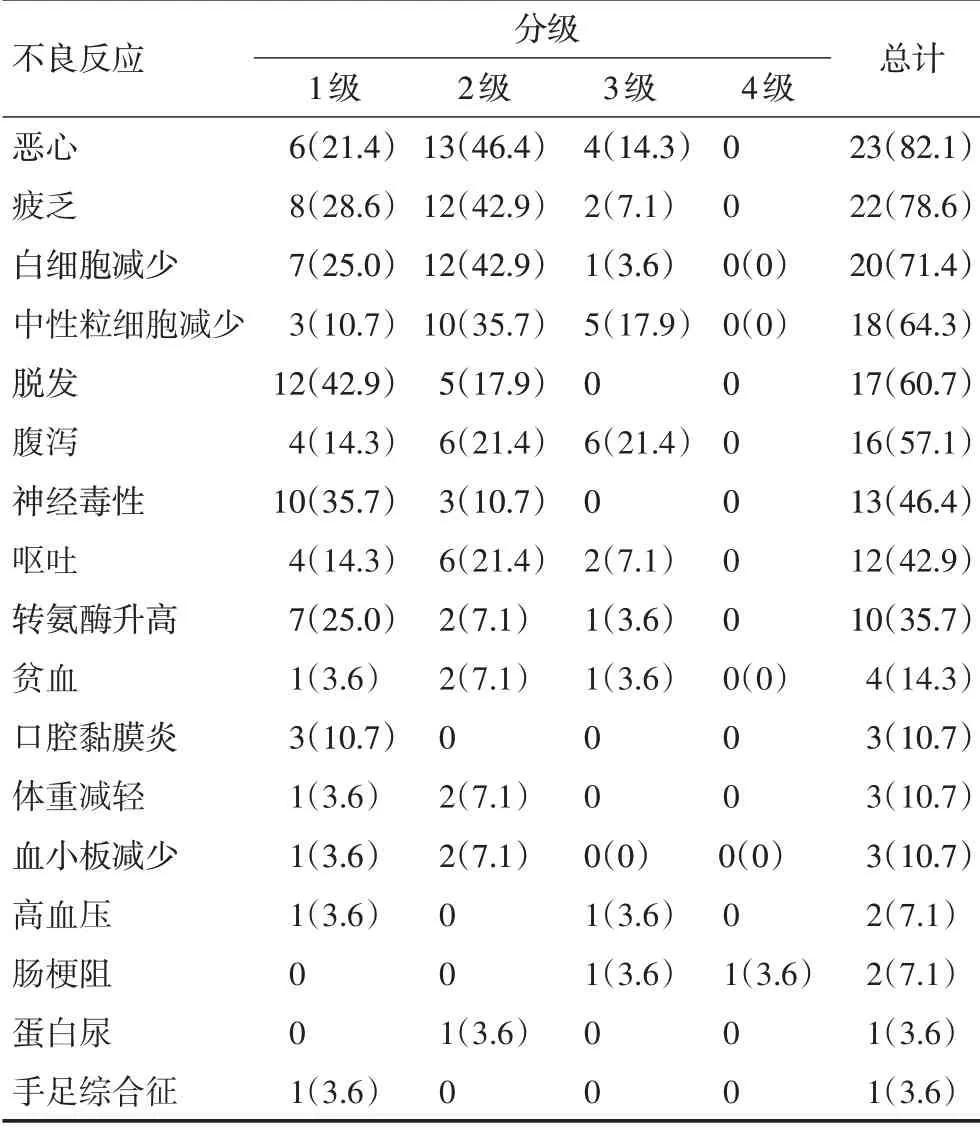
表5 CAPRINOX组不良反应发生率 n(%)

表6 两组患者不良反应比较 n(%)
国外两项大型Ⅲ期随机对照临床研究对比了FOLFOXIRI与FOLFIRI方案在mCRC患者中的疗效,证实三药联合相比传统两药化疗显著增加疗效及改善生存[7-8]。一项关于21例mCRC患者一线应用FOLFOXIRI方案的回顾性研究显示其ORR和DCR达到66.7%和95.2%[9]。本研究FOLFOXIRI三药联合化疗组的ORR达61.4%,DCR达97.7%,该结果与西方国家的研究结果一致[10]。此外,该方案也提高了手术转化率,11例(25%)初始肿瘤不可切除的患者被评估认为可接受R0 切除。近几年,FOLFOXIRI方案在与靶向药物联合方面取得一定研究进展。TRIBE Ⅲ期临床试验及OLIVIAⅡ期临床试验显示,FOLFOXIRI联合贝伐珠单抗在有效率及生存期方面优于FOLFIRI或FOLFOX方案联合贝伐珠单抗,并提高了转移病灶切除率[11-12]。GONO研究组设计的TRIBE2临床研究进一步比较FOLFOXIRI三药联合贝伐珠单抗,在晚期结直肠癌患者二线治疗的有效性和安全性[13]。
2015年美国国立综合癌症网络(NCCN)指南已推荐FOLFOXIRI用于mCRC患者的一线治疗。中国临床肿瘤学会(CSCO)指南也将FOLFOXIRI±贝伐珠单抗作为适合强烈治疗的潜在可切除患者或姑息治疗一线的Ⅱ级推荐治疗方案。但三药联合的高毒性限制了该方案的应用。因此如何对药物剂量进行优化,口服氟尿嘧啶类药物替代传统5-FU是否可以提高患者的耐受性值得进一步探索。卡培他滨作为口服的氟尿嘧啶类药物,能维持较高的血药浓度并提高抗癌活性,并且口服制剂避免了因持续静脉给药产生静脉炎及中心静脉置管相关并发症。既往研究证实,无论是针对辅助治疗还是晚期结直肠癌,卡培他滨均能替代5-FU/LV,疗效相当且更加安全。另有多项Ⅱ期临床试验证实CAPRINOX方案作为不可切除mCRC的一线治疗的可行性和有效性。有研究显示,应用FOLFOXIRI三药联合治疗mCRC 患者,ORR 达到53%~67%,DCR 达到89%~100%,化疗后R0切除率达22%~30%[3-6]。近年有临床研究使用CAPRINOX化疗联合贝伐珠单抗/西妥昔单抗一线治疗mCRC,其ORR高达83%,DCR高达100%,R0 切除率为25%[14-15]。本研究单纯使用CAPRINOX 三药化疗的19 例患者ORR 为52.6%,DCR 为84.2%,R0切除率为15.8%,CAPRINOX三药联合贝伐珠单抗的9例患者其ORR为66.7%,DCR为100%,R0切除率为22.2%,与上述研究结果相比临床疗效略低,考虑可能的原因为该组患者观察时间较短。目前尚缺乏前瞻性临床研究对比CAPRINOX及FOLFOXIRI治疗mCRC的疗效及安全性,且回顾性数据较为匮乏。李晟等[16]的研究比较两组治疗方案的ORR、PFS 及OS,差异无统计学意义。本研究回顾性分析显示,无论是否联合使用靶向药物,两组的疗效对比差异均无统计学意义,与上述报道一致。
RAS/BRAF基因突变是预后不佳的因素,对于这类晚期结直肠癌患者,传统两药方案疗效较差,但既往研究显示FOLFOXIRI 联合贝伐珠单抗方案可能为RAS/BRAF 突变的mCRC 患者带来更多的生存获益[10]。本研究也显示,在FOLFOXIRI 组中,RAS/BRAF 野生患者中ORR 达76%,RAS/BRAF 突变患者ORR 达50.0%;CAPRINOX 组中,RAS/BRAF 野生患者ORR 为87.5%,RAS/BRAF 突变患者ORR 为50%。结果表明,无论RAS/BRAF 基因状态如何,三药联合应用均可得到较好的应答。因此,对于具备RAS/BRAF 突变的人群而言,其预后相对差,治疗手段有限,三药联合方案也可能是一种可以提高疗效和生存期的选择,或可成为这一人群的优选方案。
本研究由于观察时间较短,目前尚未达到OS。本研究FOLFOXIRI 组的mPFS 为7.7 个月,CAPRINOX 组为9.6 个月,差异无统计学意义(P=0.585)。两组mPFS与既往研究相比略低,考虑可能与本研究观察时间较短相关;另外,本组研究对象均存在较大的肿瘤负荷,这可能会影响PFS。近一半患者在治疗前CEA>100 ng/mL。
三药联合方案突出的缺点是化疗相关不良反应,尤其3~4级不良事件发生率均有增加[7-8,17-19]。既往研究显示,FOLFOXIRI方案3~4级腹泻发生率为16%~27.7%,3~4级粒细胞减少的发生率为35%~51%。考虑到种族差异和安全耐受性,研究对FOLFOXIRI进行改良,降低了伊立替康及5-FU的剂量强度后,3级以上不良反应发生率为38.1%,未出现3级以上的腹泻及神经毒性[9]。本研究FOLFOXIRI组中,最常见的3~4级不良反应为白细胞减少、粒细胞减少及腹泻,其中白细胞减少的发生率为26.7%,粒细胞减少的发生率为24.4%,腹泻发生率为6.7%,不良反应发生率与上述报道相比略低。对于CAPRINOX方案,国外报道的3~4级腹泻发生率为8%~40%,3~4级粒细胞减少的发生率为6%~50%[3,5-6,14-15],本研究的3级腹泻发生率为21.4%,3~4级粒细胞减少的发生率为17.9%,与上述文献报道一致。
本研究最常见的血液毒性为白细胞减少、中性粒细胞减少,最常见的非血液毒性为疲乏、恶心、呕吐、腹泻、脱发、转氨酶升高和外周神经毒性,但多为1~2 级。两组治疗过程中的不良反应相似,差异均无统计学意义。FOLFOXIRI 组3/4 级不良反应发生率为33.3%(15/45),CAPRINOX 组3/4 级不良反应发生率为46.4%(13/28),差异无统计学意义(P=0.263)。两组中有部分患者为化疗联合贝伐珠单抗治疗,FOLFOXIRI 组仅1 例患者联用贝伐珠单抗,并未发现相关不良反应(高血压、蛋白尿、深静脉血栓、出血、穿孔),CAPRINOX组联用贝伐珠单抗的9例患者有1例出现3级高血压和2级蛋白尿,有1例出现1级高血压,其余7例患者无相关不良反应。
随着对伊立替康的深入研究,UGT1A1*28 多态性与预测伊立替康相关毒性呈一定相关性。对UGT1A1*28非野生型患者,可能需要更积极的预防,干预迟发性腹泻。本研究发现FOLFOXIRI组共发生12 例3~4 级白细胞减少,22 例UGT1A1 突变型患者中有9例,较野生型患者发生概率高(P=0.035),但两组3~4级粒细胞减少及腹泻发生率差异均无统计学意义。考虑与样本量较小有关。
综上所述,在中国患者中应用三药联合化疗方案一线治疗mCRC的近期疗效较高,不良反应可以耐受。对于体力状况良好伴有潜在可切除转移病灶的患者应用联合方案可明显提高R0切除率,进而转化为生存获益,三药联合方案应是最优先选择之一。另外,对于肿瘤负荷大或者存在BRAF基因突变时也应考虑采用三药联合化疗。口服卡培他滨替代输注5-FU在不影响疗效的同时可以减少FOLFOXIRI方案中使用中心静脉导管的相关并发症,简便易行,值得临床推广。但是,CAPIRINOX方案是否优于两药标准化疗方案,尚期待大样本临床研究予以进一步验证。
