超声处理对猪皮明胶特性的影响
2019-04-10李雪晗郭婷余永张宇昊
李雪晗,郭婷,2,余永,2,张宇昊,2*
1(西南大学 食品科学学院,重庆,400715)2(西南大学,国家食品科学与工程实验教学中心,重庆,400715)
明胶由动物皮肤、骨、肌膜、肌腱等结缔组织中的胶原部分降解而成,属于大分子的亲水胶体,可溶于热水,可形成热可逆性凝胶。明胶作为食品添加剂广泛应用到各类食品之中,如可添加到酒类中作为澄清剂、可添加到肉制品中作为增稠剂和胶凝剂、亦可添加到分散体系中作为稳定剂[1]。食品体系中的电解质、酸碱性、糖类物质及外源物理处理如紫外照射、微波等均会影响明胶的黏度、凝冻强度和透射比[2]。
近年来,超声波技术作为一种高速发展的新兴技术,被各个领域所广泛应用。在食品加工过程中,超声波技术主要应用于食品加工的单一过程,例如在食品无损检测及保鲜、乳液的乳化和均质、超声辅助完成的提取干燥杀菌过滤、肉的嫩化等方面[3-6]。巴西圣保罗大学的LUIS等[7]研究发现超声处理增加了重组熟制火腿的红度值,并导致了肌原纤维产生微裂纹,并由此推断超声波在生产更健康的肉制品方面具有良好的潜力。此外,超声波技术在蛋白质改性方面也有较为普遍的应用,其主要研究方向关于蛋白质的水合作用、结构变化以及加工特性。MADADLOU等[8]研究发现,酪蛋白溶液经过超声处理后,形成凝胶的pH值降低,凝胶的弹性和强度增强。超声处理可以增加蛋白溶解性,提高其乳化性,改善流变性能[9-10]。
由此可见不同的超声处理可以改变蛋白的性质,目前超声波技术对明胶理化性质与功能特性的影响尚缺乏系统的研究,本实验以猪皮明胶为原料,系统研究不同条件下超声处理对明胶性质影响规律,并结合明胶分子结构的影响,分析超声影响明胶性质的分子机制,旨在为超声波技术在含有明胶的食品体系中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
猪皮明胶(gelatin from porcine skin,V900863-500G),西格玛奥德里奇(上海)贸易有限公司。
1.2 仪器与设备
电子天平(JA3003B),上海精天电子仪器有限公司;电热恒温鼓风干燥箱(101-4-S),上海跃进医疗器械厂;温控水浴锅(8002),北京永光明医疗仪器厂;质构仪(CT-3),美国博勒飞公司;基础电泳仪(Power Pac TM),美国Bio-Rad公司;红外光谱仪(Spectrun100),美国Perkin Elmer公司;超声波细胞破碎仪(JY92-IIDN型),宁波新芝生物科技股份有限公司;流变仪(DHR-1),美国TA公司。
1.3 实验方法
1.3.1 明胶的超声处理
配制66.7 g/L的明胶溶液30 mL,在60 ℃的恒温水浴锅中充分溶解后,快速放置于超声波细胞粉碎仪中超声处理,超声处理基础条件为超声功率400 W,超声时间10 min,超声功率水平设置为为200、400、600 W,超声时间水平设置为1、5、10、20 min 的12组实验,每组实验做3组平行。将做好的样品60 ℃热风干燥24 h后放于干燥皿中保存备用。
1.3.2 明胶强度分析
将样品配成66.7 g/L的溶液,所得溶液放置于4 ℃的冰箱18 h后取出,立即采用质构仪测定其凝胶强度。测定参数为:探头TA5,测试类型TPA分析,测试目标为距离4 mm,触发点负载5 g,测试速度1 mm/s。
1.3.3 明胶的亚基组成分析
采用SDS-PAGE垂直电泳分析明胶的亚基组成和分子质量分布。质量分数为6%的分离胶,质量分数为5%的浓缩胶;电泳缓冲液为10×Tris-Glycine缓冲液(含0.25 mol/L Tris、1.92 mol/L Glycine、10 g/L SDS,稀释10倍作内槽电泳液);5×样品缓冲液(含250 mmol/L Tris-HCl(pH值6.8)、0.1 g/mL SDS、5 mg/mL BPB、0.5 mL/mL甘油、0.05 mL/mL 2-ME);考马斯亮蓝R-250染色液(含1 g/L考马斯亮蓝R-250、 250 mL/L异丙醇、100 mL/L冰乙酸)和考马斯亮蓝染色脱色液(含100 mL/L冰乙酸、50 mL/L乙醇)。配制1.5 mg/mL的明胶溶液,按体积比4∶1添加5×样品缓冲液,沸水浴,冷却后上样,上样量为10 μL(marker上样量为10 μL)。15 mA恒流电泳,待溴酚蓝跑到分离胶中后,电流调至25 mA,电泳时间约1 h。 考马斯亮蓝染色后用脱色液脱色,多次更换脱色液直至背景脱净。
1.3.4 流变特性分析
分别测定超声处理前后明胶黏度、胶凝温度和熔化温度、储能模量与损耗模量。
(1)明胶黏度特性分析
釆用DHR-1流变仪测定66.7 g/L的明胶溶液在40 ℃下黏度随剪切速率的变化。
(2)明胶胶凝温度和熔化温度分析
釆用动态黏弹性法测定明胶的胶凝温度和熔化温度,以tan(d)=1作为胶凝和熔化的转折点,定义其对应的温度为胶凝/熔化温度。采用DHR-1流变仪测定6.67%的经超声处理的明胶样品的黏弹性,设定温度变化速率为1 ℃/min,控制应力3.0 Pa,测试夹具40 mm A1平板,Peltier温度控制系统,板间距为0.15 mm,明胶样品溶化后于流变仪上温度由40 ℃ 冷却到5 ℃,在5 ℃下保持2 min,然后由5 ℃加热到40 ℃,测定储能模量(G′)和损耗模量(G″)随温度扫描的变化,得到相角(δ)。
(3)明胶模量分析
采用DHR-1流变仪测定样品的凝胶性。DHR-1流变仪测定6.67%的经超声处理的明胶样品的黏弹性,设定温度变化速率为1 ℃/min,控制应力3.0 Pa,测试夹具40 mmA1平板,Peltier温度控制系统,板间距为0.15 mm,明胶样品溶化后于流变仪上温度由40 ℃冷却到5 ℃,在5 ℃下保持2 min,然后由5 ℃加热到40 ℃,测定储能模量(G′)和损耗模量(G″)。随温度扫描的变化测定时间为37 min。
1.3.5 红外光谱分析
称取经不同超声处理的干明胶1 mg分别与1 g溴化钾(KBr)研磨均匀后,置于40 ℃下烘干一夜,取出压片。用Spectrun100红外光谱仪检测红外吸收,扫描范围400~4 000 cm-1,扫描次数32次,分辨率4 cm-1。 曲线拟合采用Origin 8.0,酰胺A带、酰胺Ⅰ带峰位置以及AⅢ/A1453的变化采用Perkin Elmer进行分析。
1.3.6 数据处理与统计分析
每组实验重复3次,并计算出平均值以及标准方差来表示实验结果。实验数据均采用软件Origin 8.0进行作图,用软件SPSS 20.0进行显著性差异分析(P<0.05 及P<0.01)。
2 结果与分析
2.1 超声处理对明胶凝胶强度的影响
不同超声条件处理后明胶凝胶强度变化趋势如图1所示,在不同超声功率下,明胶凝胶的凝胶强度均随处理时间的延长呈现先上升后下降的趋势,功率为200、400、600 W的时候明胶凝胶强度均在10 min时达到最大值,分别达到393 g、446 g和415 g,相比于未经过任何处理的明胶样品,分别提高了76.27%、67.21%、72.28%。

图1 超声波对明胶凝胶强度的影响Fig.1 Effect of ultrasound on gelatin gel strength注:用t检验法进行多重比较。同一曲线中标有不同大写字母、小写字母者分别表示组间差异极显著(P<0.01)和显著(P<0.05)。
这说明了适度超声处理可以改善明胶凝胶特性。从超声功率的角度分析,400 W处理后明胶凝胶强度最优,其次是600 W处理,最后是200 W 处理,其变化趋势与超声时间对明胶凝胶强度的影响一致,说明适度超声处理可以明显改善明胶的凝胶强度,但超声强度过大反而会导致明胶凝胶特性劣变。超声波具有能量和波动的双重效应,一是空化效应,即在液体介质中表现为泡的形成、破裂以及伴随的能量的释放;二是介质和容器也可以通过声的吸收产生共振性质的二级效应,如机械效应等。这些效应可以破坏维系明胶结构的氢键平衡,甚至可以破坏肽键[11]。
适度超声处理可以提高明胶的凝胶强度,可能是因为该条件下空化效应等作用并未断裂明胶的肽键,保持了明胶亚基组分的完整性,但改变明胶的二级结构,使明胶亚基展开,在凝胶形成过程中更易形成类三螺旋结构,进而赋予明胶更好的凝胶特性。
2.2 超声处理对明胶的亚基组成的影响
应用SDS-PAGE电泳检测不同超声处理后的明胶样品的亚基组成及分子质量分布,结果如图2所示,图中可以清楚看到明胶的α1链、α2链以及β链。

M-标准蛋白; 1-200 W 1 min; 2-200 W 5 min; 3-200 W 10 min;4-200 W 20 min; 5-400 W 1 min; 6-400 W 5 min; 7-400 W 10 min; 8-400 W 20 min; 9-600 W 1 min; 10-600 W 5 min; 11-600 W 10 min;12-600 W 20 min; 13-未经处理的明胶样品图2 超声处理对明胶分子质量的影响Fig.2 Effect of ultrasonic treatment on gelatin molecular weight
由图2可知,超声处理使明胶组分产生了一定的降解,但从SDS-PAGE图谱中小分子组分的颜色分析,大部分处理后降解程度的差异并不明显,这可能与电泳的分辨率有关。对于超声强度较大的600 W 20 min处理组,可明显看到其小分子组分明显高于其他处理组,说明在较强超声强度下,产生的空化效应等会造成明胶亚基组分的降解,进而导致明胶凝胶特性劣变。此外,因为电泳的前处理过程中破坏了明胶亚基间的非共价键,因此无法判断超声处理是否促进了明胶亚基组分的聚集。因此拟通过流变学手段,进一步研究超声处理后明胶亚基组分变化情况。
2.3 超声处理对明胶黏度特性的影响
流体在有相对运动时产生内摩擦力以抗形变是流体的一种固有物理属性,称为流体的黏性或黏滞性。不同超声波预处理对明胶凝胶表观黏度的影响如图3所示。图3表明在剪切速率为0~1 s-1,所有明胶样品的黏度随剪切速率的增加而降低,表现为剪切变稀,呈现假塑性流体的性质[12]。黏度的降低主要是由于剪切过程中产生的物理作用力[13],在剪切过程中,液体介质在剪切、振荡等作用下,最终形成蛋白质之间的布朗运动和氢键被破坏的综合作用[14]。当剪切速率增加以克服布朗运动和分子间碰撞时,溶液在流动区域内变得更加有序,且对流动的抵抗减弱,因此表现出较低的黏度[15-16]。

图3 经超声波200 W、400 W、600 W处理对明胶凝胶表观黏度的影响Fig.3 Effect of 200 W, 400 W, 600 W ultrasonic treatment on the apparent viscosity of gelatin gel
如图3所示,经超声处理的明胶凝胶的黏度值基本高于空白值(即未经过超声处理的明胶),因此推测超声处理过程产生的空化效应、机械效应等可能导致明胶亚基组分肽链展开,亚基氨基酸暴露,并通过氢键作用使亚基聚集体增加进而造成其对流动抵抗增强[17]。
总体来讲,400 W处理后明胶的黏度值高于600 W 和200 W处理,证明黏度下降过程中400 W处理后的样品中亚基组分间的互做更强,凝胶特性更好,与凝胶强度结果一致。
2.4 超声处理对明胶溶液相位角的影响
相位角(tanσ)是耗能模量和储能模量的比值称为损耗角正切(tanσ=G″/G′),表示黏弹性的度量,是蛋白质凝胶网络形成过程中的黏性和弹性的一个相对区分,即相位角越大,黏性越大,弹性越小;相位角越小,黏性越小,弹性越大[18]。因此,相位角的变化可以代表凝胶网络结构形成的类型,相位角越低,证明凝胶网络结构越好[16,19]。经超声不同功率处理后的明胶溶液tanσ值随温度的变化趋势如图4所示,随着温度的降低,明胶溶液的tanσ值先增加,而后突然出现拐点,表明明胶出现了相变,随后tanσ值随着温度的进一步降低迅速下降,说体系已经由溶液变为凝胶。
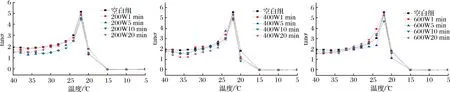
图4 经超声波200 W、400 W、600 W处理后的明胶分别在冷却过程中相角的变化Fig.4 The change of phase angle of gelatin treated by ultrasonic 200 W, 400 W and 600 W respectively during cooling
从明胶拐点的tanσ值看,空白组的tanσ值大于所有超声处理组,说明在本研究所选择的超声处理条件下,明胶凝胶特性均得到一定程度改善;而且3个超声功率下,每个组明胶拐点的tanσ最低值均为10 min处理样品,说明其凝胶特性好于其他时间处理组,与凝胶强度结果一致。这主要是因为适度超声所产生的空化效应等改变了明胶的构象,使之结构适度展开,在后期凝胶形成过程中更有利于三螺旋结构的形成。
2.5 超声处理对明胶模量的影响
储能模量G′可以用以衡量凝胶网络结构弹性形变过程中的能量储存,代表凝胶网络结构的强度[8]。超声波预处理对明胶凝胶储能模量G′的影响如图5所示。

a,b,c-冷却;d,e,f-加热图5 超声处理后的明胶在冷却和加热过程中储能模量(G′)的变化Fig.5 Changes in storage modulus (G′) during cooling and heating of gelatin after sonication
由图5可知,所有明胶样品的G′都随温度的降低而升高,说明随着温度越低,明胶凝胶网络结构强度增大[20]。所有超声处理的明胶凝胶样品的储能模量G′均高于未经超声处理的明胶样品,再次证明本研究所选择的超声处理条件后,明胶凝胶特性均得到一定程度改善。从超声功率的角度分析,400 W处理后样品的G′最高,其次是600 W处理,200 W处理后明胶样品的G′最低。说明400 W处理后明胶中亚基组分构象变化更适合于类三螺旋结构的形成,使明胶凝胶特性体系中网络结构强度更大,进而赋予了明胶更好的凝胶特性,与黏度结果分析一致。
2.6 红外光谱分析
超声波作用后的明胶红外光谱扫描图如图6所示。各组明胶的酰胺A带、酰胺Ⅰ带的峰位置以及酰胺Ⅲ带与1 457 cm-1处的峰峰强度比值变化趋势如表1所示。
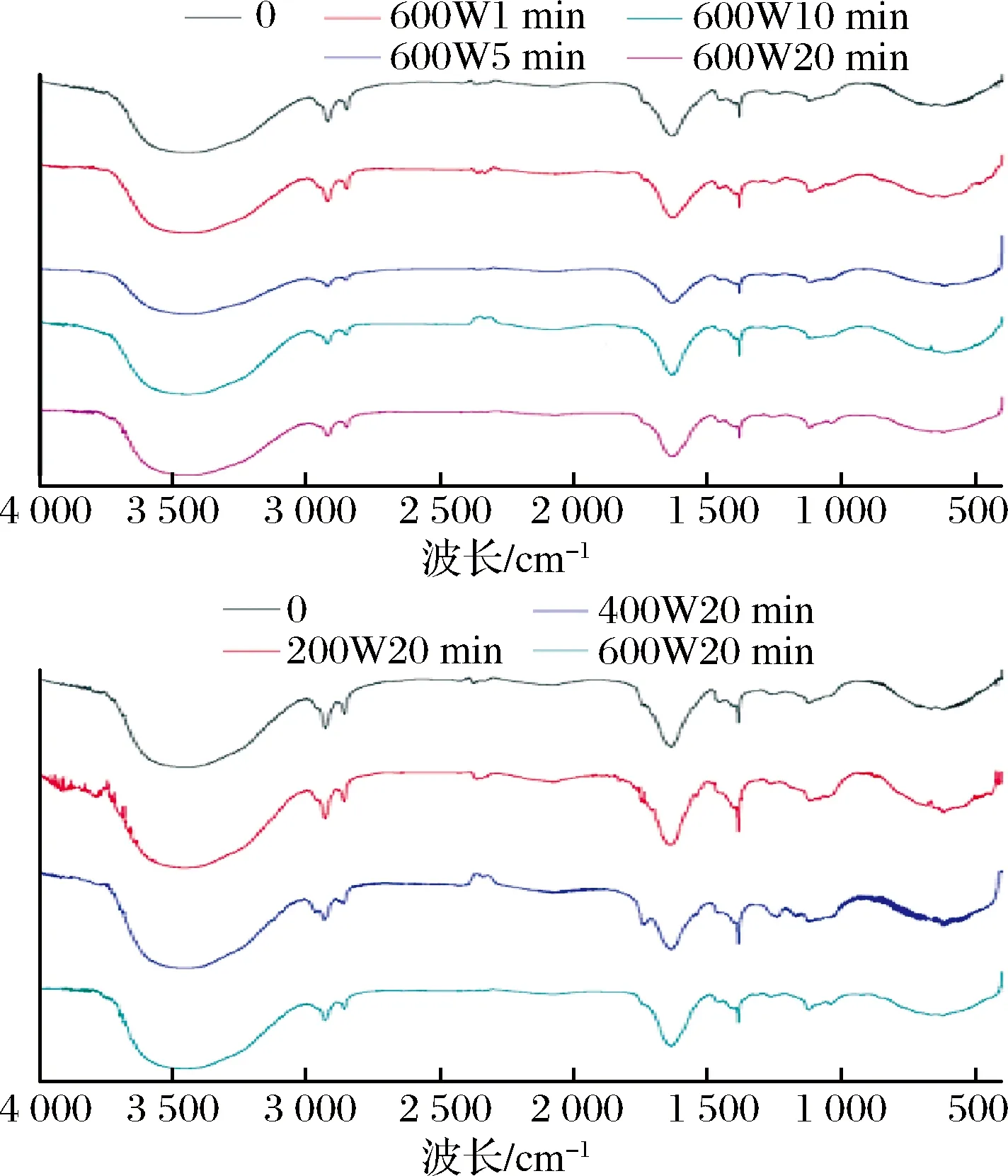
图6 超声处理后明胶的红外光谱扫描图Fig.6 Infrared spectra of gelatin after ultrasonic treatment

表1 超声处理明胶红外光谱中酰胺A带峰位置、酰胺Ⅰ带峰位置、AⅢ/A1453的变化Table 1 Ultrasonic treatment gelatin infrared spectrum amide A peak position, amideⅠpeak position, AⅢ/A1453changes
在3 430~3 440 cm-1的吸收峰被认为是酰胺A带的谱带,是N—H伸缩振动的吸收峰,表明分子内氢键的存在。当N—H参与氢键的形成时,酰胺A向低波数移动。超声处理过的明胶酰胺A带均向低波数移动,说明超声处理后明胶中N—H参与的氢键均有所增加,这在明胶凝胶形成过程中更有利于类三螺旋结构的形成;这主要是因为明胶原有的氢键平衡在空化效应等作用下发生改变,也是超声处理后,明胶凝胶强度均有所增加的原因之一。不同超声功率处理后,明胶中N—H参与形成的氢键变化差异不明显,因此这不是造成不同超声功率影响明胶凝胶特性差异的原因。
超声过程中所产生的空化效应、机械效应可以改变蛋白的构象,破坏蛋白原有空间结构,使蛋白展开[17]。酰胺Ⅲ与1 453 cm-1峰强度之比(AⅢ/A1453),可以表征胶原三螺旋结构完整度,比值越接近1表明胶原三螺旋结构完整性越高[11]。由表1中数据可知,超声处理均可造成明胶中三螺旋结构的展开。从超声时间角度分析,随着超声时间的延长,AⅢ/A1453值呈现先上升后下降的趋势,且超声10 min处理,均造成明胶中三螺旋结构展开程度最大。明胶三螺旋结构中亚基组分部分展开,可以使其在凝胶形成过程中有利于形成更多的类三螺旋结构,赋予明胶更好的凝胶特性,这也是图1中明胶凝胶强度最优值均出现在10 min的原因。不同超声功率下处理10 min时,AⅢ/A1453值的趋势与明胶凝胶强度并不一致,这可能是因为,三螺旋结构的展开程度并不是影响明胶凝胶强度的唯一因素,当明胶三螺旋结构展开超过一定程度后,其对明胶凝胶特性影响已经不再明显。
3 结论
(1)经过超声波处理后的明胶样品的凝胶强度明显高于未处理的空白样品,但凝胶强度随着超声时间的增强和功率的增大呈现先上升后下降趋势,说明适度超声处理可以明显改善明胶的凝胶强度,但超声强度过大反而会导致明胶凝胶特性劣变。其中处理时间10 min与处理功率400 W的条件处理后的明胶凝胶强度最优。
(2)电泳分析表明,在本实验所设置的超声条件范围内对明胶进行超声处理,明胶亚基组分并未发生明显降解。
(3)流变学分析表明,400 W超声处理后明胶的黏度增加明显,说明在此条件下,超声处理可能导致明胶亚基组分肽链展开,亚基氨基酸暴露,并通过氢键作用使亚基聚集体增加。明胶胶凝温度与模量随超声条件变化趋势与凝胶强度一致,说明400 W处理10 min 后明胶中亚基组分构象变化更适合于类三螺旋结构的形成。
(4)红外光谱分析表明,超声处理后明胶中N—H参与的氢键有所增加,同时会导致明胶三螺旋结构中的亚基组分部分展开,可以使其在凝胶过程中有利于形成更多的类三螺旋结构,赋予明胶更好的凝胶特性。
