心肌及蛛网膜下腔NGF基因转染对1型糖尿病大鼠心脏损伤的保护作用
2019-04-09易剑敏岳维高盼张伟男
易剑敏,岳维,高盼,张伟男
糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是一组由多病因引起的以高血糖为特征的代谢性疾病,主要累及神经系统,尤其是心脏的感觉神经,可使轴突萎缩、脱髓鞘、再生潜能减弱、发炎及周围神经纤维进行性丧失[1]。神经生长因子(nerve growth factor,NGF)作为神经营养因子家族中重要的一员,可通过作用于高亲和力酪氨酸激酶受体A(tyrosine kinase A,TrkA)和低亲和力p75受体(75 kd neurotrophin receptor, p75NTR),从而调控神经纤维的生长、发育和再生[2]。由于高血糖的作用,糖尿病大鼠心脏感觉神经病变可下调内皮细胞和神经细胞NGF的生成,使受NGF调控的降钙素基因相关肽(calcitomin gene-related peptide,CGRP)大幅度减少,进而导致心功能的恶化[3]。重组腺相关病毒(recombinant adeno-associated virus,rAAV)具有安全性好、免疫源性低、转染时间长等特点,其中rAAV9 有较好的心脏亲和力,rAAV2 有较强的噬神经性[4]。本课题组前期研究表明,高血糖可使NGF表达减少[5]。本研究主要通过不同的转染途径介导NGF 基因转染糖尿病大鼠的心脏或脊髓组织,旨在比较不同转染方法对糖尿病大鼠的心脏保护作用。
1 资料与方法
1.1 实验动物 SPF 级雄性SD 大鼠36 只,7 周龄,体质量200~220 g,由中国人民解放军军事医学科学院实验动物中心提供,实验动物许可证:SCXK(京)2014-0013。所有实验动物均置于室温、避免异常环境刺激干扰、昼夜交替(12 h/12 h)条件下饲养,饲养1周适应新环境后开始实验。本实验分为两个子实验,实验一中大鼠按随机数字表法分为2 组(n=6):对照组、糖尿病(DM 组);实验二中大鼠按随机数字表法分为4组(n=6):糖尿病心脏转染对照(MC)组、糖尿病心脏转染(ME)组、糖尿病脊髓转染对照(SC)组、糖尿病脊髓转染(SE)组。实验操作程序经山西医科大学动物伦理委员会批准,并按实验动物使用的3R原则给予人道主义关怀。
1.2 主要试剂与仪器 rAAV9-NGF-GFP(滴度1.2×1015µg/L)、rAAV9-GFP(滴度1.6×1015µg/L)、rAAV2-NGF-GFP(滴度1.2×1015µg/L)、rAAV2-GFP(滴度1.6×1015µg/L)均购自上海汉恒生物科技有限公司;链脲佐菌素(streptozotin,STZ,美国Sigma 公司);大鼠NGF ELISA 试剂盒、大鼠CGRP ELISA试剂盒(上海西唐生物科技有限公司);小动物生命指标检测仪(四川仪器厂);Leica CM-1850 恒冷切片机(德国Leica 公司);BX-51 型荧光显微镜(日本TKO 光学仪器株式会社);Novapath酶标仪(美国Bio-Rad公司)。
1.3 方法
1.3.1 实验一
1.3.1.1 1型糖尿病模型的制备 大鼠适应性喂养1周后,实验一中的DM 组大鼠禁食24 h,继以腹腔注射STZ(50 mg/kg)。连续测量之后7 d 的空腹血糖,以7 次血糖值均>16.7 mmol/L为造模成功(实验二中4组大鼠造模采用相同方法)。
1.3.1.2 测定大鼠甩尾反射潜伏期和蛋白表达情况 STZ注射前1 d及后第1、2、4、6、8、9周,使用甩尾仪红外光源对准大鼠尾尖端进行照射,记录从按下开关开始到大鼠因逃避热痛而甩开尾巴的时间,即为甩尾反射潜伏期(tail flick latency,TFL);第9周时取左心室心肌组织在液氮条件下研磨至粉末状,按10 mL/g加入蛋白裂解液,冰盒裂解1 h(每10 min混匀1次)后,4 ℃、15 000×g离心30 min,取上清,严格按照说明书步骤,采用ELISA试剂盒测定样本NGF和CGRP含量。
1.3.2 实验二 本实验采用的是2×2析因设计,两个因素分别是因素A:转染物,因素B:转染途径,两因素各有2 个水平,共设置4组,见表1。

Tab.1 The experimental factors and levels and specific intervention programs of each treatment group表1 实验因素、水平及各处理组的具体干预方案
1.3.2.1 病毒转染 大鼠糖尿病成模后第4周,以7%的水合氯醛(300 mg/kg)腹腔注射麻醉后,经口直视下气管插管,连接呼吸机控制呼吸。将MC、ME 组大鼠仰卧位固定于手术台,在胸骨体偏左侧1 cm暴露心尖部,以心尖部为注射区域,网格状选取5个注射点(点间隔约1 mm,深度1~2 mm),注射滴度为0.8×1013µg/L 的rAAV9-GFP、rAAV9-NGF-GFP 各100µL(每注射点20µL),逐层关胸。将SC、SE 组大鼠颈部垫高,仰卧位固定于手术台上,暴露手术视野,选取寰椎和枢椎的间隙进针见脑脊液流出后,将导管置入蛛网膜下腔后固定,注射滴度为0.8×1012µg/L 的rAAV2-GFP、rAAV2-NGFGFP各25µL,封闭导管外口,术后次日拔管。各组大鼠术后连续3 d肌内注射庆大霉素10 000 U以预防感染。
1.3.2.2 心功能指标的监测 糖尿病造模后第9 周(转染后第5 周),各组以25%的乌拉坦(5 mL/kg)腹腔麻醉,测血糖、体质量。连接小动物生命指标检测仪,监测大鼠心电图,分离大鼠右侧颈动脉,置动脉导管监测左心室收缩压(left ventricular developed pressure,LVSP)、左心室舒张末压(left ventricular end-diastolic pressure,LVEDP)、心率(heart rate,HR)、左心室内压最大上升速率(+dp/dtmax)、左心室内压最大下降速率(-dp/dtmax)等指标。
1.3.2.3 荧光显微镜观察绿色荧光蛋白(green fluorescent protein,GFP)表达 造模后第9周,取大鼠心脏、脊髓和背根神经节(dorsal root ganglion,DRG),包埋后冰冻切片,立即在荧光显微镜下观察GFP的表达,因rAAV-NGF自身携带GFP标签,GFP 自发绿色荧光,故可直接冰冻切片后观察GFP 的表达情况,由此验证外源基因NGF是否稳定转染入组织中。
1.3.2.4 心肌、脊髓、DRG组织NGF、CGRP含量测定 第9周时取左心室心肌组织,T1-T5脊髓及DRG组织在液氮条件下研磨至粉末状,按10 mL/g加入蛋白裂解液,冰盒裂解1 h(每10 min混匀1次)后,4 ℃、15 000×g离心30 min,取上清,严格按照说明书步骤,采用ELISA试剂盒测定样本NGF和CGRP含量。
1.4 统计学方法 采用SPSS 25.0统计软件分析数据。符合正态分布的计量资料以均数±标准差()表示,实验一均数比较采用重复测量方差分析,实验二均数比较采用2×2析因设计方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 实验一
2.1.1 2组TFL比较 随着时间的延长,大鼠的甩尾潜伏期逐渐延长(P<0.05),在注射STZ 后DM 组大鼠的甩尾潜伏期长于对照组(P<0.05),见表2。
2.1.2 各组心肌组织中NGF、CGRP 的表达 与对照组相比,DM 组大鼠心肌组织中的NGF、CGRP 等蛋白含量明显下调(P<0.05),见表3。
Tab.2 Comparison of tail flick latencies at different time points between two groups表2 各组大鼠甩尾潜伏期的比较(n=6,s,)

Tab.2 Comparison of tail flick latencies at different time points between two groups表2 各组大鼠甩尾潜伏期的比较(n=6,s,)
F时间=1 412.39**,F组别=1 305.94**,F交互=293.49**;**P<0.01
对照组DM组18.80±0.24 22.95±0.24 19.18±0.19 27.26±0.36 19.58±0.38 29.00±0.37
Tab.3 The expressions of NGF and CGRP in myocardium in two group表3 大鼠心肌组织中NGF、CGRP的含量 (ng/g,)
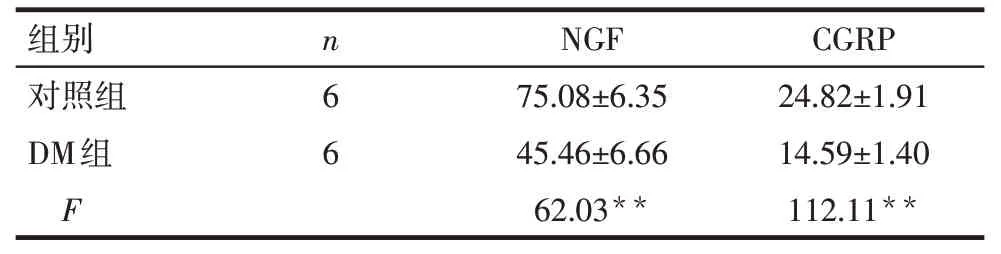
Tab.3 The expressions of NGF and CGRP in myocardium in two group表3 大鼠心肌组织中NGF、CGRP的含量 (ng/g,)
*P<0.05,**P<0.01;表5、7同
对照组DM组F 6 6 75.08±6.35 45.46±6.66 62.03**24.82±1.91 14.59±1.40 112.11**
2.2 实验二
2.2.1 各组心功能指标的变化 转染物和转染途径均对大鼠的心功能有影响(P<0.05),转染途径对大鼠的LVSP 影响不明显(P>0.05),转染物和转染途径对-dP/dtmax 的影响不存在交互效应(P>0.05)。两者对其他观察指标都有明显作用,并存在明显的交互作用(P<0.05)。见表4、5。
Tab.4 Comparison of cardiac functions between four groups of rats表4 各组大鼠心脏功能的比较(n=6,)
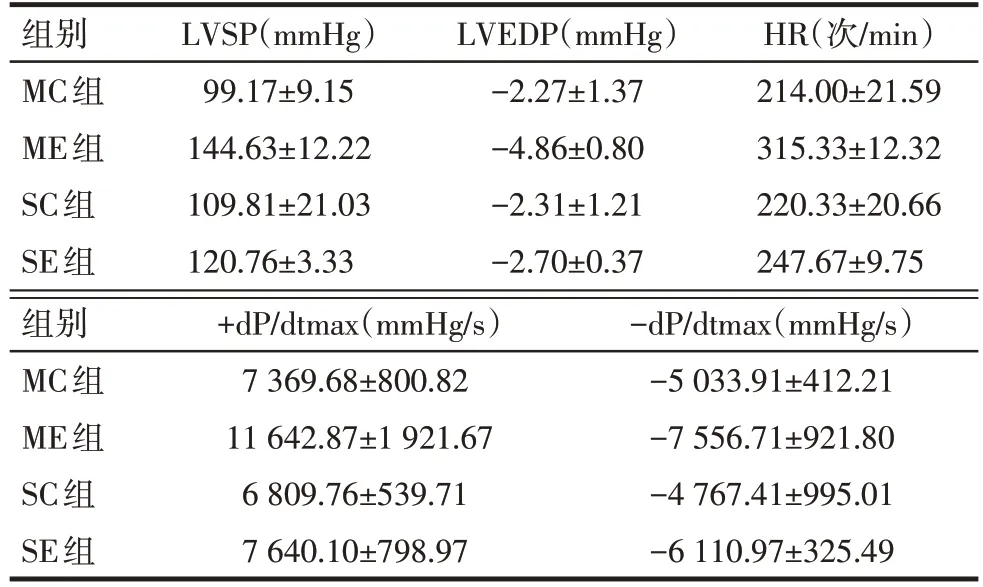
Tab.4 Comparison of cardiac functions between four groups of rats表4 各组大鼠心脏功能的比较(n=6,)
组别MC组ME组SC组SE组LVSP(mmHg)99.17±9.15 144.63±12.22 109.81±21.03 120.76±3.33 LVEDP(mmHg)-2.27±1.37-4.86±0.80-2.31±1.21-2.70±0.37 HR(次/min)214.00±21.59 315.33±12.32 220.33±20.66 247.67±9.75组别MC组ME组SC组SE组+dP/dtmax(mmHg/s)7 369.68±800.82 11 642.87±1 921.67 6 809.76±539.71 7 640.10±798.97-dP/dtmax(mmHg/s)-5 033.91±412.21-7 556.71±921.80-4 767.41±995.01-6 110.97±325.49
2.2.2 大鼠心脏、脊髓及DRG中GFP的表达 左心室的心肌注射部位、脊髓灰质及DRG 中有大量的GFP蛋白散在分布于细胞内,表明病毒已稳定转染,见图1。
2.2.3 心肌、脊髓、DRG 组织中NGF、CGRP 含量的变化 ME 组大鼠心肌组织中NGF、CGRP 的蛋白含量较其他组大鼠明显上调,SE组大鼠T1-T5段脊髓和T1-T5 段DRG 组织中NGF、CGRP 的蛋白含量较其他组大鼠明显上调;转染物和转染途径均对大鼠组织中的NGF、CGRP有影响(P<0.05),且二者之间存在明显的交互作用(P<0.05)。见表6、7。

Tab.5 Analysis of variance of factorial design of cardiac functions in five groups of rats表5 大鼠心脏功能析因设计方差分析结果
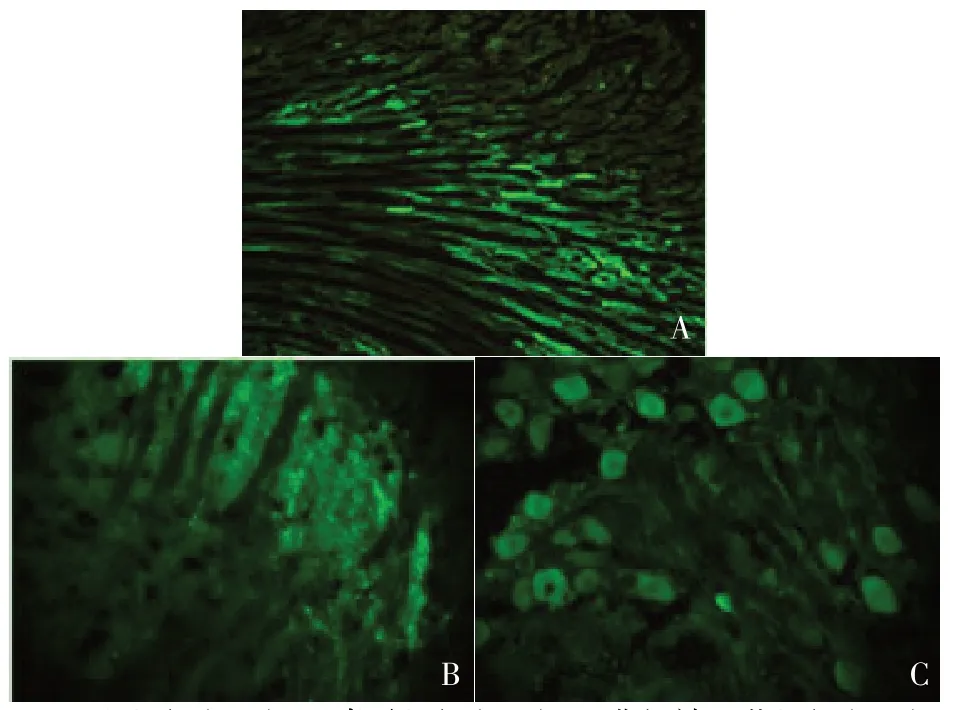
Fig.1 The expression of green fluorescent protein in tissues图1 各组织中绿色荧光蛋白的表达
Tab.6 The expressions of NGF and CGRP in different tissues of each group表6 大鼠不同组织中NGF、CGRP的含量 (ng/g,)
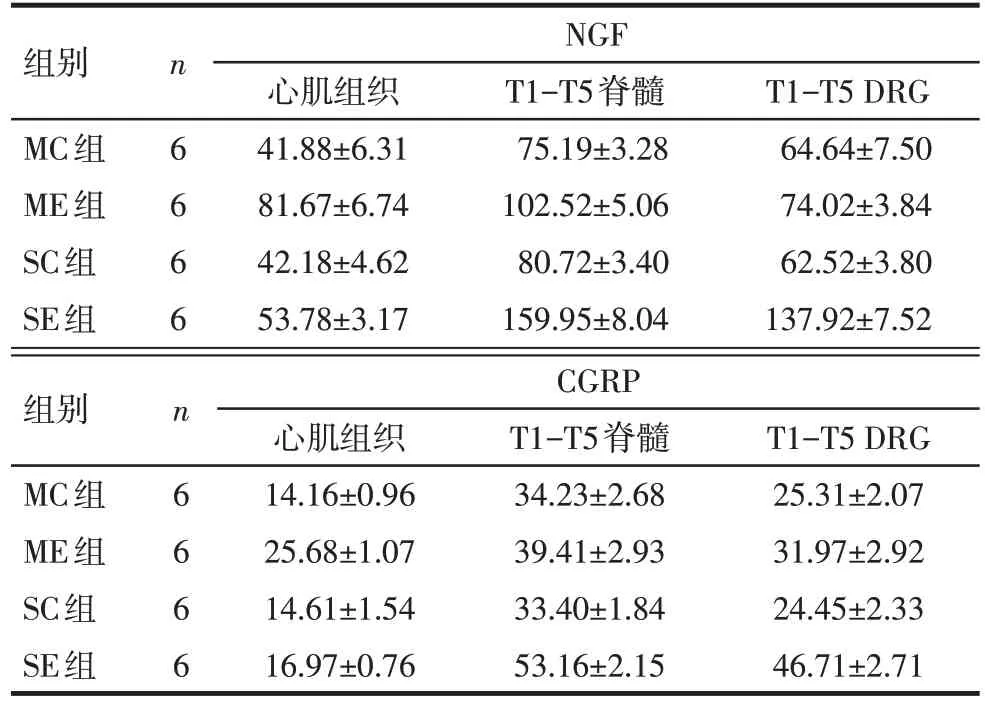
Tab.6 The expressions of NGF and CGRP in different tissues of each group表6 大鼠不同组织中NGF、CGRP的含量 (ng/g,)
组别MC组ME组SC组SE组n6 6 6 6 NGF心肌组织41.88±6.31 81.67±6.74 42.18±4.62 53.78±3.17 T1-T5脊髓75.19±3.28 102.52±5.06 80.72±3.40 159.95±8.04 T1-T5 DRG 64.64±7.50 74.02±3.84 62.52±3.80 137.92±7.52组别MC组ME组SC组SE组n6 6 6 6 CGRP心肌组织14.16±0.96 25.68±1.07 14.61±1.54 16.97±0.76 T1-T5脊髓34.23±2.68 39.41±2.93 33.40±1.84 53.16±2.15 T1-T5 DRG 25.31±2.07 31.97±2.92 24.45±2.33 46.71±2.71
3 讨论
长期的高血糖、低胰岛素血症及血脂异常容易促使DPN 病程的进展[5],使外周小神经纤维的功能和形态受损,引起远端对称性多发性周围神经病变、轴突萎缩、再生潜能减弱[6]。DPN 极易影响心脏的感觉神经,使NGF 及其下游的相关蛋白表达下调,从而导致左室收缩舒张功能障碍,内皮和心肌细胞凋亡,神经纤维变性、缺失和异常再生[7]。糖尿病心脏感觉神经病变发病机制包括缺血性微血管病变、NGF 及其受体的缺乏、晚期糖基化终末产物的过度产生、氧化应激、线粒体功能紊乱等,其中NGF及其受体的缺乏是一个极其重要的机制[8],与本研究结果一致,注射STZ后的DM组大鼠与对照组相比发生了DPN,且第9 周时糖尿病大鼠心肌组织中的NGF的含量显著下调。
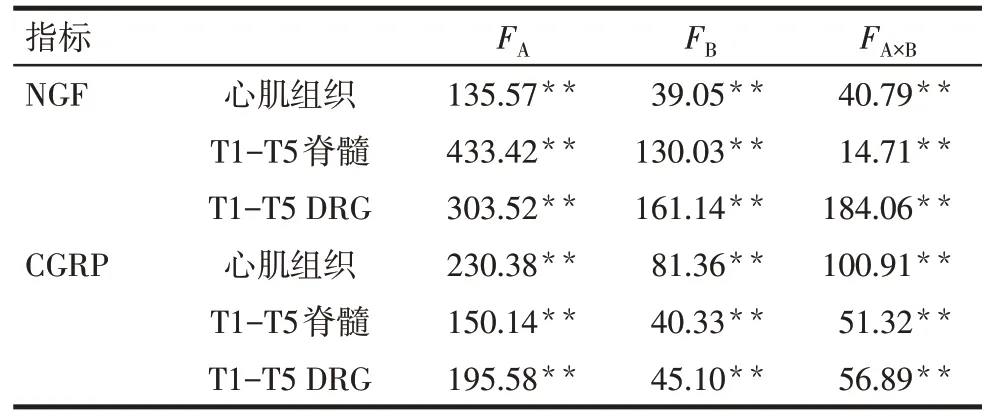
Tab.7 Analysis of variance of factorial design of expressions of NGF and CGRP in different tissues of each group表7 各组大鼠不同组织中NGF、CGRP析因设计方差分析结果
NGF是最早发现的一种介于神经系统和心血管系统之间的神经营养因子,通过受体TrkA 及p75NTR激活PI3K/Akt、MEK/ERK 等通路,上调CGRP 的表达,从而调控神经细胞的分化、增殖及凋亡[2]。心房及心室肌内含有大量的CGRP-IR 纤维,当CGRP 与其受体结合后,可以激活鸟苷酸环化酶,促进细胞内环磷酸腺苷和前列腺素的释放,发挥强大的舒血管作用,同时心肌收缩力、心输出量及心率上升,血液黏稠度降低[13]。实验二中ME组大鼠心肌转染NGF基因后,过表达的NGF 促使心肌组织中的CGRP 含量明显增多,而增多的CGRP使大鼠心脏的收缩及舒张功能明显改善,考虑可能是因为ME 组以心肌点注射法可以有效地转染表达NGF 基因,使下游蛋白CGRP 上调,产生了心脏保护作用,这与Meloni 等[6]的研究结果一致,Meloni 在糖尿病小鼠中外源性补充NGF,从而激活心脏Akt/Foxo3a 通路,促进CGRP等心脏保护性蛋白的表达,营养正常的神经纤维,减少心肌细胞的凋亡,改善糖尿病导致的心脏神经病变。与此同时,大量的研究表明DPN时NGF可以通过降低内质网应激[10],抑制神经细胞、内皮细胞及成纤维细胞的凋亡,促使胰岛β 细胞分泌胰岛素或者上调血管内皮生长因子(VEGF)发挥其强大的生物学效应[11]。已有研究证实,糖尿病心脏感觉神经病变时,高血糖激活多元醇途径,上调醛糖还原酶对葡萄糖的亲和力,使山梨醇含量增高,从而引起神经细胞水肿,神经纤维节段性脱髓鞘,神经细胞丢失大量的内肌醇,引起神经功能减退,同时内皮细胞和神经细胞合成的NGF 及其靶基因CGRP 下调,进一步加重神经的损伤[12]。
基因治疗为糖尿病心脏感觉神经病变开创了新的治疗途径。蛛网膜下腔及心肌点注射法均可将NGF 基因稳定地转染至大鼠体内并过表达,但以心肌点注射法转染时没有DRG 外膜及血脑屏障的限制,且不易受外来物的影响,可以减低炎症免疫反应,技术更加成熟,效果更加确切。在本研究中,分别以心肌点和蛛网膜下腔注射法转染rAAV-NGF基因至糖尿病大鼠体内,结果显示转染rAAV-NGFGFP及以心肌组织为转染途径均可使大鼠的各项心功能指标得到改善,使心肌组织中NGF、CGRP 蛋白含量上调;且两个因素之间存在交互作用,故糖尿病大鼠心肌点注射rAAV-NGF-GFP 时可以发挥更大的心脏保护作用。研究显示,加大腺相关病毒的病毒颗粒可以部分对抗软脊膜、DRG 外膜及血-脑的屏障作用,但过大的病毒颗粒可能会引起机体的免疫炎症反应和神经系统的损伤,从而出现各种新的不可预测的并发症[14]。因此,尽管蛛网膜下腔注射法转染NGF 基因可以改善大鼠的外周感觉神经病变[14],但是病毒携带的基因并不能较好地在心肌组织中转录翻译,不能发挥心脏感觉神经病变的保护作用,故在糖尿病心脏感觉神经病变中心肌点注射法转染NGF基因应作为治疗的更优选择。
综上所述,与蛛网膜下腔注射法相比,心肌点注射法可以增加心肌外源性NGF 的表达,逆转糖尿病大鼠感觉神经病变,改善心功能,产生心脏保护作用,为临床有效地控制DPN,尤其是心脏的感觉神经病变,提供了新的治疗思路。
