右美托咪定减轻新生期大鼠重复七氟醚吸入导致的远期突触可塑性损害
2019-04-09梁小丽桂欢刘程曦张超徐珊张益朱昭琼
梁小丽,桂欢,刘程曦,张超,徐珊,张益△,朱昭琼△
七氟醚是婴幼儿期手术最常用的麻醉药之一,具有诱导后苏醒快、麻醉过程平稳等特点。婴幼儿期是大脑快速发育的时期,在这一阶段反复接受七氟醚麻醉可导致在幼年期和成年期的学习记忆能力下降,而七氟醚对海马神经元突触可塑性的损害可能是其中重要的机制[1]。因此,如何预防七氟醚对发育期大脑海马突触可塑性的影响成为临床上防治七氟醚毒性作用的关键一环。近期有研究显示,α2肾上腺受体激动剂右美托咪定(Dexmedetomidine,Dex)预处理可改善新生期七氟醚吸入导致的神经元凋亡[2],然而Dex 是否可减轻七氟醚导致的远期突触可塑性的损害及由此引起的认知功能损害,目前仍然不清楚。本研究观察Dex预处理对新生期大鼠重复七氟醚吸入导致的远期突触可塑性以及学习记忆能力损害的改善作用,为临床工作提供参考。
1 材料与方法
1.1 材料 (1)实验动物。SD孕鼠7只,购自重庆陆军军医大学实验动物中心[SCXK(渝)2012-0005],孕鼠于SPF级动物房饲养产仔,获得健康新生期SD大鼠48只。(2)主要试剂。七氟醚(益君宁)购于鲁南贝特制药有限公司;钠石灰购于英国Intersurgical 公司。(3)主要仪器。Morris水迷宫测试仪(成都泰盟科技有限公司),麻醉机(德国Drager公司),气体监测仪(上海德尔格医疗设备有限公司),大鼠立体定位仪(美国stoelting公司),Model3000微电极放大器(美国A-M system公司),Mircro1401数模转换器(英国CED公司)。
1.2 方法
1.2.1 动物分组与模型建立 采用随机数字表法将动物分为3 组,分别为空白对照组(C 组)、单纯七氟烷组(S 组)以及Dex 预处理组(DS 组),每组16 只。S 组分别于出生后7、14、21 d 分3 次间断重复吸入2.6%七氟烷+运载气体(1 L/min O2+1 L/min空气)4 h,每次麻醉前20 min腹腔给予3 mL/kg的生理盐水。C组给予3 mL/kg生理盐水后放入相同环境中吸入运载气体4 h,DS组将20µg/kg的Dex稀释至3 mL/kg的生理盐水中,行腹腔注射后再于相同时间点重复吸入七氟烷4 h。大鼠置于自制吸入麻醉箱中,箱底铺一薄层钠石灰,吸入过程中用自制水浴箱加热,控制箱温在30~34 ℃,气体监测仪持续监测,保证进气孔和出气孔七氟烷浓度一致。麻醉过程中监测动物呼吸频率和皮肤色泽,排除发生缺氧者。
1.2.2 学习记忆能力测试 当大鼠成长至幼年期时,采用抓阄法从每组中随机抽取8只大鼠于出生后第31天(d31)时进行Morris 水迷宫实验。直径1.2 m、高60 cm的圆形水池装有温水(23±1)℃,东南西北四个入水点把水池分为四个象限,在第一象限中央放置一直径15 cm,高30 cm 的圆柱形平台,低于水面2 cm。定位航行实验前1 d,所有动物均放置于没有平台的水池中游泳120 s,以充分适应环境并淘汰不会游泳者。出生后第32~36 天(d32~36)行定位航行实验,为期5 d,每天4次,水中加入奶粉使水变浑浊,使平台不可见。将大鼠面向桶壁依次从4个象限入水。记录大鼠找到平台所用时间(即逃避潜伏期)并允许其在平台上停留10 s,如大鼠在120 s内未发现平台,则将其放置于平台10 s,潜伏期计为120 s。d36定位航行实验结束后2 h,行空间探索实验,撤去平台,大鼠游泳120 s,记录在此期间经过原平台位置的次数(跨台次数)。数据的采集和处理由Morris水迷宫图像自动监视处理系统完成。水迷宫实验结束后1 d行在体电生理实验。剩余大鼠继续饲养至成年期,于d91~96 行定位航行实验与空间探索实验,其后行在体电生理实验,方法同幼年期。
1.2.3 在体电生理实验 腹腔注射戊巴比妥钠麻醉后,将大鼠头部固定于大鼠立体定位仪上,根据大鼠脑立体定位图谱(Paul Halasz&Lewis Tsalis,第五版)将自制绑定的同心圆刺激电极和金属记录电极[3]分别放置于海马Schaffer 侧支(前囟后4.2 mm,中线旁开3.8 mm,深度2.6~3.1 mm)和CA1区放射层(前囟后3.7 mm,中线旁开2.9 mm,深度1.8~2.3 mm)。电极放置过程中每10 s 给予1 个0.2 ms 强度为3~6 mA 的测试刺激,观察其诱发的场兴奋性突触后电位(field excitatory postsynaptic potential,fEPSP)的波形特征,以确定刺激和记录电极位置。以能够引起最大fEPSP 斜率刺激强度最小值的50%作为基础刺激强度,波形稳定后记录30 min基础值。在给予高频刺激(high frequency stimulation,HFS)前,采用刺激间隔为25、50、75、100、150、200、250 ms,波宽为50 ms,强度0.1 mA 的连续2 次电刺激诱发双脉冲易化(paired-pulse facilitation,PPF),每30 s 1次,每种刺激间隔给予3个双脉冲刺激,计算PPF 率。PPF 率为第2 个脉冲刺激反应的峰值与第1 个反应峰值之比的百分率。随后给予3 串200 Hz、0.1 mA的HFS以诱发长时程增强,每串20个,串间隔30 s。此后再以基础刺激诱发fEPSP,fEPSP 斜率增加30%,维持30 min以上认为诱发长时程增强(long-term potentiation,LTP)成功,实验记录60 min 以确保LTP 的稳定性。fEPSP 斜率为fEPSP幅度除以时程,均以基础值斜率作为100%,HFS后各时间点的斜率均为在此基础上的百分比。观察比较各组大鼠在37 d和97 d时强直刺激前后不同时间点fEPSP斜率的增幅以及不同刺激间隔的双脉冲刺激所诱发的反应。所有实验完成后大鼠用4%多聚甲醛灌注后取脑,经甲醛固定、乙醇脱水、石蜡包埋后行HE染色,以确定电极位置是否准确。
1.3 统计学方法 所有数据统计学分析均采用SPSS 19.0处理,图表绘制采用GraphPad Prism 6 完成。计量资料采用均数±标准差()表示,2组间均数比较采用独立样本t检验,3组间均数比较采用单因素方差分析,组间多重比较用LSD-t法,P<0.05为差异有统计学意义。
2 结果
2.1 水迷宫实验结果 幼年期(37 d)和成年期(97 d)时的定位航行实验中,5 d内逃避潜伏期均逐渐缩短;各组间逃避潜伏期比较,S组明显长于C组和DS组(P<0.05),C 组与DS 组比较差异无统计学意义;各组跨台次数比较,S 组明显少于C 组和DS 组(P<0.05),C 组与DS 组比较差异无统计学意义,见表1、2。S组成年期第1天和第2天的逃避潜伏期较幼年期明显缩短(t分别为3.139、2.429,P<0.05),而跨台次数较幼年期显著增加(t=3.416,P<0.01)。
2.2 各组LTP 比较 组织染色结果显示所有在体电生理实验电极位置均较为准确,结合脑立体定位以及记录电极波形判断电极位置的方法准确可行,见图1A。37 d、97 d 时HFS 后各组fEPSP 斜率均增加30%以上,维持时间超过30 min,代表性的fEPSP见图1B。幼年期和成年期S组fEPSP斜率在HFS后所有时间点的增幅均明显低于C 组和DS 组(P<0.05);同时,成年期S组大鼠HFS后fEPSP斜率增幅在所有时间点均明显高于幼年期(P<0.05),成年期C 组大鼠HFS 后fEPSP 斜率增幅仅在30 min 和60 min两个时间点高于幼年期(P<0.05),DS组成年期与幼年期比较差异无统计学意义,见图1C、D,表3。
2.3 各组PPF率比较 幼年期S组大鼠在刺激间隔为75、100、150、200、250 ms的PPF率较C组与DS组升高(P<0.05),而成年期S 组大鼠在刺激间隔为100、150、200、250 ms 的PPF 率较C 组与DS 组升高(P<0.05);此外,S 组成年期大鼠与幼年期相比,在刺激间隔为50、100、150、200 ms 时的PPF 率降低(P<0.05),而C组和DS组不同年龄大鼠PPF率比较差异无统计学意义,见图2,表4。
3 讨论
目前临床上接受七氟醚麻醉的新生儿呈逐年增加趋势,新生期七氟醚暴露是否会引起患儿在学龄期和成年期学习记忆能力低于正常人,成为广泛关注的问题。然而,由于临床研究观察周期较长,目前尚未得出确切的结论[4]。大量的动物实验研究仍然显示,新生期重复七氟醚暴露可引起远期海马神经元的凋亡,同时长期抑制海马神经元的LTP,由此导致在幼年期和成年期的学习记忆能力的下降[5-7]。Dex可通过多种途径减少吸入麻醉药导致的发育期神经元凋亡,产生即时神经保护作用[8-9]。然而Dex是否可以逆转新生期重复吸入麻醉药导致的远期毒性作用,目前尚不清楚。
本研究结果显示,Dex 预处理可显著改善新生期大鼠七氟醚暴露对远期海马神经元LTP的抑制作用,并在行为学上显著缓解七氟醚导致的学习记忆能力的障碍,说明了Dex 可通过调节长时程突触可塑性产生远期的神经保护作用。其可能的机制为:Dex通过激活α2受体缓解了发育期七氟醚暴露对脑源性神经营养因子(brain derived neurotrophic factor,BDNF)—原肌球蛋白受体激酶B(tropomyosin receptor kinase B,TrkB)通路蛋白表达的长期抑制[10],使BDNF 等与海马突触可塑性密切相关的蛋白表达上调,从而恢复了海马神经元的LTP效应。
Tab.1 Comparison of escape latency and crossing number between three groups of rats at juvenile age表1 幼年期3组大鼠逃避潜伏期与跨台次数的比较(n=8,)
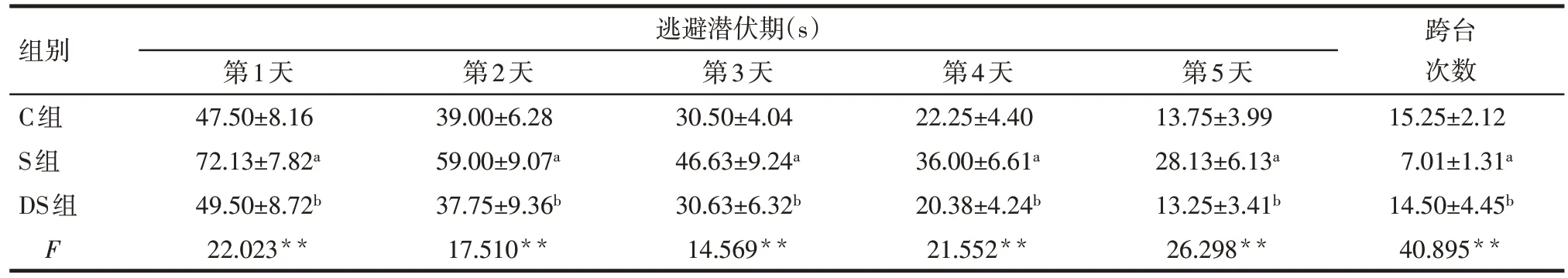
Tab.1 Comparison of escape latency and crossing number between three groups of rats at juvenile age表1 幼年期3组大鼠逃避潜伏期与跨台次数的比较(n=8,)
*P<0.05,**P<0.01;a与C组比较,b与S组相比,P<0.05
组别C组S组DS组F逃避潜伏期(s)第1天47.50±8.16 72.13±7.82a 49.50±8.72b 22.023**第2天39.00±6.28 59.00±9.07a 37.75±9.36b 17.510**第3天30.50±4.04 46.63±9.24a 30.63±6.32b 14.569**第4天22.25±4.40 36.00±6.61a 20.38±4.24b 21.552**第5天13.75±3.99 28.13±6.13a 13.25±3.41b 26.298**跨台次数15.25±2.12 7.01±1.31a 14.50±4.45b 40.895**
Tab.2 Comparison of escape latency and crossing number between three groups of rats at adult age表2 成年期3组大鼠逃避潜伏期与跨台次数的比较(n=8,)
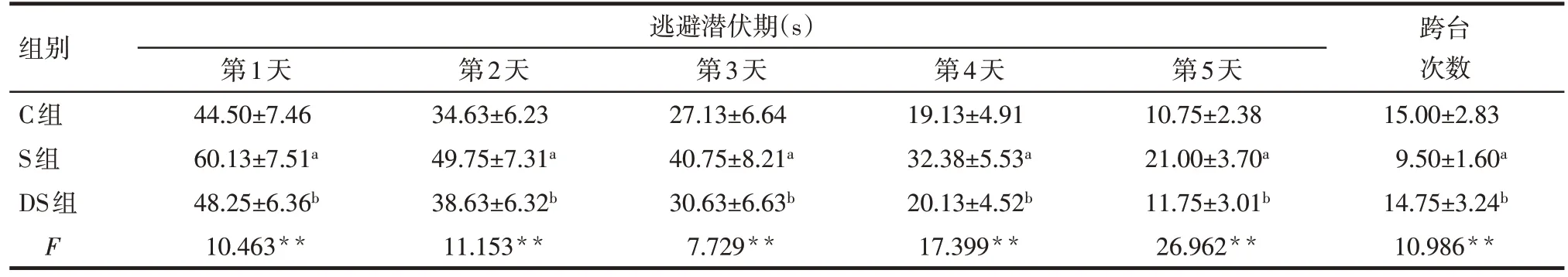
Tab.2 Comparison of escape latency and crossing number between three groups of rats at adult age表2 成年期3组大鼠逃避潜伏期与跨台次数的比较(n=8,)
*P<0.05,**P<0.01;a与C组比较,b与S组相比,P<0.05
组别C组S组DS组F逃避潜伏期(s)第1天44.50±7.46 60.13±7.51a 48.25±6.36b 10.463**第2天34.63±6.23 49.75±7.31a 38.63±6.32b 11.153**第3天27.13±6.64 40.75±8.21a 30.63±6.63b 7.729**第4天19.13±4.91 32.38±5.53a 20.13±4.52b 17.399**第5天10.75±2.38 21.00±3.70a 11.75±3.01b 26.962**跨台次数15.00±2.83 9.50±1.60a 14.75±3.24b 10.986**
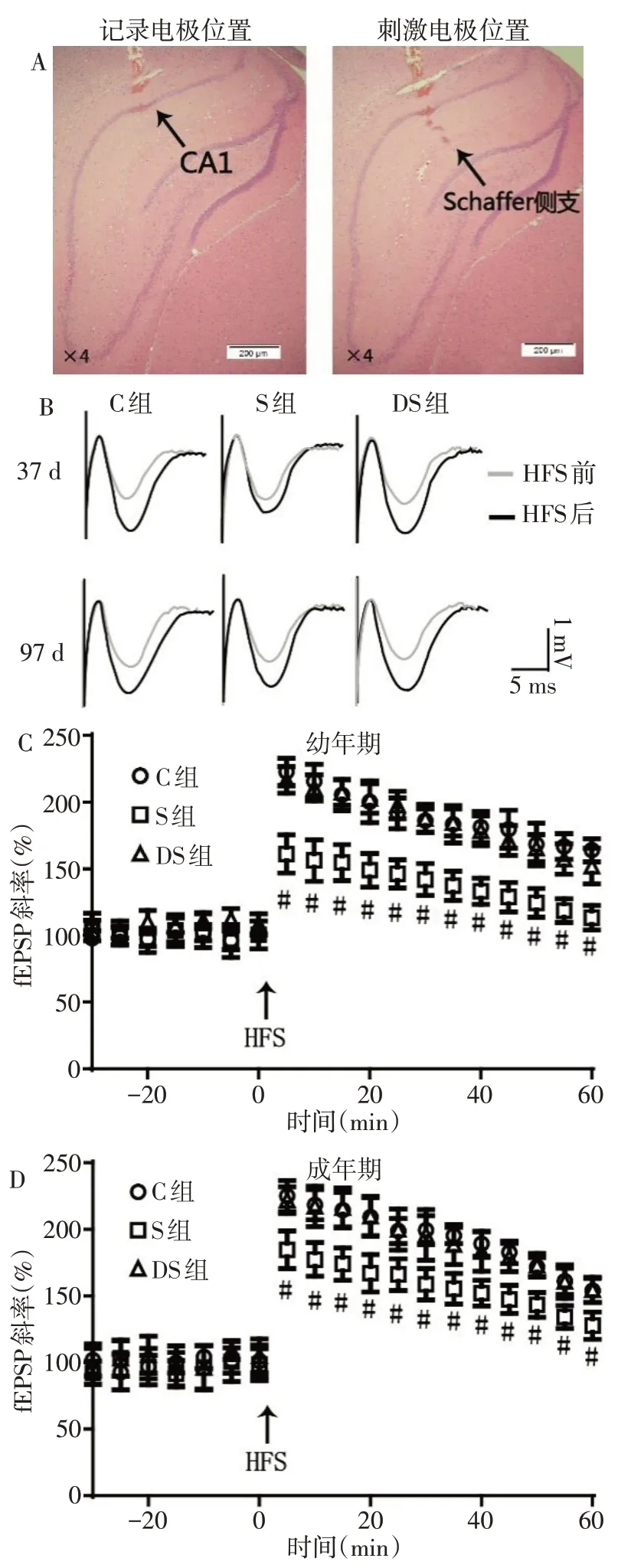
Fig.1 DEX preconditioning ameliorated the suppression on LTP at CA1 region induced by repeated neonatal sevoflurane exposure at both juvenile and adult age图1 DEX预处理可显著改善新生期重复七氟醚吸入导致的幼年期和成年期海马CA1区LTP抑制
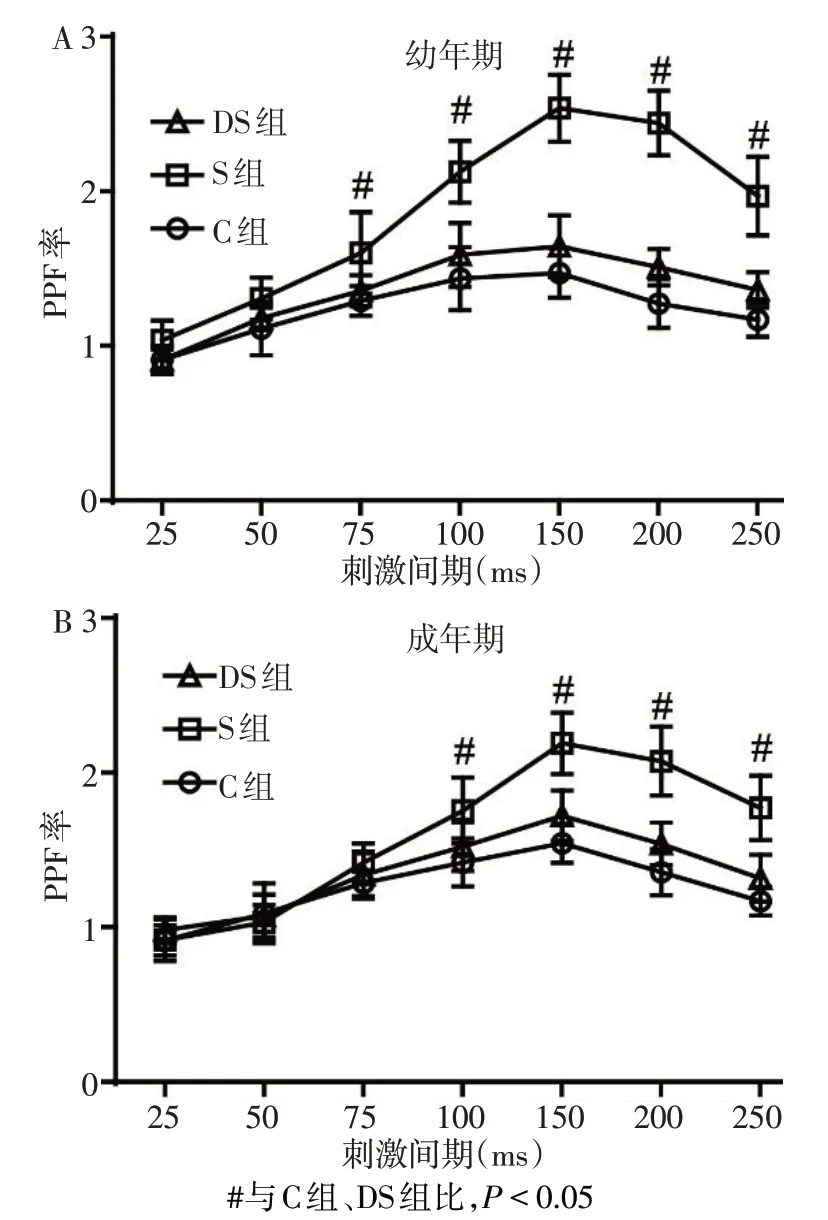
Fig.2 DEX preconditioning reversed the effect of repeated neonatal sevoflurane exposure on PPF ratio of neurons in hippocampal CA1 region at juvenile and adult age图2 DEX预处理可逆转新生期重复吸入七氟醚对幼年期和成年期海马CA1区神经元PPF率的影响
此外,Dex 还可显著逆转由新生期大鼠七氟醚吸入引起的PPF率升高。PPF率可反映短时程突触可塑性,后者在海马的功能活动中也扮演着重要的角色[11]。双脉冲易化主要由突触前机制参与,笔者前期研究显示新生期重复吸入七氟醚后在幼年期和成年期不同的刺激间期的PPF 率均明显升高[12],这可能与突触前膜内Ca2+浓度异常增加有关[13]。而有研究显示,Dex 可抑制海马神经元突触前膜钙离子流,降低突触前膜钙离子浓度[14],这可能正是本研究运用Dex 预处理后,PPF 率在新生期大鼠单纯七氟醚暴露基础上发生明显降低的重要原因。
有研究表明,新生期腹侧海马损伤的大鼠在42 d 后因损伤而引起的异常行为逐渐消失,到70 d 时原有全脑广泛的糖代谢异常变化仅限于小部分的脑区,这一过程可能与大脑神经元的重组修复有关[15]。本研究也发现,无论是在行为学、LTP 还是PPF 率,新生期重复吸入七氟醚的影响在成年期时较幼年期明显降低,说明尽管新生期七氟醚吸入的影响可持续至成年期,但其严重程度明显减轻,这也可能是由于损伤的神经网络代偿与重组所致。而在给予Dex预处理后,幼年期和成年期的异常行为学和电生理指标均趋于正常,两者之间差异消失,这进一步说明了Dex对新生期大鼠七氟醚暴露的远期保护作用。
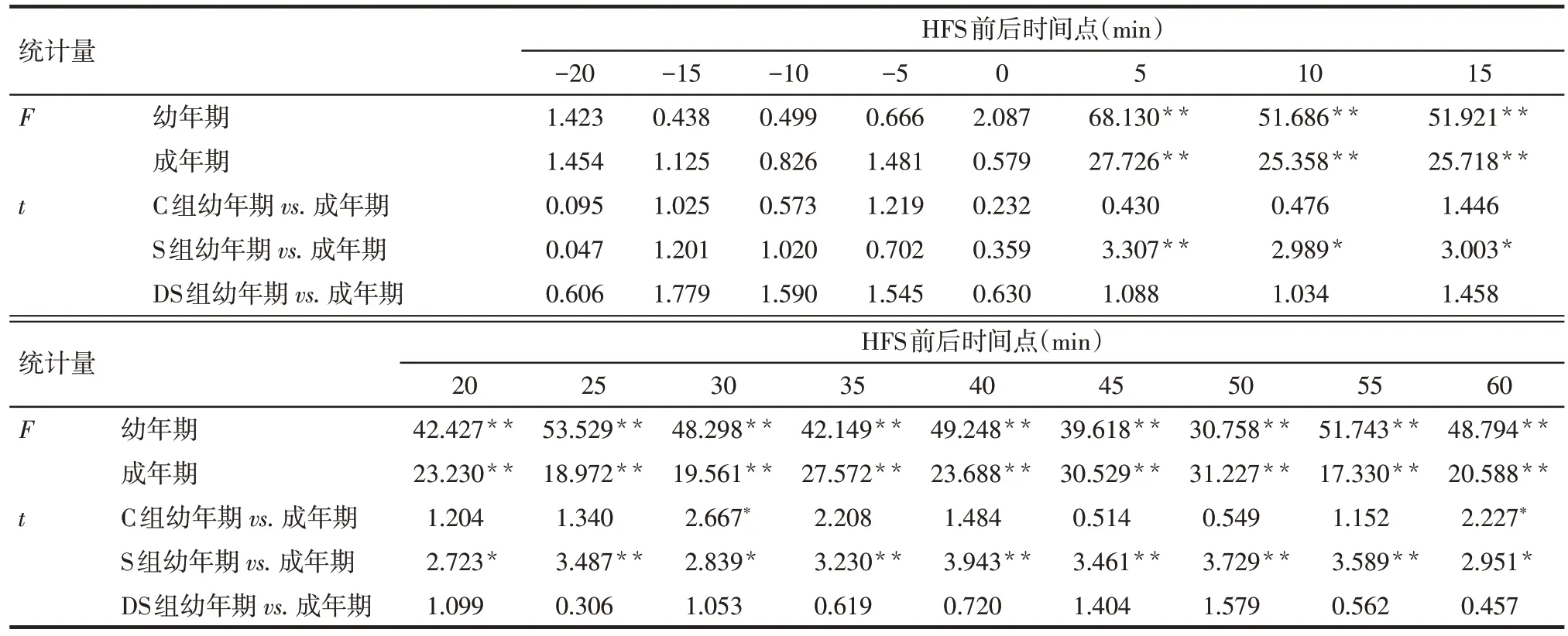
Tab.3 Comparison of F value for fEPSP slope before and after HFS between three groups and t value for fEPSP slope between juvenile and adult groups表3 3组大鼠高频刺激前后fEPSP斜率比较F值以及各组幼年与成年期fEPSP斜率比较t值
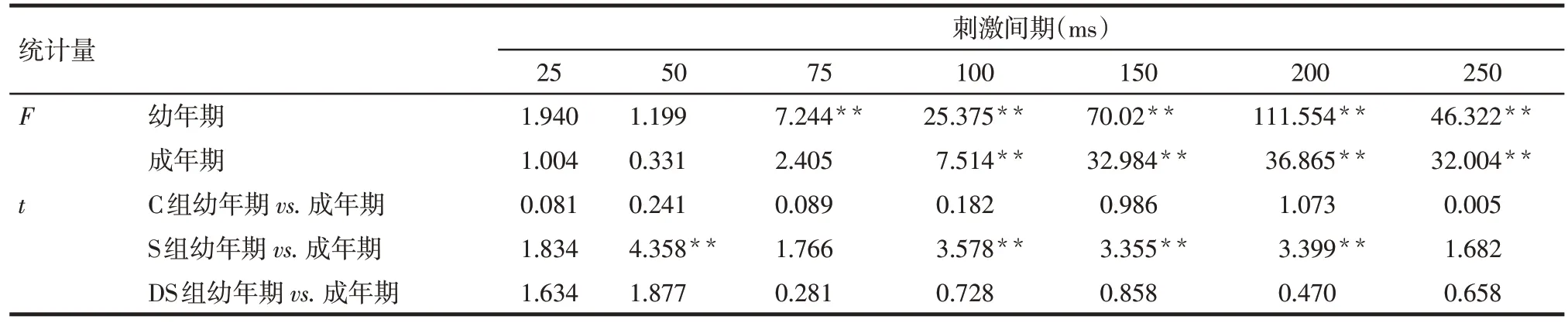
Tab.4 Comparison of F value for PPF ratio between three groups and t value for PPF ratio between juvenile and adult groups表4 3组大鼠PPF率比较F值及各组幼年期与成年期PPF率比较t值
综上所述,新生期大鼠七氟醚重复暴露可导致幼年期和成年期长时程、短时程突触可塑性以及学习记忆能力的异常,Dex预处理可逆转这些改变,改善认知功能,为临床上防治七氟醚对发育期大脑的不良影响提供了新的策略。
