乏氧和低糖条件下低表达ESE3促进胰腺癌细胞的侵袭
2019-04-09肖笛赵天锁俞鸣
肖笛,赵天锁,俞鸣△
胰腺癌是世界范围内第4大恶性消化道肿瘤,5年总体生存率不足7%[1]。究其原因,是由于绝大部分胰腺癌患者发生了淋巴结和/或远端器官转移[2]。上皮特异性ETS 转录因子3(ESE3)定位于染色体11p12,在上皮细胞中特异性地表达[3]。目前,在多种恶性肿瘤中,ESE3 均被认为是抑癌基因,其同时作为核转录因子,可以特异地识别GGAA/T序列,调控下游靶基因的表达,在恶性肿瘤的发生发展中发挥着重要功能[4]。胰腺癌实体肿瘤常处于乏氧微环境中,有文献报道胰腺癌亦处于低糖微环境之中[5]。但是胰腺癌细胞ESE3 表达水平在乏氧和低糖压力刺激下的变化目前尚鲜见报道。本研究旨在探讨乏氧和低糖微环境中ESE3对胰腺癌细胞侵袭的影响,为胰腺癌的防治提供新思路。
1 资料与方法
1.1 一般资料
1.1.1 患者标本 收集2005年1月—2014年10月在天津医科大学肿瘤医院经组织病理学诊断为胰腺导管腺癌(PDAC)且接受根治性手术切除的肿瘤组织标本99例,其中包含邻近正常胰腺组织标本16例。所有患者术前均未经化疗或放疗,随访至2017年1月。本研究经天津医科大学肿瘤医院伦理道德委员会批准。
1.1.2 细胞与试剂 人胰腺癌细胞株PANC-1、SW1990由天津医科大学肿瘤医院肿瘤研究所保存。常规DMEM培养基、低糖DMEM 培养基和胎牛血清均购于Gibco(美国)公司;ESE3 及其空白对照慢病毒购于上海吉玛基因;嘌呤霉素购于InvivoGen 公司(美国);基质胶购自BD Bioscience(美国);Transwell 小室购自Corning公司(美国);核-浆分离试剂盒与BCA 蛋白定量试剂盒购于Thermo Fisher Scientific(美国);兔抗人ESE3多克隆抗体购自LifeSpan BioSciences(美国);免疫组化试剂盒、鼠抗人HIF-1α 单克隆抗体和兔抗人GRP78 多克隆抗体购自Abcam 公司(英国);鼠抗人β-antin、β-Tublin和Lamin B1 单克隆抗体以及兔抗人α-Tublin 多克隆抗体购自武汉三鹰公司。
1.2 方法
1.2.1 免疫组化分析ESE3表达水平及判定方法 按照免疫组化试剂盒说明书将入组的99例标本的组织芯片经脱蜡、梯度乙醇水化、蒸馏水以及抗原修复后,加50µL 的ESE3 抗体(1∶200稀释),4 ℃过夜孵育后滴加二抗,室温孵育1 h,DAB显色后光镜下观察表达水平。根据ESE3阳性细胞染色强度和百分比进行半定量评分。染色强度评分为0(阴性)、1(低)、2(中)、3(高)。阳性细胞百分比评分为0(无染色)、1(1%~25%染色)、2(26%~50%染色)、3(51%~100%染色)。最终染色评分通过强度评分×面积评分来确定,范围0~9。最终评分低于5被认为阴性或低表达,5~9被认为中高表达。
1.2.2 TCGA 数据库验证肿瘤转移和肿瘤大小与ESE3 mRNA 表达水平的关系 选取TCGA 数据库(http://www.cbioportal.org/)中147例PDAC 患者的临床资料,并对患者ESE3 mRNA 表达水平进行归一化处理[6],按照有无淋巴结和/或器官转移,分为转移组和非转移组;同时以3 cm为截断值[7]将PDAC 患者分为肿瘤≥3 cm 组和肿瘤<3 cm 组,验证肿瘤转移和肿瘤大小与ESE3 mRNA表达水平的关系。
1.2.3 构建PANC-1 过表达ESE3 稳定转染细胞系 利用慢病毒载体在低内源ESE3 表达的PDAC 细胞系PANC-1 中特异性的过表达ESE3,嘌呤霉素(1 g/L)筛选48 h 后得到稳定转染的细胞系。并应用蛋白质免疫印迹法对转染效率进行验证。转染空载质粒的细胞记为pCDH-Vector,转染过表达ESE3 质粒的细胞记为pCDH-ESE3。
1.2.4 细胞迁移实验检测PANC-1 细胞侵袭能力 使用铺有1∶5 稀释的基质胶的Transwell 小室进行细胞迁移能力测定,用含有2%胎牛血清的DMEM培养基重悬细胞,每个上室分别加入2×105个PANC-1 和PANC-1 过表达ESE3 细胞,含有10%胎牛血清的DMEM 培养基加入下室中,分别在常氧、乏氧和低糖条件下孵育细胞36 h,将迁移至小室底部的细胞使用三步染色法染色。
1.2.5 蛋白质免疫印迹法检测ESE3、HIF-1α、GRP78表达情况 使用含10%胎牛血清的常规DMEM 培养基和含10%胎牛血清的低糖DMEM 培养基(含葡萄糖1 000 mg/L)培养PANC-1、SW1990细胞,放置于37 ℃、5%CO2的空气湿润的孵箱中0、6、12 h;乏氧处理时将细胞放置入乏氧孵箱中(0.1%O2、5%CO2和N2平衡气中)37 ℃孵育,分别培养0、6、12 h。PANC-1、SW1990细胞经预冷PBS冲洗2遍后加入含有蛋白酶抑制剂的十二烷基磺酸钠(SDS)细胞裂解液,研磨裂解取总蛋白,100 ℃加热10 min。按照核-浆分离试剂盒说明书步骤提取上述乏氧和低糖条件下PANC-1、SW1990细胞的核蛋白与浆蛋白。HIF-1α、GRP78 分别作为乏氧和低糖的标志蛋白,Lamin B1作为核蛋白内参,α-Tubulin作为浆蛋白内参,β-actin或β-Tublin作为总蛋白内参。BCA法进行蛋白定量后每孔上样20µg 于10%SDS-PAGE 电泳分离,以260 mA恒流转至PVDF 膜。用5%脱脂牛奶室温封闭2 h,使用相应的抗体检测目的蛋白,ECL曝光显影。
1.3 统计学方法 采用SPSS 20.0 和GraphPad Prism 6 软件分析数据。数据采用均数±标准差()或M(P25,P75)表示,组间比较采用t检验、秩和检验或方差分析。多重比较用SNK-q检验。计数资料组间比较采用χ2检验。使用Kaplan-Meier 法估计不同ESE3 表达者的累积生存率,并用Log-rank法比较总生存率的差异。P<0.05为差异有统计学意义。
2 结果
2.1 ESE3蛋白在胰腺癌组织中的表达情况 99例胰腺癌组织ESE3 中高表达64例(64.65%),低表达35例(35.35%);16例正常胰腺组织中ESE3 中高表达12例(75.00%),低表达4例(25.00%)。与正常胰腺组织相比,胰腺癌组织中ESE3 的表达水平降低(χ2=8.959,P<0.01),见图1。
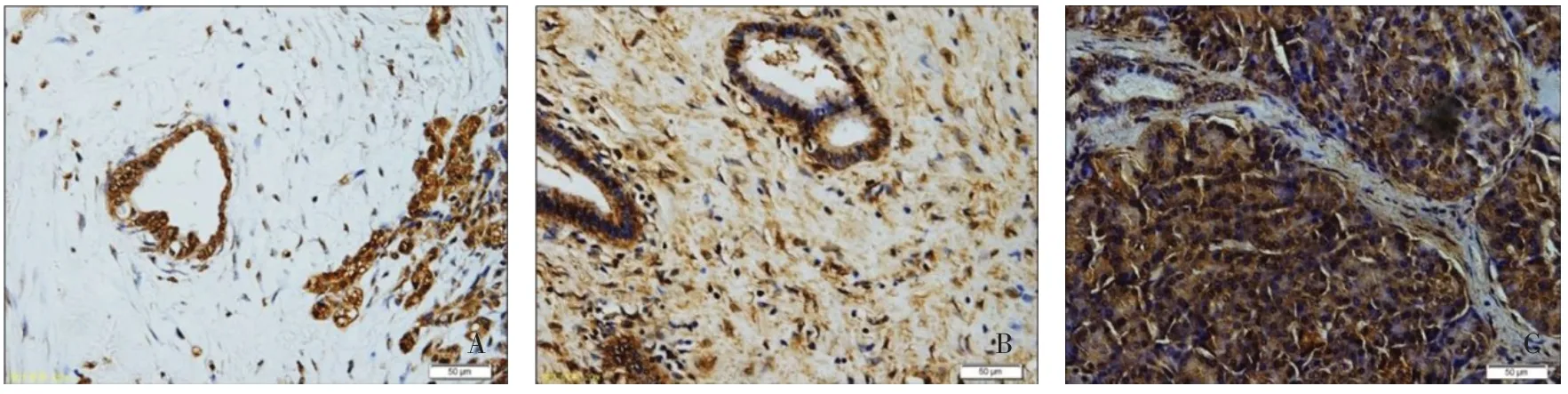
Fig.1 Results of the expression levels of ESE3 in tissues by optical microscope(immunohistochemistry stain,×200)图1 光学显微镜观察组织中ESE3的表达水平(免疫组化染色,×200)
2.2 胰腺癌中ESE3表达水平与预后的关系 结果表明,具有低表达ESE3的PDAC患者与高表达ESE3的PDAC 患者比较,总生存期(OS,14 个月vs.17 个月,HR=1.505,95%CI:1.042~2.600,Log-rankχ2=4.096,P=0.043)和无复发生存期(DFS,7 个月vs.11个月,HR=1.761,95%CI:1.280~3.316,Log-rankχ2=7.942,P=0.005)更短,见图2。
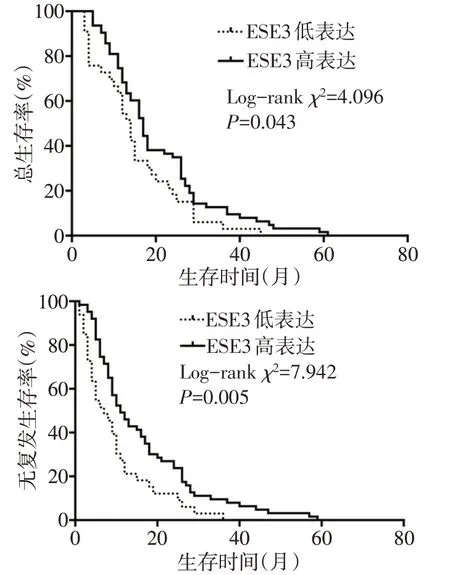
Fig.2 OS curve and DFS curve with different ESE3 expression levels图2 不同ESE3表达水平患者的OS曲线和DFS曲线图
2.3 TCGA 数据库验证结果 转移组患者的ESE3表达量低于非转移组(P<0.05);不同肿瘤大小组的ESE3表达量差异无统计学意义,见表1。
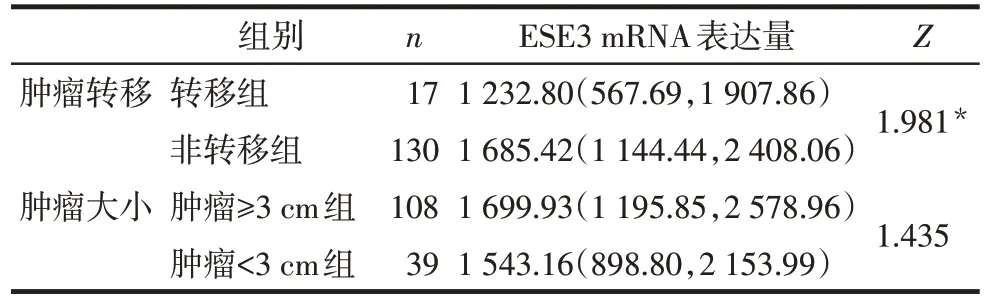
Tab.1 Comparison of ESE3 mRNA expression in different clinicopathological data in TCGA database表1 TCGA数据库中不同临床病理资料中ESE3 mRNA表达量的比较 [M(P25,P75)]
2.4 过表达ESE3 稳转细胞系验证 实验结果显示,与空载质粒相比,pCDH-ESE3 质粒可有效增加PANC-1细胞中ESE3的蛋白表达,见图3。
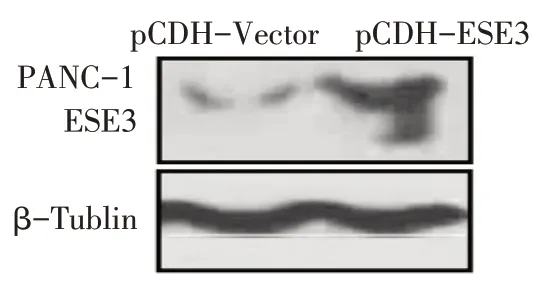
Fig.3 The verification of ESE3 overexpression cell line图3 过表达ESE3稳转细胞系验证结果
2.5 乏氧和低糖条件下过表达ESE3抑制胰腺癌细胞侵袭的能力 细胞迁移实验结果发现过表达ESE3抑制了PANC-1细胞的侵袭能力;而在乏氧和低糖条件下,过表达ESE3的PANC-1细胞的侵袭能力与常规条件培养的过表达ESE3 的PANC-1 细胞相比显著增强(F=552.333,P<0.01),见图4。
2.6 胰腺癌细胞中ESE3 和HIF-1α、GRP78 表达的关系 结果表明,乏氧和低糖条件下的PANC-1 和SW1990 细胞系随着处理时间的延长,ESE3 表达降低,HIF-1α、GRP78表达增加,见图5A~D。PANC-1细胞过表达ESE3后,ESE3蛋白表达增加,同样伴随HIF-1α、GRP78 表达降低,见图5E。乏氧和低糖条件下处理PANC-1、SW1990 胰腺癌细胞系12 h 后,在细胞核中ESE3表达降低,而HIF-1α、GRP78的表达增加,见图5F~I。
3 讨论
3.1 ESE3 在胰腺癌组织中低表达 有文献报道,食管鳞状细胞癌[8]和前列腺癌[9-10]的肿瘤组织中ESE3蛋白的表达缺失。在本研究中,考虑到用RT-qPCR检测mRNA表达水平的不稳定性,本文仅从蛋白水平观察ESE3 在胰腺癌组织及胰腺癌细胞中的变化情况。发现胰腺癌组织中ESE3 蛋白表达水平比正常胰腺组织降低。为了进一步探讨ESE3 的表达在PDAC进展中的意义,对患者ESE3表达水平与其临床信息及病理资料之间的关系经单因素分析,结果显示ESE3 的表达缺失与胰腺癌的不良预后相关,这表明ESE3 低表达是影响胰腺癌患者OS 和DFS 的危险因素。TCGA 数据库证实肿瘤的转移与ESE3 的表达水平密切相关,因此,ESE3蛋白表达的缺失在胰腺癌的进展过程中起重要的作用。此外,同样发现了支持ESE3 作为胰腺癌抑癌基因的有力证据,使用ESE3稳定过表达的PANC-1细胞系来评估其侵袭能力的改变,发现ESE3的过表达可以抑制PANC-1细胞的侵袭能力。
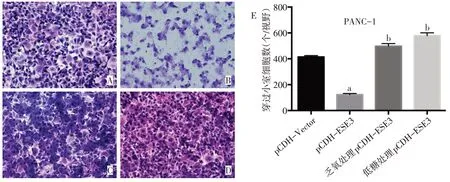
Fig.4 Overexpression of ESE3 under hypoxic and glucose deprived conditions inhibited the invasion of PDAC cells(×100)图4 在乏氧和低糖条件下过表达ESE3抑制胰腺癌细胞侵袭的能力降低(×100)
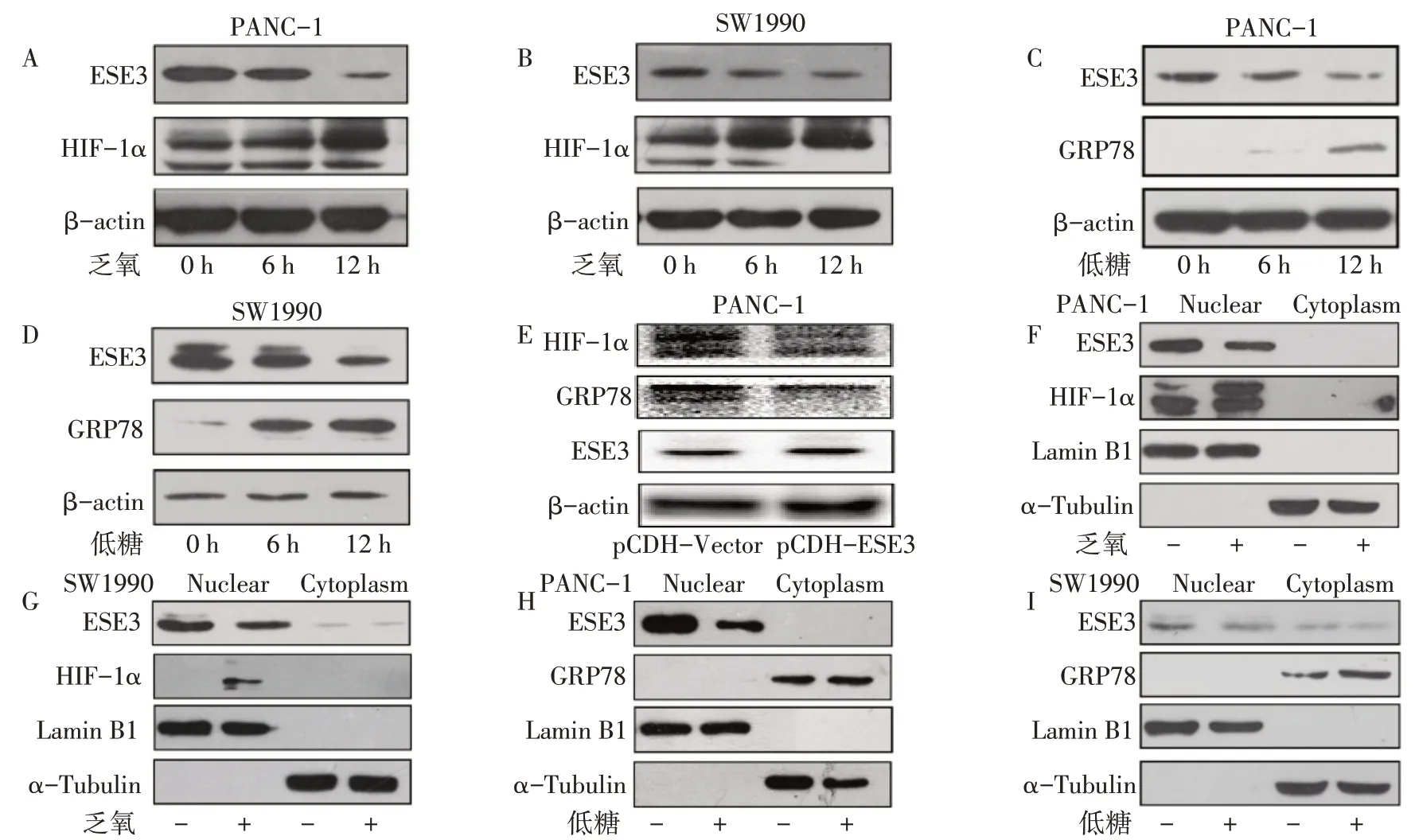
Fig.5 The relationship between the expression of ESE3 and HIF-1α,GRP78 in PDAC cell line图5 胰腺癌细胞中ESE3和HIF-1α、GRP78表达的关系
3.2 乏氧和低糖可以降低ESE3抑制胰腺癌细胞的侵袭能力 胰腺癌组织一般处于乏氧和低糖的肿瘤微环境中,Zhu 等[11]课题组证实了胰腺导管腺癌组织中存在HIF-1α过表达,并且其过表达与淋巴结转移相关。乏氧可以通过激活核转录因子HIF-1α 改变下游靶基因的转录水平[12]。另一方面,与正常细胞相比,肿瘤细胞对葡萄糖的摄取及代谢均处于增高状态,糖代谢的增加是许多恶性肿瘤的显著特征[5]。同时胰腺癌组织中HIF-1α、GRP78的过表达可以提高血管内皮生长因子(VEGF)和成纤维细胞生长因子(FGF)的表达,从而促进肿瘤血管的新生,并与胰腺癌的转移相关[13]。为了在体外进一步了解ESE3 在乏氧和低糖条件下对胰腺癌细胞侵袭作用的影响,本研究对过表达ESE3的稳定转染细胞系进行乏氧和低糖条件处理,结果发现,与pCDH-ESE3组相比,乏氧和低糖条件下的pCDH-ESE3胰腺癌细胞系的侵袭能力有所增强,提示乏氧和低糖微环境中ESE3的变化可能与肿瘤转移相关。随后,使用蛋白质免疫印迹法观察到在乏氧和低糖条件下ESE3总蛋白的表达水平降低,同时伴随HIF-1α、GRP78总蛋白表达水平增高;使用pCDH-ESE3 质粒转染PANC-1 细胞系后,随着ESE3 总蛋白的增加HIF-1α、GRP78总蛋白的表达下调。
由于ESE3作为核转录因子,在细胞核中执行转录调控的功能,直接调控下游靶基因,有文献报道,ESE3可以直接结合并调控E-cadherin 的启动子区,促进其表达,影响肿瘤细胞的浸润和转移[14]。为了验证在乏氧和低糖条件下ESE3 蛋白在细胞核中的表达是否发生变化,本研究使用了核浆分离方法,结果表明ESE3蛋白在细胞核中表达降低,也伴随着与HIF-1α、GRP78在细胞核中的表达水平增高。
综上所述,在胰腺癌组织中ESE3表达水平显著低于正常胰腺组织。此外,ESE3表达水平的降低与胰腺癌的转移密切相关,低表达ESE3的胰腺癌患者预后不良。另在胰腺癌细胞系中,证实乏氧和低糖条件可以降低ESE3蛋白的表达,从而促进胰腺癌细胞系的侵袭,且ESE3与HIF-1α、GRP78呈负性表达关系。但乏氧和低糖引起ESE3 表达降低的具体机制还有待进一步研究,期望今后随着本课题组对胰腺癌肿瘤微环境中各个组分及分子机制之间的深入研究,为肿瘤治疗能提供更新的思路与方法。
