U0126对谷氨酸神经毒性损伤模型大鼠的脑保护作用
2019-04-09赵精咪孙莉梁浩程焱
赵精咪,孙莉,梁浩,程焱
兴奋性氨基酸(EAA)是存在于人体中枢神经系统的兴奋性神经递质。其中谷氨酸是最重要的EAA之一,对神经元的生长、存活,突触的连接及适应性生长都有着重要作用。约1/3 的中枢神经系统神经元的信息传递需要谷氨酸及其受体的参与,这些神经元主要分布在大脑皮质和海马,参与学习、行为、记忆等多种重要神经功能[1]。正常生理环境下,谷氨酸通过三羧酸循环、谷氨酸-谷氨酰胺循环等途径完成生成、释放、摄取和失活过程,可避免神经元暴露于高浓度谷氨酸而造成神经损伤[2]。当机体受到代谢、免疫、缺血等方面损伤时,谷氨酸平衡被破坏,大量谷氨酸堆积造成神经毒性损伤。近年来研究发现,许多神经系统疾病,如阿尔茨海默病(AD)[3]、帕金森病(PD)[4]、肌萎缩侧索硬化(ALS)[5-6]、多发性硬化(MS)[7]、亨廷顿病(HD)[8]、精神分裂症[9]、癫痫[10]、重度抑郁及双相障碍[11]等都与谷氨酸神经毒性损伤因素有关。MAPK/ERK1/2(mitogen-activated protein kinase/extracellular signal-regulated kinase 1/2)是介导细胞增殖分化的重要信号通路,在维持细胞正常形态、组织结构和增殖方面具有重要作用。然而,在某些损伤条件下,MAPK/ERK1/2 信号通路也可被激活,参与细胞损伤。已有研究显示,谷氨酸兴奋毒性损伤可引起MAPK/ERK1/2激活,但目前对于MAPK/ERK1/2 抑制剂在谷氨酸神经兴奋性毒性损伤中的作用尚存在争议[12-14],且这些研究结果多来源于体外研究,鲜有体内相关研究。基于此,本研究通过开展大鼠体内的谷氨酸兴奋性毒性研究,以期明确MAPK/ERK1/2 抑制剂对谷氨酸毒性损伤的保护作用。
1 材料与方法
1.1 实验动物 成年健康雄性SD 大鼠50 只,体质量260~280 g,由北京华阜康生物科技股份有限公司提供。分笼饲养于室温、自然光环境下昼夜循环,自由饮水,标准饲料喂养。所有动物实验前适应性喂养至少3 d。
1.2 试剂与仪器 N-甲基-D-天冬氨酸(NMDA)购自Sigma公司,MAPK/ERK1/2抑制剂U0126购自Merck millipore公司;小鼠抗总ERK1/2 抗体、小鼠抗p-ERK1/2 抗体、小鼠抗Caspase-3(活化形式)抗体、小鼠抗环氧合酶-2(COX-2)抗体均购自Santa cruz 公司;兔抗诱导型一氧化氮合酶(iNOS)购自ABclonal 公司;免疫荧光染色一抗及兔抗NeuN 抗体购自Abcam公司;蛋白质印迹实验及免疫荧光染色实验二抗均购自北京中杉金桥生物技术有限公司。石蜡切片机购自日本Shandon 公司;低温高速离心机购自美国Kendro 公司;Western blot电泳与转膜系统购自美国Bio-Rad公司;凝胶成像仪购自美国Syngene公司。
1.3 谷氨酸神经毒性损伤模型建立 大鼠术前禁食水6 h,10%水合氯醛(0.35 mL/100 g)腹腔注射麻醉。麻醉成功后使大鼠呈俯卧位,将头部固定于立体定位仪。头顶皮肤剃毛、消毒,正中位切口,逐层分离肌肉、筋膜,暴露前囟。以前囟为0点,坐标为AP+0.5 mm,L 3.5 mm,墨水标记,用牙科钻于标记处钻开颅骨,垂直进针,进针深度为1.2 mm,予以药物注射(1µL)。注射完成后每5 min拔针0.5 mm,直至完全退针。缝合头皮切口并再次消毒。(1)NMDA 最佳作用浓度筛选。实验设正常组(单纯手术处理)、对照组(开颅后注射1µL生理盐水)和不同浓度(50、100、200 mmol/L)NMDA处理组。(2)最佳作用时间筛选。选取最优的NMDA处理浓度,注射后观察3、6、12、24 h,实验另设正常组和对照组。
1.4 分组及处理 根据已选定的最佳条件,实验设对照组,U0126(2 g/L)单独处理组、NMDA 单独处理组、不同浓度(0.5、1、2 g/L)的U0126与NMDA联合处理组。对照组皮层注射1µL生理盐水,单纯U0126处理组注射1µL的U0126(2 g/L),U0126+NMDA 组于NMDA 注射前30 min 分别注射1 µL 0.5、1、2 g/L的U0126,各组均处理24 h。
1.5 HE 染色 将造模完成后的大鼠水合氯醛腹腔注射麻醉,打开胸腔,从心尖部插入至升主动脉,灌注预冷的磷酸盐缓冲液(PBS)150 mL,断头法处死后剥取完整脑组织于4%多聚甲醛中固定15 h。将脑组织置于大鼠脑模具中,以针刺点为中心,前后各切2 mm,然后取脑组织。将4 mm厚脑组织切片分别经梯度乙醇脱水、二甲苯透明后浸蜡包埋,切片。将切片组织脱蜡、脱水后苏木精染色2 min,伊红染色1 min,后再次经梯度乙醇脱水脱色、二甲苯梯度透明后中性树胶封片,然后于显微镜下观察组织细胞形态变化。
1.6 组织免疫荧光染色 将低温冰冻切片室温下复温15 min后于冰丙酮中固定10 min,PBS洗涤3遍,0.3%Triton X-100 破膜15 min,PBS 洗涤3 遍,5%BSA 室温封闭1 h 后滴加NeuN(1∶1 000)、p-ERK1/2(1∶50)一抗混合液于4 ℃过夜。次日PBS 洗涤3 遍后滴加相应种属二抗(1∶120)混合液常温避光孵育1 h,PBS洗涤3遍后滴加DAPI,封片后于荧光显微镜下观察。
1.7 蛋白质免疫印迹实验 取距入针部位前后左右各3 mm的正方形脑皮层组织,组织剪剪碎后每100 mg脑组织加入1 mL 裂解液于冰上超声匀浆、裂解30 min。4 ℃,13 000 r/min离心15 min 取上清。BCA 法测定蛋白浓度,各组取50µg 蛋白,经10%SDS-PAGE 凝胶电泳(80 V,30 min 后120 V,50 min),电转法将蛋白转至PVDF 膜(100 V,70 min),5%脱脂奶粉封闭1 h,选择相应一抗4 ℃孵育过夜[小鼠抗GAPDH抗体、小鼠抗总ERK1/2抗体、小鼠抗磷酸化-ERK1/2(p-ERK1/2)抗体、小鼠抗Caspase-3(活化形式)抗体、小鼠抗COX-2抗体稀释比例均为1∶200,兔抗iNOS抗体稀释比例为1∶1 000]。室温下将膜与相应HRP标记二抗(1∶5 000)孵育1 h,之后进行ECL化学显影。使用Image J软件进行条带灰度值测定。
1.8 统计学方法 采用GraphPad Prism 6.0统计软件进行统计分析。符合正态分布的计量资料以均数±标准差()表示,对照组与正常组比较用独立样本t检验,NMDA不同浓度及不同时间组分别与对照组相比用单因素方差分析;U0126处理中,U0126组与正常组比较用独立样本t检验,NMDA 组与U0126 不同浓度处理组之间的比较用单因素方差分析。P<0.05表示差异有统计学意义。
2 结果
2.1 NMDA 引起大鼠皮层兴奋毒性损伤 50、100、200 mmol/L的NMDA注入大鼠皮层后24 h,其炎症、凋亡相关指标COX-2、iNOS、Caspase-3(活化形式)均明显增高(P<0.05),且具有NMDA 浓度依赖性,选200 mmol/L NMDA 作后续实验;同时,200 mmol/L的NMDA 皮层注射3、6、12、24 h 后,COX-2、iNOS、Caspase-3(活化形式)随时间增加而明显增高(P<0.05),见图1。HE染色结果显示,与对照组相比,给予NMDA(200 mmol/L)处理24 h 后,低倍镜下可见皮层有明显损伤灶,高倍镜下可见核固缩,胞质浓缩,细胞体积减小,细胞排列紊乱,见图2。
2.2 NMDA 激活MAPK/ERK1/2 信号通路 与NMDA 致皮层兴奋毒性损伤的结果相似,大鼠p-ERK1/2 的表达水平也随NMDA 处理浓度和处理时间的延长而升高,呈现浓度和时间依赖性,但总ERK1/2 表达未见明显变化,见图3。同时进行p-ERK1/2 与神经元标记物NeuN 免疫荧光双染色显示,与对照组相比,200 mmol/L NMDA 组p-ERK1/2荧光信号明显增加,且大部分可与NeuN 信号叠加,提示p-ERK1/2主要表达于神经元细胞中,见图4。
2.3 U0126保护大脑皮层兴奋毒性损伤 与NMDA组相比,U0126单独处理时COX-2、iNOS、Caspase-3(活化形式)及p-ERK1/2 表达均明显降低(P<0.05);同时0.5、1、2 g/L 的U0126 与NMDA(200 mmol/L)联合处理的结果显示,随着U0126浓度的增加,COX-2、iNOS、Caspase-3(活化形式)及p-ERK1/2表达均明显降低(P<0.05),总ERK1/2表达未见明显变化(P>0.05),见图5、6。HE染色可见U0126单独处理组与NMDA 组相比,相同解剖层面的损伤面积明显减小,见图7。
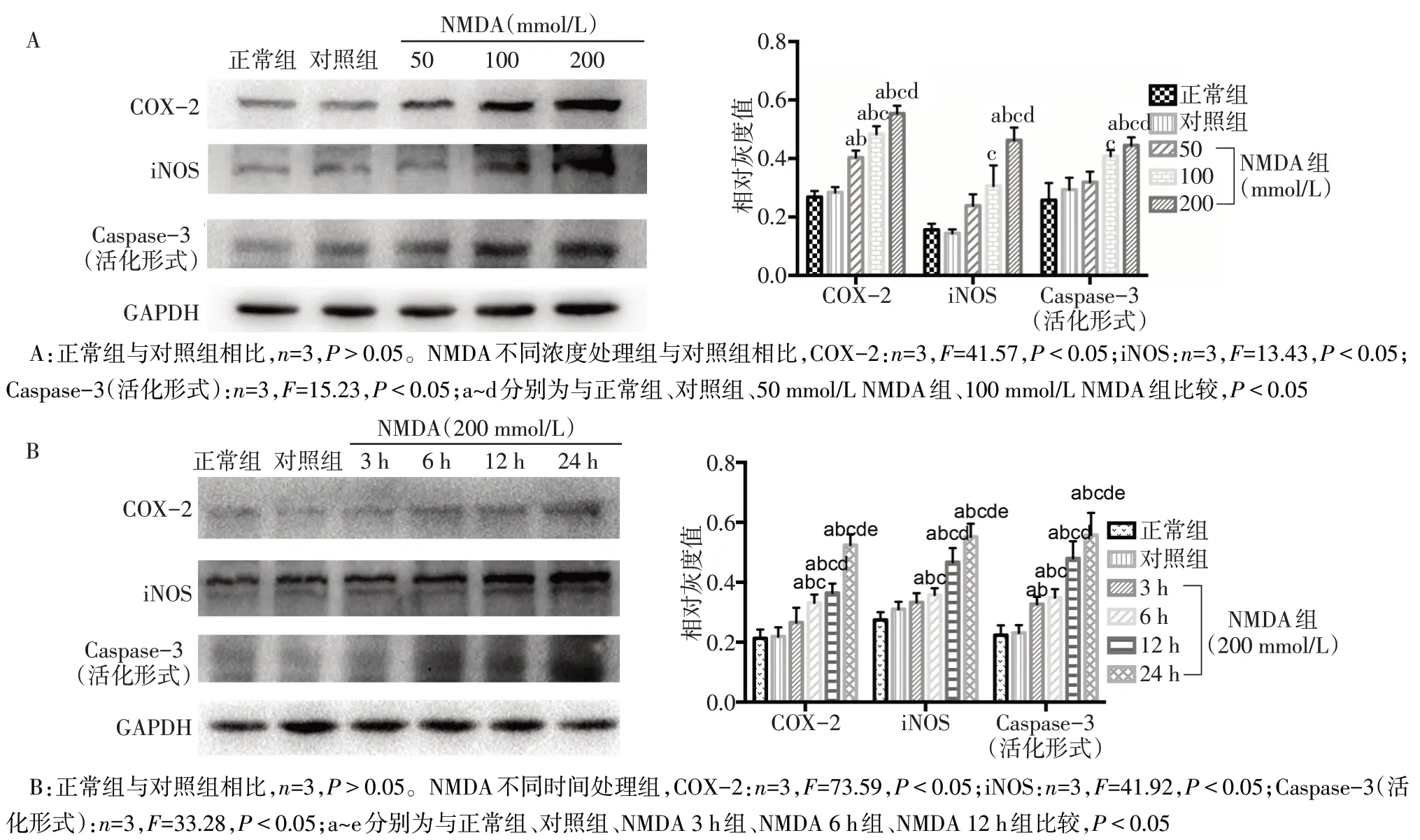
Fig.1 Effects of NMDA with different time points and different concentrations on the expressions of COX-2,iNOS and Caspase-3(active form)proteins图1 NMDA不同时间及不同浓度处理对COX-2、iNOS、Caspase-3(活化形式)蛋白表达的影响
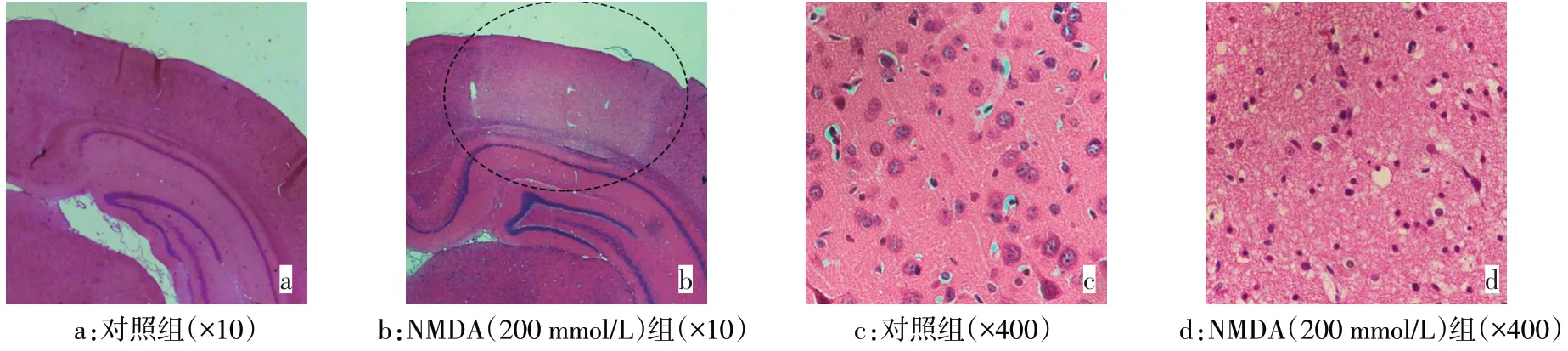
Fig.2 Cortical damage induced by NMDA treatment in rats(HE staining)图2 NMDA处理引起大鼠皮层损伤(HE染色)
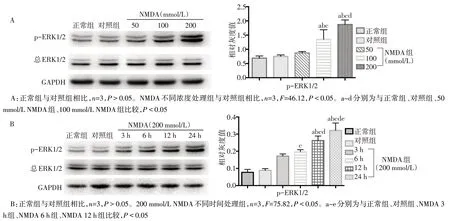
Fig.3 Effects of NMDA with different time points and different concentrations on the expression of p-ERK1/2图3 NMDA不同时间及不同浓度处理对p-ERK1/2表达的影响
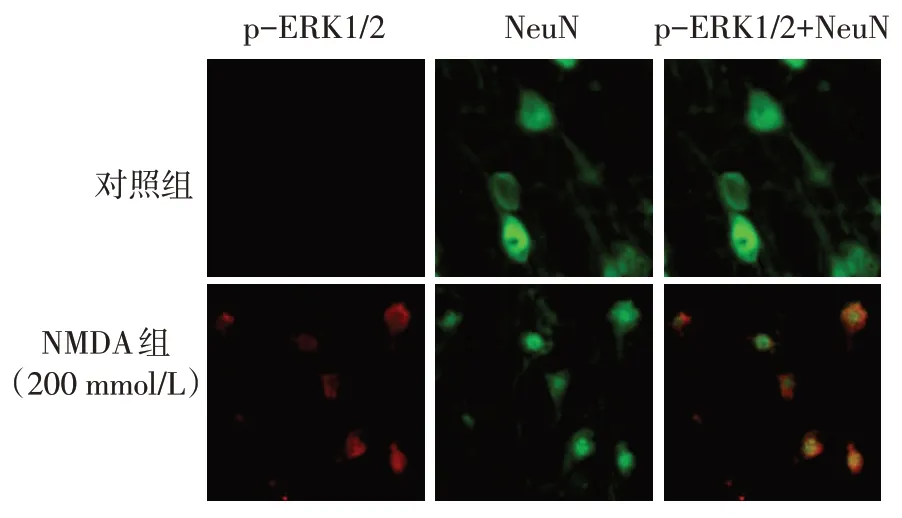
Fig.4 The effect of NMDA on p-ERK1/2 expression(Immunofluorescence staining,×400)图4 NMDA对p-ERK1/2表达的影响(免疫荧光染色,×400)
3 讨论
谷氨酸受体是中枢神经系统最主要的兴奋性神经递质受体,已知约1/3 的中枢神经系统神经元的信息传递需要谷氨酸及其受体的参与,这些神经元主要分布在大脑皮质和海马。根据其作用方式、功能不同可被分为两大类——代谢型受体和离子通道型受体。代谢型谷氨酸受体属于G 蛋白偶联受体,可参与调控细胞神经兴奋、突触的形成以及神经变性的信号转导过程。离子型受体是配体介导的通道型受体,包括NMDA受体、α-氨基-3-羟基-5-甲基-4-异恶唑丙酸(AMPA)受体和红藻氨酸(KA)受体,它们可与钠、钾、钙等离子通道偶联,形成受体离子通道复合物,从而介导细胞间快信号的传导。已有文献证明谷氨酸的神经毒性主要通过NMDA受体介导[15-17],有很少部分通过AMPA 及KA 受体,其原理为大量钙离子内流造成钙超载,触发下游通路,导致活性氧的产生和线粒体功能障碍,继而造成神经元损伤[18-19]。因此,笔者选用NMDA 大脑皮层微量注射来制作谷氨酸神经毒性损伤模型。

Fig.5 The inhibitory effect of U0126 treatment on NMDA-induced expressions of COX-2,Caspase-3(activated form)and iNOS图5 U0126处理对NMDA诱导的COX-2、Caspase-3(活化形式)、iNOS表达的抑制作用

Fig.6 The inhibitory effect of U0126 treatment on NMDA-induced the expression of p-ERK1/2图6 U0126处理对NMDA诱导的p-ERK1/2表达的抑制作用

Fig.7 The protective effect of U0126 on NMDA damage(HE staining,×10)图7 U0126处理对NMDA损伤的保护作用(HE染色,×10)
MAPK/ERK1/2 是存在于细胞内的丝氨酸和苏氨酸蛋白激酶,其可使蛋白质磷酸化修饰,是多种信号的交汇点。其上游激酶MEK1/2通过引起MAPK/ERK1/2磷酸化而对其具有激活作用。MAPK/ERK1/2激活后,p-ERK1/2可转位入核,对一些核转录因子的反应基因进行表达调控。U0126通过特异性抑制MEK1/2,从而在体内和体外抑制ERK1/2 的激活[20-21]。本研究中,NMDA 处理3 h 即可引起p-ERK1/2 表达增加,该作用一直持续至24 h,由此提示,NMDA处理可引起大脑皮层ERK1/2大量激活。
已有文献证明ERK1/2 激活参与了谷氨酸兴奋毒性损伤的多种信号途径。例如,ERK1/2激活可介导炎性因子IL-1、IL-6、TNF-α的表达[22];ERK1/2激活可引起NADPH 氧化酶关键催化亚基gp91phox 的表达增加[23];另外,ERK1/2 激活还可介导与细胞凋亡有关的NF-κB 的表达增加[24]。笔者也观察到NMDA 在引起脑组织损伤的同时,浓度依赖性地诱导炎性、凋亡相关因子COX-2、iNOS 及活化的Caspase-3 表达。同时,给予ERK1/2 抑制剂U0126后,随着U0126 浓度的增加,NMDA 引起的ERK1/2活化被显著抑制,且大脑皮层损伤面积减小,COX-2、iNOS 及活化的Caspase-3 表达明显降低。由此,笔者推测U0126通过阻断MAPK/ERK1/2途径,抑制细胞的炎性反应及凋亡,减少大脑皮层兴奋毒性损伤。另外,与单纯抗炎、抗氧化或抑制细胞凋亡相比,由于ERK1/2激活参与介导了NMDA引起的多种损伤途径,ERK1/2抑制剂对这些途径能够同时具有抑制作用,因此可能具有更好的保护效果。
尽管ERK1/2的早期激活介导了一系列炎症、凋亡反应,但同时它的激活也参与了晚期组织细胞的修复再生。有文献证实ERK1/2通过促进上皮细胞、成纤维细胞的增殖参与了损伤后上皮细胞的修复和损伤后纤维化,同时ERK1/2参与了Egr-1基因对生长因子表达的调控,从而参与新生血管的形成[25-27]。因此,推测ERK1/2抑制剂(U0126等)需要在谷氨酸兴奋毒性损伤早期给予,这样既可抑制ERK1/2的激活及其介导的损伤反应,也可避免干扰晚期ERK1/2激活介导的脑组织自我修复及再生。U0126 及PD98059 等为第一代ERK1/2 抑制剂,新型ERK1/2抑制剂,如SCH772984 和已经应用于临床的维罗非尼(Vemurafenib)等目前只是应用于部分肿瘤患者的治疗及研究[28-29],期待更多开展新型ERK1/2抑制剂对谷氨酸兴奋毒性损伤的相关研究。
综上所述,ERK1/2抑制剂U0126对于谷氨酸引起的神经毒性损伤具有明显的保护作用,其机制可能与抑制ERK1/2激活及其下游的炎症、凋亡信号途径有关。
