表面增强拉曼光谱法分析软饮料中的阿斯巴甜
2019-04-08周光明罗庆红郝光辉
罗 丹,周光明*,陈 蓉,罗庆红,郝光辉
(1.发光与实时分析教育部重点实验室 西南大学 化学化工学院,重庆 400715;2.隆昌市环境监测站,四川 隆昌 642100 )
阿斯巴甜(APM)是一种人工甜味剂,因其热量低、体内不代谢且制造成本低、甜度高等优点,被作为甜味剂广泛使用于糖果、软饮料、果脯及糕点等食品。近年来,软饮料,尤以苏打水、可乐、雪碧、芬达等为代表受到了广大消费者的喜爱[1],但甜味剂的过量摄入可能会造成人体肝脏及神经系统破坏,以及导致肥胖、2型糖尿病(T2D)、代谢症候群、高血压以及心血管疾病[2]。研究还表明:APM在老鼠体内会分解为天冬氨酸、苯丙氨酸及甲醇,是一种潜在的致癌剂[3]。世界卫生组织食品添加剂专家联合委员会确定,APM的可接受摄入量为50 mg/kg体重,软饮料含APM的最高允许水平为600 mg/L[4-5],因此很有必要建立对APM的检测方法。
目前,关于APM的检测方法有高效液相色谱法[6-7]、流动注射法[8]、循环伏安法[9]。尽管此类方法具有较高的灵敏度和准确度,但存在很大的缺陷,如需要对样品进行繁琐的预处理,成本高,流动相需使用大量有机溶剂,检测时间长且对仪器的耗损较大。荧光法[10]、分子印迹法[11]及毛细管电泳法[12]也被用于APM的检测,但这些方法也存在缺点,如需长达几个月的时间寻找适合的荧光探针或抗体,且荧光探针、抗体和酶联剂易受到实验室温度、湿度及pH值的影响。因此建立一种无损、快速、环境污染小的适合大批量样品的现场分析方法,并适用于糖类食品等复杂基体中甜味剂的定量检测极其重要。
表面增强拉曼光谱(SERS)是一种基于单色入射光对光子和分子进行非弹性散射的具有强大吸引力的无损实时振动光谱技术,通常采用金、银等贵金属来增强拉曼散射。该方法因检测周期短、无损、基体干扰小、污染少等特点,在食品、药品、环境、卫生等领域受到热切关注。本文利用超声技术辅助预处理,使用纳米银为活性基底,优化纳米银与APM溶液的pH值、混合体积比、混合温度及加热时间等实验条件,建立了对软饮料中APM进行无损分析的SERS方法。
1 实验方法
1.1 试剂与仪器
阿斯巴甜(APM,98%,阿拉丁试剂公司(上海));硝酸银、乙二醇、聚乙烯吡咯烷酮(PVP)、三氯化铁、氯化钠、氢氧化钠、盐酸(分析纯,四川科龙试剂有限公司);甲醇(色谱纯,四川科龙试剂有限公司);苏打水、可乐、雪碧、芬达均从重庆当地一家超市购买;实验用水均为去离子水。
激光显微拉曼光谱仪:英国Renishaw公司,激发波长为633 nm,激光强度为10 mW,积分时间为30 s,检测波长范围:0~3 000 cm-1。高效液相色谱仪:岛津LC-20A,色谱柱:Phenomenex C18,柱温:35 ℃,流速:0.500 m L/min,流动相:甲醇-水。
1.2 纳米银的制备
按照文献方法并稍加改进后制备纳米银[13]:将PVP 溶于乙二醇中,配制0.56 mol/L PVP 溶液。取50 mL 0.56 mol/L PVP 溶液至100 mL烧杯,加入磁力搅拌器搅拌同时油浴加热至150 ℃,保持温度恒定,加入110 μL 0.15 mmol/L FeCl3溶液,5 min后,加入100 μL 0.15 mol/L NaCl 溶液,5 min后再加入10 mL 0.15 mol/L AgNO3。为了从纳米银中分离出过量的PVP,将制取液用乙醇稀释,并以4 000 r/min离心,将上清液分散在乙醇中置于冰箱中保存备用。
1.3 溶液的配制及测定
将苏打水、可乐、雪碧、芬达置于烧杯中超声洗脱1 h后排尽CO2。准确称取APM粉末溶于水、苏打水、雪碧、可乐、芬达中,配制1 000 mg/L标准储备液及基质加标液,并逐级稀释至100、80、50、20、10、0.5 mg/L,常温下保存,备用。 取上述配制溶液与纳米银按照1 ∶ 1混合 20 min后,滴在玻片上待测,并根据拉曼峰强度和标准浓度绘制标准曲线。
2 结果与讨论
2.1 纳米银的表征
由于纳米粒子的尺寸、表面粗糙程度等因素会影响其光学性质,因此采用紫外光谱(UV/Vis)和透射电子显微镜(TEM)对钠米银进行表征。结果显示,纳米银的紫外吸收峰在589 nm左右(图1A),表明其对应直径约为100 nm。TEM图(图1B)则显示制备的纳米银为较均匀的球形颗粒,且比表面积大,有助于使APM分子吸附更均匀,拉曼信号更稳定。

图 1 纳米银的紫外吸收光谱(A)及透射电子显微镜图(B)Fig.1 Ultraviolet absorption spectrum(A)and TEM image(B) of silver nanoparticles
2.2 APM的拉曼光谱和待测样品的SERS谱图分析


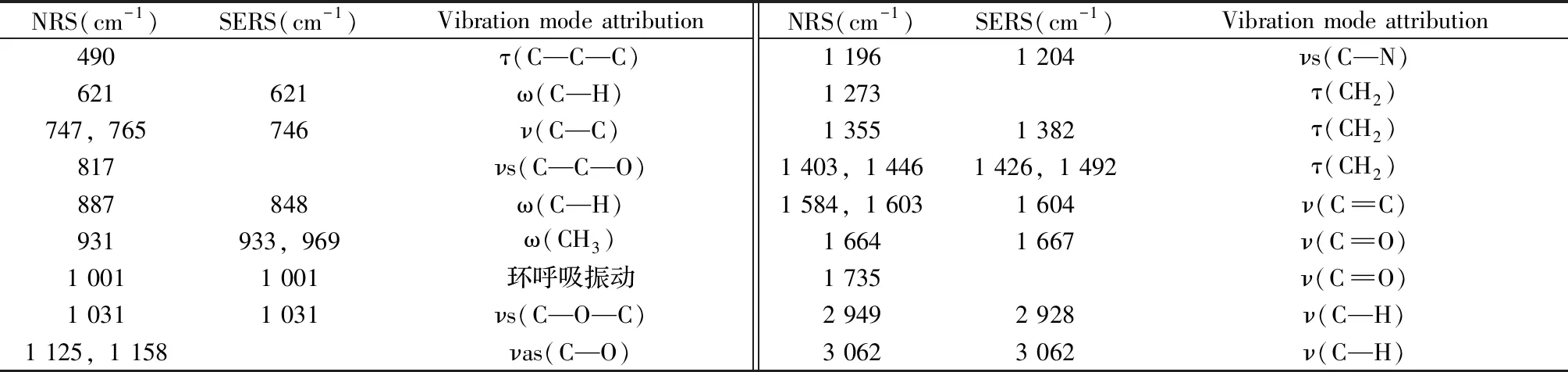
NRS(cm-1)SERS(cm-1)Vibration mode attributionNRS(cm-1)SERS(cm-1)Vibration mode attribution490τ(C—C—C)1 1961 204νs(C—N)621621ω(C—H)1 273τ(CH2)747,765746ν(C—C)1 3551 382τ(CH2)817νs(C—C—O)1 403,1 4461 426,1 492τ(CH2)887848ω(C—H)1 584,1 6031 604ν(C‖C)931933,969ω(CH3)1 6641 667ν(C‖O)1 0011 001环呼吸振动1 735ν(C‖O)1 0311 031νs(C—O—C)2 9492 928ν(C—H)1 125,1 158νas(C—O)3 0623 062ν(C—H)
2.3 实验条件的优化
为获取最佳检测条件,采用单因素对混合溶液pH值、混合比例、混合温度及加热时间等因素对特征峰的影响进行考察。
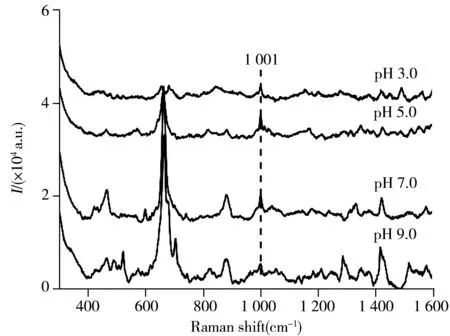
图3 APM在不同pH值下的SERS谱图Fig.3 SERS spectra of APM at different pH values
2.3.1pH值的选择酸碱度差异对APM电离程度、特征峰强度及吸附位置均有影响。因此,考察了100 mg/L APM标准溶液在不同pH值的SERS增强效果。由图3可知,pH值大于7.0时,拉曼峰特征清晰,但1 001 cm-1处的强度比弱酸性和中性时更小。此外,由于APM水解后pH值为5.0且在pH 3.0 ~ 5.0时较稳定,因此实验选择最佳pH值为5.0。
2.3.2纳米银与APM体积比的优化总体积不变条件下,分别考察了纳米银与APM的最佳体积比为1 ∶ 4、1 ∶ 3、1 ∶ 2、1 ∶ 1、2 ∶ 1、3 ∶ 1时的SERS光谱。结果显示,随着混合体积比从1 ∶ 4升至1 ∶ 1再升至3 ∶ 1,APM的拉曼特征峰强度光逐渐增大之后又减小,因此实验选择纳米银与APM的最佳体积比为1 ∶ 1。这可能是由于早期APM的量过大时,导致纳米银被过于包裹从而使得电子跃迁概率下降,但纳米银的量过多时,易导致纳米银团聚而使得SERS信号减弱。
2.3.3混合温度与加热时间的优化实验温度会影响APM粒子对纳米银的吸附,因此考察了100 mg/L APM溶液在不同温度下的SERS响应。实验发现:随着温度的不断上升,1 001 cm-1处的特征峰强度变化趋势较小,为保持体系的稳定性,实验选择30 ℃为最佳混合温度。为选择理想的加热时间,考察了加热时间对特征峰强度的动力学曲线。将 100 mg/L标准溶液置于30 ℃油浴锅中,连续采集一系列加热时间的SERS光谱。结果表明,当加热时间由2 min增至6 min,SERS的特征峰强度不断上升,但当超过6 min后,特征峰强度反而下降,这可能是因为时间过长导致纳米银产生团聚,使SERS信号产生衰减所致。因此实验选择最佳加热时间为6 min。
2.4 APM的定量分析
以水以及苏打水、雪碧、可乐、芬达为溶剂配制一系列浓度(0.5、10、20、50、80、100 mg/L)的标准溶液及基质加标溶液,并进行SERS扫描,运用线性回归法,绘制以溶液浓度(x,mg·L-1)对应1 001 cm-1处信号强度(y)的标准曲线,部分谱图见图4,线性结果如表2所示。APM在0.5~100 mg·L-1的质量浓度范围内线性关系良好,其中在苏打水、雪碧、可乐和芬达中的相关系数(r2)为0.974 7~0.984 8,纯品中的r2为0.993 3。对0.5 mg/L APM标准溶液平行测定12次,以3倍标准偏差计算得到检出限为0.41 mg/L。与笔者按GB5009.263-2016法采用HPLC进行测定的结果(y=37 361x+712 422,r2=0.999 1)相比,本方法在灵敏度上存在一定的差距,其原因可能是待测样品中所含色素或其他添加剂干扰所致。此外,若使用的活性基底不均匀,也会降低实际样品的灵敏度。但由于HPLC前处理繁杂,需使用大量有机溶剂,同时洗脱时间较长,对仪器损耗较大,因此SERS在节约成本、无损、快速等方面存在巨大潜力。


MatriceLinear range(mg/L)Linear equationr2Water0.5~100 y=1 131x+973.60.993 3Soda0.5~100 y=30.44x+104.30.984 6Sprite0.5~100 y=20.99x+79.530.984 4Cola0.5~100 y=21.02x+109.80.974 7Fanta0.5~100y=42.70x+93.860.984 8
2.5 软饮料中APM的检测
将购买的软饮料(苏打水、可乐、雪碧、芬达)按照本方法进行预处理后,向其分别添加10.0、20.0、50.0 mg/L 浓度水平的APM标准溶液,采用HPLC法及本方法进行测定,并计算其平均加标回收率和相对标准偏差(RSD)。表3结果显示,利用SERS法测得4种饮料中APM的平均回收率为88.4%~ 121%,RSD为2.6%~6.4%;HPLC法测得回收率为99.5%~108%,RSD为2.1%~4.6%。尽管SERS法的回收率和RSD与HPLC法相比存在一定差距,但该方法预处理1个样品需1 h,检测约1 min,而HPLC法预处理1个样品需2 h,检测需15 min,这充分体现了SERS法的快速优势。此外,实际样中可乐的回收率最低,可能是由于可乐颜色较深,其中色素等杂质干扰了SERS测试。目前已有报道利用SERS技术对奶粉中的非法添加剂[16],及食品中的着色剂进行检测[17-18],但分析更为复杂的实际样品(如肉类、服饰)中的违禁成分时,其灵敏度和检出限还需进一步提高。因此,进一步优化SERS检测的前处理方法,缩短前处理时间,以获得均匀的基底和均一的吸附角度将是SERS的研究重点。

表3 样品分析及加标回收结果Table 3 Analytical results and recoveries of sample
3 结 论
本文借助超声辅助技术对软饮料进行预处理,通过优化纳米银与APM溶液的pH值、混合体积比、混合温度及加热时间等SERS条件。在优化条件下,运用SERS技术结合化学计量方法对水及软饮料中APM进行定量检测。测得水中r2为0.993 3,检出限为0.41 mg/L,软饮料中r2为0.974 7 ~ 0.984 8,回收率为 88.4 %~ 121%。相比于HPLC法,SERS技术检测软饮料中APM浓度时在灵敏度和回收率方面还存在不足,但可避免使用大量有机溶剂,减少了环境污染,同时检测速度快、无损,适用于简单成分大批量样品的现场实时分析。该方法的建立为SERS技术在食品中化学添加剂的检测及开发奠定了基础。
