基于PC12细胞电化学传感器检测苯并(a)芘的研究
2019-04-01,,,,,,*
,, , ,,,*
(1.扬州大学,食品科学与工程学院,江苏扬州 225127;2.南京财经大学,食品科学与工程学院,江苏南京 210023)
多环芳烃(PAHs)是一类具有稠合芳香环的化合物,为重要的大气污染物[1]。大量研究表明,肺癌、哮喘、支气管炎和心脏病发病率的增加都与PAHs的暴露有关[2-3]。苯并(a)芘(Benzo(a)pyrene,BaP)为具有五个结构环的PAH化合物,已经被证明为一种致癌物质,表现出很强的致癌活性[4-6]。BaP经细胞色素P450(CYP)代谢活化生成的BaP-7,8-dio-9,10-环氧化物(BPDE)与DNA形成加合物,引起G→T颠换突变为主的基因突变,从而诱发癌症[7-8]。由于BaP对人体健康的威胁,对BaP进行真实有效地检测具有重要意义[9]。
细胞电化学传感技术利用活细胞作为识别元件,将生物信号转化为容易识别和记录的电信号,能够从细胞水平上,对潜在有害物及其毒性进行准确、快速、高效的安全性评价[10-11]。细胞电化学传感技术还能从分子水平更好地识别多环芳烃类有害产物,实现对苯并(a)芘真实有效的测定。此外,活细胞构建的生物传感器,能根据细胞在形态和生理上的特殊变化,提供比光谱和色谱方法更多的综合信息。电化学阻抗谱(EIS)测量具有操作简便、响应时间短和灵敏度高等优点,近几年引起了研究人员的关注[12-14]。虽然已有电化学传感器技术检测苯并(a)芘的相关研究,但是利用活细胞作为识别原件,以细胞电化学传感器技术检测苯并(a)芘的研究仍处于空白阶段。
本文利用亲生物性的海藻酸钠凝胶和聚电解质膜(PEM)包裹活细胞作为识别BaP的特殊原件。采用10 μL不同浓度的BaP刺激细胞,通过不同浓度的BaP造成细胞不同程度的损伤,导致电化学信号发生变化。以电化学阻抗谱(EIS),差分脉冲伏安法(DPV)和循环伏安法(CV)检测电化学信号的变化,以期建立一种基于PC-12细胞电化学传感器分析检测BaP的新方法。
1 材料与方法
1.1 材料与仪器
大鼠肾上腺嗜铬细胞瘤(PC-12)细胞 中科院上海细胞库;苯并(a)芘 上海阿拉丁生化技术有限公司;RPMI 1640培养基和胎牛血清 美国Gibco公司;壳聚糖、海藻酸钠 美国Sigma-Aldrich公司;Annexin V-FITC细胞流式凋亡试剂盒:Binding Buffer、Annexin V-FITC、PI Staining Solution 森贝伽生物科技有限公司;胰酶消化液、PBS(pH7.4) 碧云天生物技术有限公司。
Tecnai 12透射电镜 荷兰Philips公司;FACSAria IIU流式细胞仪、LIFE Countess全自动细胞计数仪 美国BD公司;S-4800场发射扫描电镜 日本日立公司;二氧化碳恒温培养箱 美国Thermo Fisher公司;CHI660e电化学工作站 上海辰华仪器有限公司。
1.2 实验方法
1.2.1 海藻酸钠凝胶、聚电解质薄膜的制备 将海藻酸钠溶解在RPMI 1640培养基中获得1%(w/v)海藻酸钠(SA)凝胶后,取0.25 g壳聚糖(CS)溶解于0.5%(v/v)的乙酸,超声处理4 h获得壳聚糖溶液。将10 μL海藻酸钠滴在壳聚糖溶液中反应5 min以制备聚电解质薄膜[15-16]。反应完成后,用超纯水清洗后备用。
1.2.2 细胞的常规培养和计数 用PBS(pH7.4)清洗含有细胞的培养瓶,缓慢加入3 mL的胰酶消化液,37 ℃下静置3 min,加入适量完全培养液终止消化过程。用1 mL移液枪均匀吹打内壁上的细胞后,转移到灭菌的离心管中,1000 r/min离心5 min,离心结束后弃去上清液,向下层沉淀中加入1 mL完全培养液,用枪轻轻吹打均匀。取1 mL处于对数生长期的细胞用PBS洗涤后重悬,每次计数前用枪吸取200 μL细胞悬液于玻片中,将玻片置于LIFE Countess全自动细胞计数仪中,运行Countess II软件可自动获得细胞浓度。
1.2.3 细胞传感器的构建 取10 μL细胞与制备好的1%(w/v)海藻酸钠溶液混合均匀,将制备好的海藻酸钠细胞凝胶按照1.2.1的方法制备聚电解质薄膜。之后,将制备好的细胞凝胶和聚电解质薄膜覆盖于裸金电极(GE)表面,浸入含有100 mmol/L CaCl2的1640培养基中,并在37 ℃具有5% CO2的培养箱中放置5 min以实现细胞固定。将固定后的细胞凝胶与电极形成的角手架连接至工作线路插口,将铂丝电极连接至对电极线路插口,并将饱和甘汞电极连接至参比电极的插口。最后打开电化学工作站的开关即可。
1.2.4 BaP对PC-12细胞损伤作用的研究
1.2.4.1 扫描电镜 用50 μmol/L BaP刺激PC-12神经细胞,将刺激后的细胞与制备好的凝胶混合,形成混合均匀的细胞凝胶。吸取1 mL的细胞凝胶到2.5%的戊二醛中,在4 ℃冰箱中固定4 h以上。用50%乙醇、70%乙醇、80%乙醇、90%乙醇、95%乙醇、100%乙醇对细胞凝胶依次梯度脱水。最后,使用含有无水硫酸钠的乙醇再次进行脱水。轻轻撕开脱水后的凝胶,将撕开后的样品放入CO2干燥器临界点35 ℃下干燥1 h。干燥后的样品进行喷金镀膜即可使用扫描电镜观察。
1.2.4.2 透射电镜 用50 μmol/L BaP刺激PC-12神经细胞,然后1000 r/min离心5 min,琼脂包裹。用戊二醛(2.5%)在4 ℃冰箱中固定4 h后,用PBS(pH=7.4)清洗3~4次,接着加入1%锇酸固定。继续使用PBS清洗3次,依次加入不同浓度的乙醇脱水,在加入100%丙酮、含有无水硫酸钠的100%丙酮梯度脱水,以上每个脱水步骤最少15 min。用丙酮∶树脂=1∶1的混合液渗透1 h后,再用丙酮∶树脂=1∶2的混合液渗透2 h,接着用树脂渗透2 h并进行包埋和聚合。对处理好的样品进行切片,用醋酸双氧铀和枸橼酸铅分别对超薄切片进行染色。将染色后的切片放在金网中,用Tecnai 12透射电镜对细胞的内部结构进行观察。
1.2.4.3 流式细胞检测 50 μmol/L BaP刺激细胞后,用预冷的PBS重悬洗涤细胞2~3次,1000 r/min离心5 min,弃去上清液。加入100 μL 1×Binding Buffer重悬细胞,随后分别加入5 μL Annexin V-FITC和10 μL PI Staining Solution,用移液枪轻轻吹打混匀后,室温避光下反应15 min。再加入400 μL 1×Binding Buffer,冰浴30 min后使用流式细胞仪进行检测。数据由NovoExpress软件捕获以供分析。
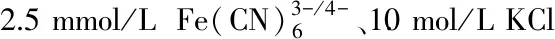
1.3 数据处理

2 结果与分析
2.1 细胞传感器的构建
使用电化学阻抗谱(EIS),差分脉冲伏安法(DPV)和循环伏安法(CV)来测试细胞传感器的特征。三种方法检测出现的信号和图谱都非常稳定,说明本传感器已构建成功。图1(A)循环伏安图中可逆氧化还原峰在裸露电极表面清晰可见(曲线“a”)。海藻酸钠水凝胶用于表征,电流显著下降(曲线“b”)。PEM良好的电导率导致电解质之间电子转移的加速,其氧化还原峰电流增加(曲线“c”)。最后,当电极被PC-12神经细胞表征时,工作电极的电子转移速率被阻断,氧化还原电流迅速下降(曲线“d”)。图1(B)中的DPV曲线显示了相同的趋势。使用CHI660e电化学工作站依次将图1(C)EIS图谱中的数据导入,经过如图1(C)右下方所示的拟合电路电化学工作站可自动拟合得到等效阻抗Ret。裸电极时,阻抗约为256 Ω(曲线“a”)。当使用海藻酸钠水凝胶时,Ret值增加到2071 Ω(曲线“b”),而当PEM被表征后,奈奎斯特图半径显著降低,其等效阻抗也对应降低,接近959.3 Ω(曲线“c”)。细胞被表征后,Ret值增加到4006 Ω(曲线“d”)。

图1 不同修饰状态下的循环伏安图(A)、差分脉冲伏安图(B)、奈奎斯特图(C)、不同细胞浓度修饰下阻抗图(D)Fig.1 Cyclic voltammograms(A),differential pulse voltammetry(B),Nyquist diagrams ofdifferent modified electrodes(C)and impedance curves(D)for different cell concentrations注:a.裸GE;b. SA/GE;c. CS/SA/GE;d. CS/SA/cells/GE。
细胞浓度影响传感器的灵敏度,选择合适的细胞浓度进行实验非常重要。如图1(D)所示,阻抗的增加值与细胞的浓度密切相关,这在一定范围内是线性的。该实验得出结论,细胞浓度从5×101~ 5×107个细胞/mL具有线性关系,相关系数为0.987。当细胞数量超过5×107个细胞/mL时,阻抗的大小变化不明显(未显示),说明即使细胞浓度增加,对传感器的影响也并不明显。分析认为,细胞数低于5×107个细胞/mL适合本实验。
2.2 BaP对PC-12细胞损伤作用的研究
正常的PC-12神经细胞放大10000倍的扫描电镜图如图2A所示,细胞的表面形态结构完好,外周神经突和细胞膜没有破损。然而,如图2B所示,经过BaP处理的PC-12神经细胞的细胞膜明显受到破坏,原有的神经突也受到不同程度的损伤。图2C为放大16000倍的正常组PC-12神经细胞的透射电镜图,细胞内部结构完整,细胞核完好。经BaP处理后的细胞如图2D所示,细胞核严重受损。以上结果证明了BaP对PC-12神经细胞有诱导损伤和坏死的作用,是进行电化学实验的基础。
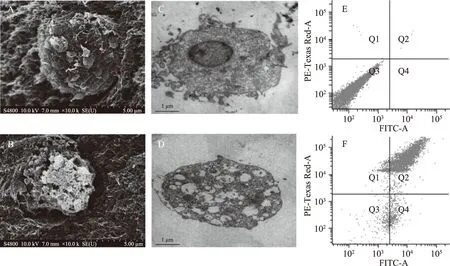
图2 BaP对PC-12神经细胞形态的影响与细胞流式检测情况Fig.2 Effects of BaP on the morphology of PC-12 nerve cells and cell flow assays注:A、C、E为正常PC-12细胞;B、D、F为BaP处理后的PC-12细胞。图中Q1区(FITC+/PI+)是坏死细胞;Q3区(FITC-/PI-)显示的是活细胞;Q2、Q4区(FITC+/PI-)显示的是凋亡细胞。
为了估计BaP的细胞毒性相互作用并构建电化学检测的方法,将BaP处理后的细胞用于流式测定。实验结果显示,正常细胞凋亡率为0.15%,坏死率0.09%,而经过BaP处理后的细胞凋亡率高达80.80%,坏死率达4.91%。表明BaP能够诱导PC-12细胞的凋亡。
2.3 细胞传感器测定BaP的标准曲线
如图3B所示,BaP一定浓度下以剂量依赖性方式诱导细胞损伤。用浓度为1~5 μmol/L的BaP处理后,EIS阻抗急剧下降,表明阻抗变化与BaP浓度相关。随着BaP浓度增加至10 μmol/L,准线性行为消失。随着BaP浓度的进一步增加,电化学信号变化不明显。可能是由于较高的BaP浓度诱导细胞溶解,耗尽细胞并导致Ret值的稳定。最终形成了一个准线性关系(y=-418.660x+4234.706,r=0.994)。根据公式LOD=3s/m,其中s表示空白样品的标准偏差(n=3),m表示BaP的相对校准曲线的斜率,BaP的检测限为0.21 μmol/L。

图3 不同浓度的BaP下的奈奎斯特图(A)与对应的阻抗图(B)Fig.3 Nyquist diagrams(A)and electrochemical impedance(B)for different concentrations of BaP注:a~j分别为0、1、2、3、4、5、10、15、20、50 μmol/L。
2.4 细胞传感器的稳定性和重现性
在不同的时间点检测DPV电流峰值。如图4,在36 h内,没有BaP刺激细胞传感器的峰值几乎保持稳定,这表明该方法具有良好的稳定性。电流峰值的增加可能是由于48 h后PBS中的营养不足造成的。此外,表1可知,平均回收率为97.88%~99.02%,方差系数为1.46%~2.31%。这些值符合实验分析所需的准确度,表明制造方案易于重现,具有良好的检测性能。

表1 检测的加标样品的回收率和再现性(CV)Table 1 Recoveries and reproducibility(coefficients of variation)of the spiked samples
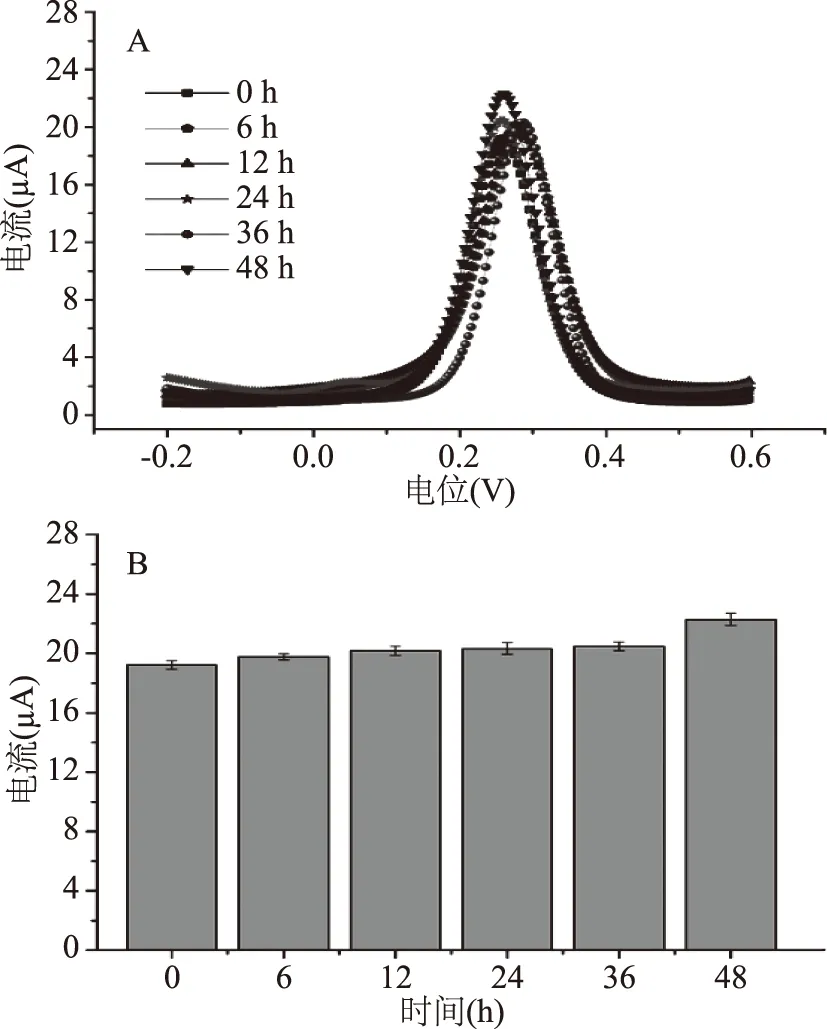
图4 不同时间时细胞传感器的差分脉冲伏安图(A)和对应的电流峰值(B)Fig.4 Differential pulse voltammetry(A)and peak currents(B)of the cell sensor at different time
3 结论
本研究开发了一种简单、廉价的基于PC-12神经细胞的电化学生物传感器,其将活细胞固定在电极上以监测电子转移的变化。海藻酸钠凝胶为细胞提供了稳定的环境,聚电解质薄膜增强了导电性。结果表明,随着BaP浓度的增加,在一定浓度范围内,Ret值不断下降。具体而言,电化学阻抗的值在1~5 μmol/L的浓度范围内不断下降,线性方程为:y=-418.660x+4234.706,r=0.994,检测限为0.21 μmol/L。平均回收率为97.88%~99.02%,检测结果的RSD低于5%,表明该传感器具有良好的重现性和稳定性。本研究为BaP的研究提供了一种新的思路。
