PPAR-gamma信号通路对Hem-MSCs体外成脂分化的影响
2019-04-01徐媛郭遥袁斯明王慜陈海妮沈卫民
徐媛 郭遥 袁斯明 王慜 陈海妮 沈卫民
幼儿血管瘤(Infantile hemangioma,IH)是儿童最常见的良性肿瘤之一,多发于头面部[1],严重时对儿童的外观影响较大。该病具有一个独特的自然消退过程,瘤体通常会在出生后6个月内迅速增长,大部分会在1岁之后自行消退,这一过程始终伴随着脂肪形成的现象[2]。
Khan等[3]的研究揭示了血管瘤的起源细胞可能是一群特殊的间充质干细胞,即血管瘤来源间充质干细胞 (Hemangioma-derived mesenchymal stem cells,Hem-MSCs),我们的前期研究也已证实Hem-MSCs是瘤体消退过程中脂肪形成的细胞基础[4]。在血管瘤病理演变过程中必然伴随着脂肪分化相关基因表达的变化,其中PPAR-gamma基因是控制间充质干细胞向脂肪细胞分化的关键基因[5]。研究证实,PPAR-gamma的激动剂罗格列酮能促进BMSCs成脂分化过程[6]。因此,我们推测罗格列酮亦可能通过激活PPAR-gamma信号通路,从而影响Hem-MSCs的成脂分化过程。
本研究旨在探讨罗格列酮对Hem-MSCs成脂分化的影响,从而为罗格列酮应用于IH患儿,以加速其血管瘤消褪进程提供理论依据。
1 材料与方法
1.1 材料
1.1.1 组织标本
瘤体标本取自南京市儿童医院烧伤整形科,系临床手术切除的增生期新鲜婴幼儿血管瘤标本,共9例,均经患儿父母授权同意。
1.1.2 主要试剂与仪器
DMEM、青链霉素溶液(Hyclone,美国),FBS、胰蛋白酶(Gibco,美国),罗格列酮原粉(天津武田),GW9662(Merck,美国),胰岛素、地塞米松、异丁基-甲基黄嘌呤(Sigma,美国),吲哚美辛(华中药业),PCR引物(吉凯基因),Matrigel基质胶(BD,美国),Perilipin A抗体(Abcam,美国),油红干粉(Amresco,美国),MaxVisionTM即用型免疫组化检测试剂盒(迈新生物)。
倒置相差显微镜(重庆奥特),显微摄像头(Jenoptik,德国),流式细胞仪(BD-FA6Calibur,美国)。
1.2 实验方法
1.2.1 细胞培养
参考文献[7]的方法,采用贴壁培养法分离培养Hem-MSCs。去除标本上多余的皮肤和脂肪组织,完整剥离出瘤体,将肿瘤组织剪碎成约1 mm3的小块,均匀分散地贴于6 cm培养皿中,加入L-DMED/10%FBS培养基,37℃、5%CO2下培养4 d,随后隔天更换培养基,直至组织块周围爬出间充质干细胞;去除组织碎片及悬浮细胞,将贴壁细胞继续培养扩增,传代至第3代后为纯化的细胞系。细胞定期传代扩增,冻存于液氮中备用。
1.2.2 实验分组
按不同条件培养基分5组,包括:A组(普通培养基,即L-DMED/10%FBS)、B组(1μM罗格列酮+普通培养基)、C组(成脂诱导培养基,10μg/mL胰岛素+1μM地塞米松+0.5 mM异丁基甲基黄嘌呤+60μM吲哚美辛)、D组(1μM罗格列酮+成脂诱导培养基)、E组(2μM GW9662+1μM罗格列酮+成脂诱导培养基)。
1.2.3 油红O染色
将2.5 mL细胞悬液接种于六孔板中,共接种两板,每板接种5孔,细胞贴壁并进入指数生长期后按实验分组更换培养基,随后隔天换液,两板细胞分别培养至第7天和第14天。先在倒置相差显微镜下观察细胞分化情况;再用4%多聚甲醛固定后,行油红O染色,倒置相差显微镜下观察脂滴形成情况。
1.2.4 Western-blot检测
将Hem-MSCs接种于5个10 cm培养皿,进入指数生长期后按实验分组更换培养基,随后隔天换液,培养直至细胞密度达到80%。定期观察,培养2周后,收获细胞进行检测。将细胞收集到EP管中,加入裂解液,在冰上裂解15 min后超声破碎细胞,离心取上清后调整蛋白浓度至2μg/μL,将样本点入加样孔后开始电泳(浓缩胶80 mA,20 min;分离胶120 mA,1 h),电泳结束后,在4℃、300 mA恒流条件下转膜150 min,将蛋白转移到PVDF膜上,封闭液(含5%脱脂牛奶的TBST溶液)室温封闭1 h,一抗孵育2 h,TBST洗膜4次,每次8 min,后二抗孵育1.5 h,TBST洗膜4次,每次8 min,加入显色液,避光显色至出现条带,加入定影剂定影10 min至胶片透明,清洗并室温晾干后进行分析。
1.2.5 实时定量PCR
将细胞接种于6孔板(每板接种5组,共接种3板,每组各3孔),细胞进入指数生长期后按实验分组更换培养基,随后隔天换液,培养7天时收集细胞。按照说明书操作,以Trizol法抽提RNA,使用分光光度计测定所抽提RNA的浓度以及质量,RNA经反转录获得cDNA,随后以两步法进行PCR反应,每12μL PCR反应体系包括SYBR premix ex taq 6.0μL、上游引物(5μM)0.5μL、下游引物(5μM)0.5μL、模板(反转录产物)1.0μL、RNase-Free H2O 4.0μL(表1)。反应条件:起始,95℃30 s ec;两步PCR,95℃5 sec,60℃30 sec,共40个循环;分离,95℃15 sec,60℃30 sec,95℃15 sec(图1)。相对定量分析F=2-ΔΔCt(ΔCt=目的基因Ct值-内参基因Ct值;-ΔΔCt=NC组ΔCt平均值-各样品ΔCt值;2-ΔΔCt反映各样品相对NC组,即A组第1周第1组,样品目的基因的相对表达水平)。
1.3 统计学分析
采用SPSS19.0软件对实验结果和数据进行统计分析。数据以表示,运用单因素方差分析和t检验行相关性分析,P<0.05为差异有统计学意义。

表1 引物序列Table 1 Primer sequence

图1 两步法RT-PCR熔解曲线Fig 1 Two-step RT-PCR melting curve
2 结果
2.1 油红O染色
培养至第7天和第14天时,A组和B组的细胞均未见明显脂肪分化。进行成脂诱导的另外3组在培养第7天时即可观察到脂滴形成,第14天时成脂分化的细胞数量明显多于第7天时;其中D组细胞成脂分化更加明显,可见大量成串的脂滴形成;E组的成脂分化程度明显低于D组,但接近C组。油红O染色发现,D组的染色面积明显大于C、E组(图2)。
2.2 Western-blot检测
A、B组的perilipin A蛋白的表达量极低,C组和E组的蛋白表达量稍高,D组的蛋白表达量明显高于其他4组(图3)。
2.3 实时定量PCR
分别于第1周和第2周时检测各组细胞脂肪分化相关基因(CEBPA、LPL、PLIN1、PPARG)的表达情况,每种基因均以第一周A组的基因表达量为对照值,以比较相对表达量。结果显示,各基因在A组和B组的相对表达量均极低,且在两个时间点上无明显变化(P>0.05),而C组和E组的基因相对表达量相当,均较A组和B组稍高(P<0.05),第2周时C组和E组的基因表达量均有所上升但增长并不明显。D组的基因相对表达量明显高于其他4组,而且相比第1周,其第2周时的基因表达量有明显增长(P<0.05)(图4)。
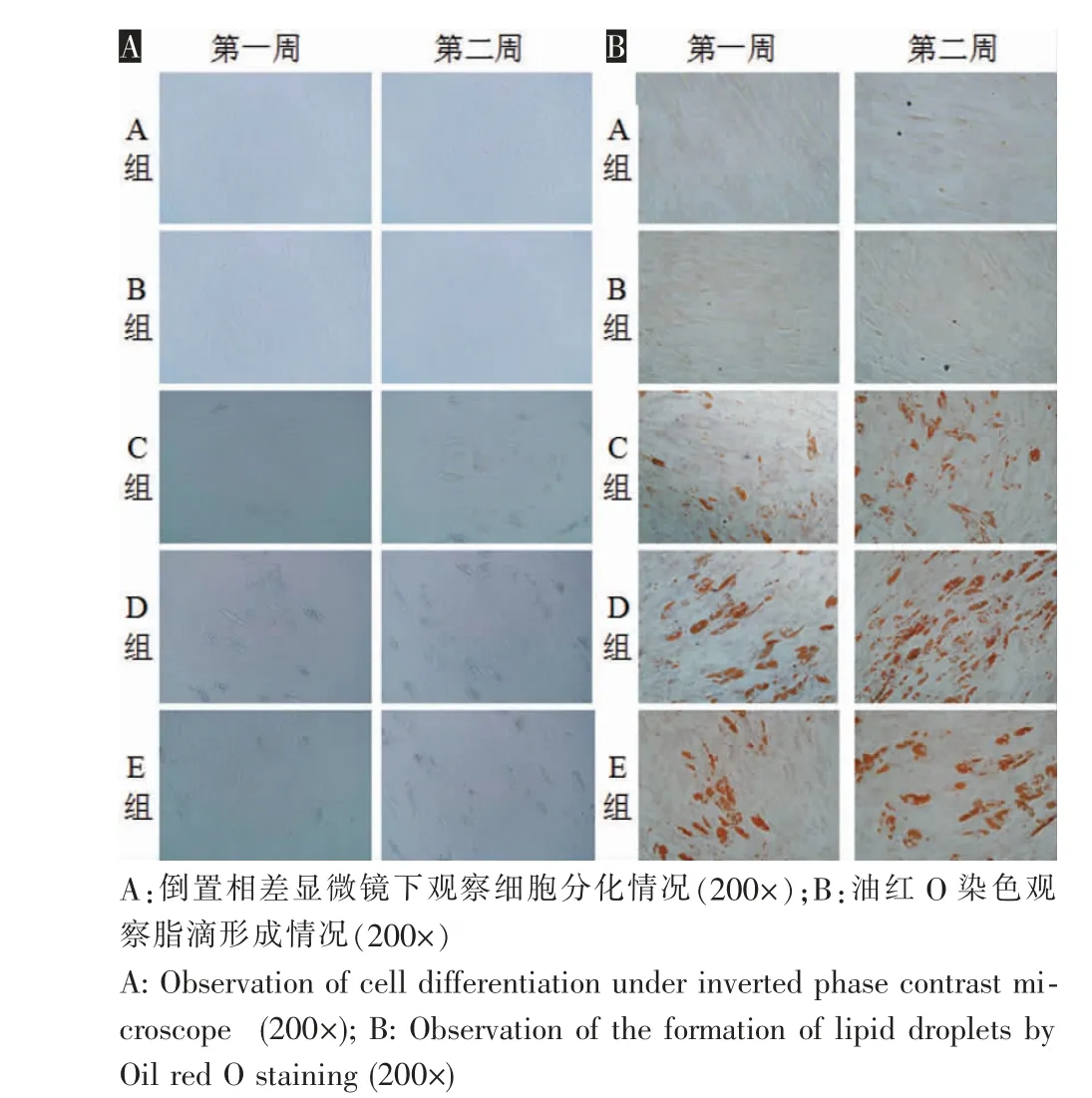
图2 各组细胞形态观察Fig.2 Morphological observation of cells in each group

图3 Western-blot检测各组Perilipin A蛋白表达情况Fig.3 The expression of Perilipin A protein in each group detected by Western-blot
3 讨论
间充质干细胞的成脂分化是一个非常复杂的过程。目前的研究结果认为,脂肪分化的调控基因主要包括PPAR-gamma、CEBPA、LPL和ADD1等[8]。其中,PPAR-gamma的高表达能正向调控脂肪细胞形成的过程,是脂肪分化过程中不可或缺的,这种调控作用主要在脂肪分化的早期阶段[9]。
Yu等[10]的研究证实,Hem-MSCs能够高表达PPAR-gamma基因,我们的前期研究证实,PPARgamma基因在血管瘤消退期和消退完成期均大量表达,说明PPAR-gamma信号通路参与了血管瘤消退过程[4]。相关研究也证实PPAR-gamma的激动剂罗格列酮能促进BMSCs的成脂分化过程[6]。因此,我们推测这种促进作用对于Hem-MSCs同样有效。
在体外的细胞诱导分化实验中,我们发现在未给予脂肪分化诱导培养基的组别中,给予罗格列酮药物刺激并不能促使细胞进入脂肪分化过程,而在脂肪分化诱导培养基条件下,罗格列酮给药组能够观察到大量分化的脂肪细胞,油红O染色也显示该组中有大量成串的脂滴形成,且在给药到第2周时我们能观察到更多脂滴形成,较第1周时明显增多。
Western-blot检测显示,A、B组中仅有极少的Perilipin A蛋白表达,而在给予成脂分化诱导培养基的另外3组中,加入罗格列酮可使Perilipin A蛋白的相对表达量明显增长。
我们通过实时定量PCR,检测了成脂分化相关基因(CEBPA、LPL、PLIN1和PPARG等)的表达情况,结果也证实罗格列酮能够促进Hem-MSCs中成脂分化相关基因在脂肪分化各阶段的高表达。
本实验还证实了GW9662拮抗组能抑制了罗格列酮对Hem-MSCs成脂分化的影响,也进一步说明了罗格列酮的相关促进作用是通过PPAR-gamma信号通路来实现的。
本研究结果显示,罗格列酮单纯激活PPARgamma信号通路并不能启动Hem-MSCs的成脂分化过程,而是在Hem-MSCs已经具备成脂分化微环境的前提下,通过在成脂分化早期促使PPAR-gamma基因高表达,从而调控其他下游基因的表达,以达到促进成脂分化的结果。
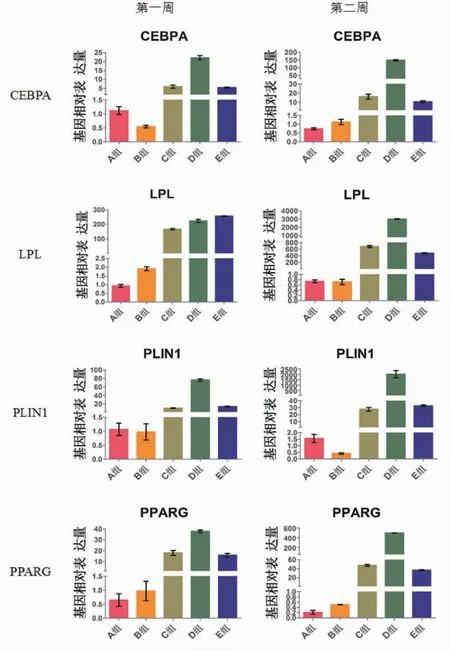
图4 PCR检测不同时间点各组Hem-MSCs细胞成脂肪分化基因的相对表达量Fig.4 Detection of relative expression of adipogenic differentiation genes in hem-MSCs cells at different time points by PCR
有研究表明,IH瘤体内的内皮细胞与Hem-MSCs接触时会通过wnt信号通路抑制Hem-MSCs的成脂分化[11],而wnt信号通路主要是通过抑制PPARγ和CEBPA两种基因的表达来达到抑制成脂分化的效果[12]。当IH进入消退期时,内皮细胞大量凋亡,这种抑制作用消失,Hem-MSCs逐渐进入成脂分化进程,这是IH的自然消退过程。本研究结果证实罗格列酮可促进Hem-MSCs在体外的成脂分化过程,该促进作用是通过激活PPAR-gamma信号通路来实现的,且在这一过程中明确提高了CEBPA和PPARG基因的表达。因此,我们认为罗格列酮能够加速IH的消退进程。
IH的消退过程包括内皮细胞的大量凋亡和Hem-MSCs的成脂分化两个重要方面,目前我们的研究仅是体外实验,罗格列酮在体内是否同样能够发挥这样的促进作用,是否同时能够加速内皮细胞的凋亡,最终加快IH的消退过程,则需要进一步的研究去证实。
