贲门内损并幽门贲门损伤法建立胃食管反流模型
2019-03-28韩梦婷罗福祥戴文豪李治建斯拉甫艾白
韩梦婷, 马 丽, 罗福祥, 戴文豪, 李治建, 斯拉甫·艾白,
(1新疆医科大学药学院, 乌鲁木齐 830011; 2新疆维吾尔自治区维吾尔医药研究所毒理学研究室, 乌鲁木齐 830049;3新疆医科大学公共卫生学院, 乌鲁木齐 830011)
胃食管反流病(gastroesophageal reflux disease,GERD) 是指胃内容物反流至食管,引起一系列不适症状和或并发症的一种消化系统动力障碍性疾病[1-3],其造模方式多样,但仍没有公认的标准的高存活率高成功率的造模方案[4]。国内外文献报道的造模方式多种多样,有的模型简易却不符合病情特点,有的手术操作难度较大不易实行[5-7]。本研究结合中医理论中改良酸灌注配合夹尾模型[8],以及同时设计创新优化手术造模方式制备模型[9-10],设计了三种操作可行、较符合病程的胃食管反流病大鼠模型。通过一般观察及血液学指标以及病理检验对该模型进行综合评价[11],旨在为后续模型建立提供一定依据。
1 材料和方法
1.1实验动物雄性SD大鼠60只,体质量(200±20)g,购于新疆医科大学实验动物中心,许可证号:SCXK(新)2016-0003。实验动物饲养于维吾尔医药研究所,SPF级,室温20~25℃,相对湿度40%,自由饮水饮食。
1.2材料大鼠饲料:北京科澳协力饲料有限公司(批号18013113),电子秤(型号:TC3K-H,常熟市双杰测试仪器厂),pH仪(型号:PHS-3C上海仪电科学仪器有限公司生产),SYSMEX全自动血细胞分析仪动物专用(型号:XT- 2000IV),不可吸收可吸收缝合线(上海浦东金环医疗用品股份有限公司),注射用头孢呋辛钠(国药集团有限公司,批号:K171211),碘伏(江西草珊瑚消毒用品有限公司生产,批号:20180903),氯化钠注射液0.9%(四川科伦药业股份有限公司生产,批号:L217010304),胃蛋白酶(Sigma生产),眼科剪(苏州六六维纳斯剪刀,型号:54140B),葡萄糖粉剂(重庆和平制药有限公司生产,批号:180426),戊巴比妥钠,动物手术台,无菌孔巾,75%乙醇,棉签,无菌纱布块,常规手术器械(剪刀、镊子、手术刀)等。
1.3方法
1.3.1 CON组及SO组 依据实验需要将大鼠随机分为6组,分别为空白组(CON组)、假手术组(SO组)、稀酸灌注配合夹尾组(GER 1组)、浓酸灌注配合夹尾组(GER 2组)、幽门半结扎加贲门括约肌松弛组(GER 3组)、幽门半结扎加贲门括约肌松弛并贲门肌内损组(GER 4组)。每组10只,自由进食饮水7 d之后开始造模。CON组即正常饮食饮水14 d。SO组术前禁食24 h不禁水。先测量每只大鼠体质量,以戊巴比妥钠40 mg/kg腹腔注射麻醉后,腹部剑突以下部分手术备皮。动物以仰卧位置于手术台上,胸腹部以碘伏消毒。SO组在胸腹部创口开3 cm大小,取上腹正中切口,胃部开孔后缝合胃部开孔,暴露腹腔脏器15 min后关腹,关腹前翻动腹腔相关脏器数次。术后禁食不禁水,观察大鼠饮食、粪便及活动情况。给予静脉营养支持1次,以及用头孢曲松钠腹腔注射连续3 d。术后48 h正常饮食,饮水中添加葡萄糖支持。对死亡动物随即行尸体解剖,观察胸腹腔脏器大体改变,以对其死因作出分析判断。
1.3.2 GER1组及GER2组 每5只1笼,按照“食管酸灌注配合夹尾刺激法”造模14 d:每日大鼠正常进食饮水。GER 1组灌胃给予盐酸溶液(pH=3.0,含0.5%胃蛋白酶),GER 2组灌胃给予盐酸溶液(pH=1.0,含0.5%胃蛋白酶)。灌胃给予盐酸10 mL/kg体质量,灌胃约30 min后,用长海绵钳夹夹住大鼠尾巴末端1/3处,使其尖叫挣扎,但以不破皮为限度,刺激并使其发怒和同笼其他大鼠厮打,每次刺激15 min,每隔10 min刺激1次,刺激3次后停止,14 d后造模结束。
1.3.3 GER 3组及GER4组 GER 3组术前准备同SO组。上腹正中切口后分离贲门幽门及胃,用外径为4 mm的玻璃棒从胃体部位穿刺入胃,避开胃部血管。通过幽门至十二指肠,避开肠部各处血管,缝扎玻璃棒外包裹的幽门及十二指肠部分。缝扎时采用3-0不可吸收缝合线,以免动物自行吸收结扎部分,注意剥离分隔幽门十二指肠处的肠部其他血管,采用棉签等拨开血管后结扎。缝扎完毕后,将玻璃棒抽出(图1)。此来保证大鼠在模型建立后所剩余的幽门内径均匀一致。缝合胃部穿刺点,于食管胃交界处纵行切开食管下括约肌肌层,分离至仅剩黏膜完全暴露于视野中,不可割破贲门以及破坏食管贲门处神经。术后操作同SO组术后。GER4组术前准备及术中内容均同GER 3组。但在术中,玻璃棒缝扎幽门及十二指肠部分后,将玻璃棒穿过贲门,从胃部向食管延伸,以在内部扩张贲门,将贲门括约肌松弛程度加剧。在此基础上,再纵行切开食管下括约肌。
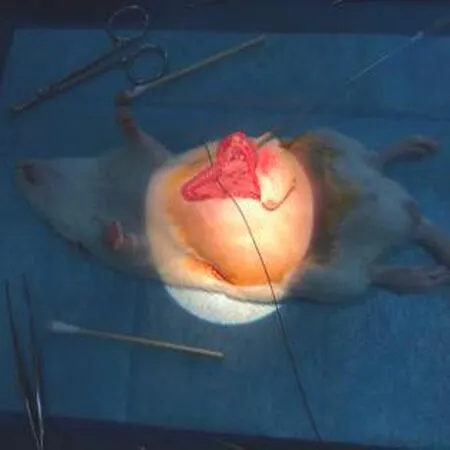
a: 幽门结扎操作示意图

b: 贲门括约肌内损操作示意图
图1幽门半结扎、贲门括约肌内损操作图
1.4动物观察及标本制备于术后7 d,将SO组GER 3组和GER 4组麻醉,通过腹主动脉采血约2 mL后放血处死。将全血置于血细胞分析仪中检测白细胞(WBC)、中性细胞(NEUT)、淋巴细胞(LYM)、单核细胞(MONO)、嗜酸性粒细胞(EOS)。沿缝合口开腹,从贲门上缘处取出食管,用生理盐水冲洗干净,取食道中下段部分、胃部、及肺部置于10% 福尔马林溶液固定后做石蜡切片,HE染色后于光镜下进行观察。于连续灌胃盐酸14 d后,将CON组、GER 1组、GER 2组同上操作。
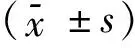
2 结果
2.1各组大鼠一般观察、体质量的变化造模前各组大鼠体态食量正常,平均体质量差异无统计学意义。造模中,CON组、GER 1组及GER 2组造模期间大鼠无死亡。进行酸灌注造模阶段,GER 1组及GER 2组大鼠性情暴躁易怒,时常相互间厮打,四肢常见被抓伤,呈现前肢离地毛发竖立,并发出“呼呼”的怒叫,毛发粗糙无光。刺激后缓慢恢复,抓伤伤口可自行恢复。GER 1组与GER 2组平均体质量增加与CON组差异无统计学意义。SO组、GER 3组、GER 4组共死亡5只大鼠,死亡率为16.7%,其中SO组意外死亡1只(10.0%),术后非预期死亡4只(20.0%)。GER 3、GER 4组处死前营养状态差,体毛无光泽。各组体质量均有增加,但GER 3组、GER 4组仍低于CON组(P<0.05)及SO组(P<0.05),GER 3组大鼠体质量增加高于GER 4组(P<0.05),见表1。
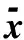
表1 各组大鼠在不同时间点的体质量比较(±s, g)
注:与CON组比较,*P<0.05; 与SO组比较,△P<0.05;与GER3组比较,#P<0.05。
2.2全血白细胞计数及白细胞分类计数GER 1组与GER 2组各项指标与CON组差异无统计学意义。与CON组比较,GER 3组、GER 4组白细胞计数,中性细胞及淋巴细胞等均明显升高(P<0.05)。与SO组比较,GER 3组GER 4组白细胞计数等差异也具有统计学意义(P<0.05),见表2。
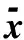
表2 各组大鼠全血白细胞计数及分类计数的比较(±s, ×109/L)
注:与CON组比较,*P<0.05; 与SO组比较,#P<0.05。
2.3各组大鼠食管、胃、气管组织病理学比较
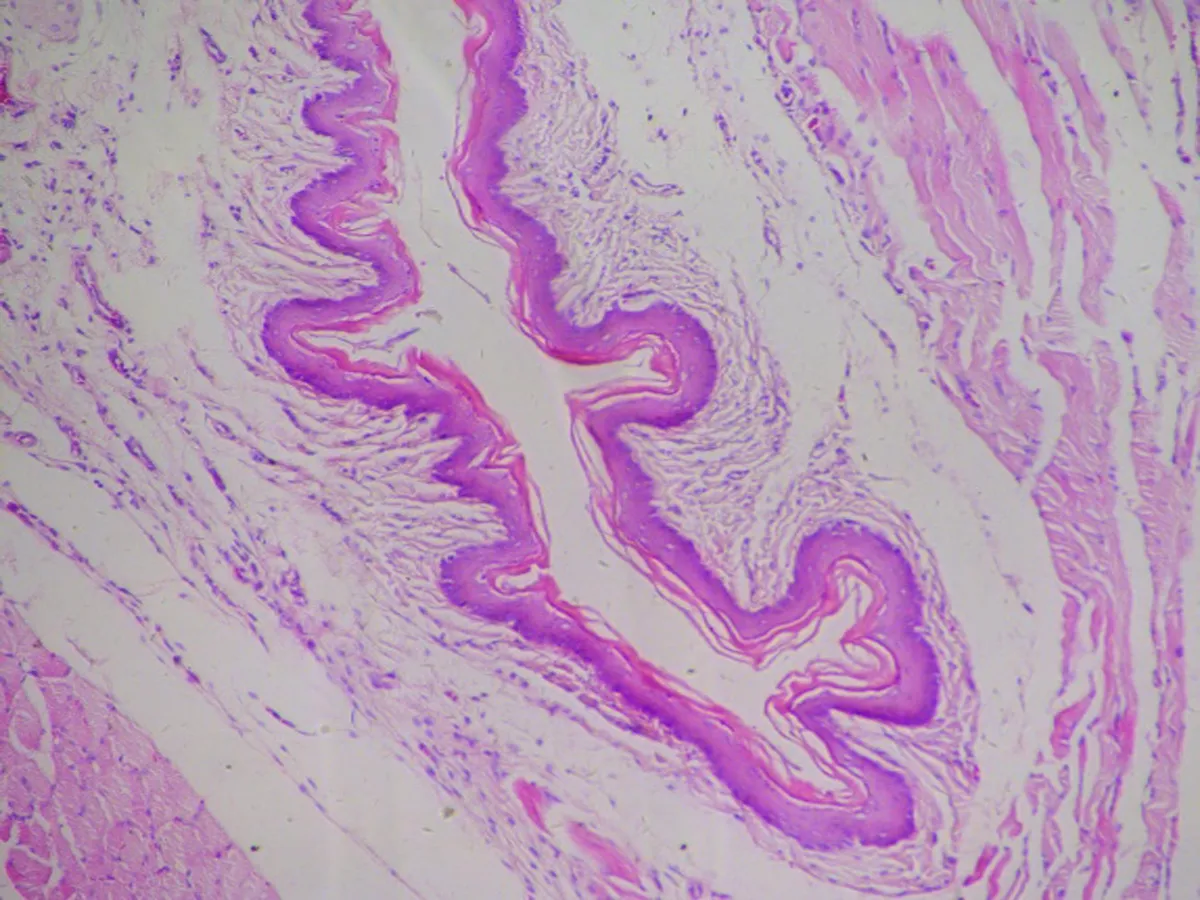
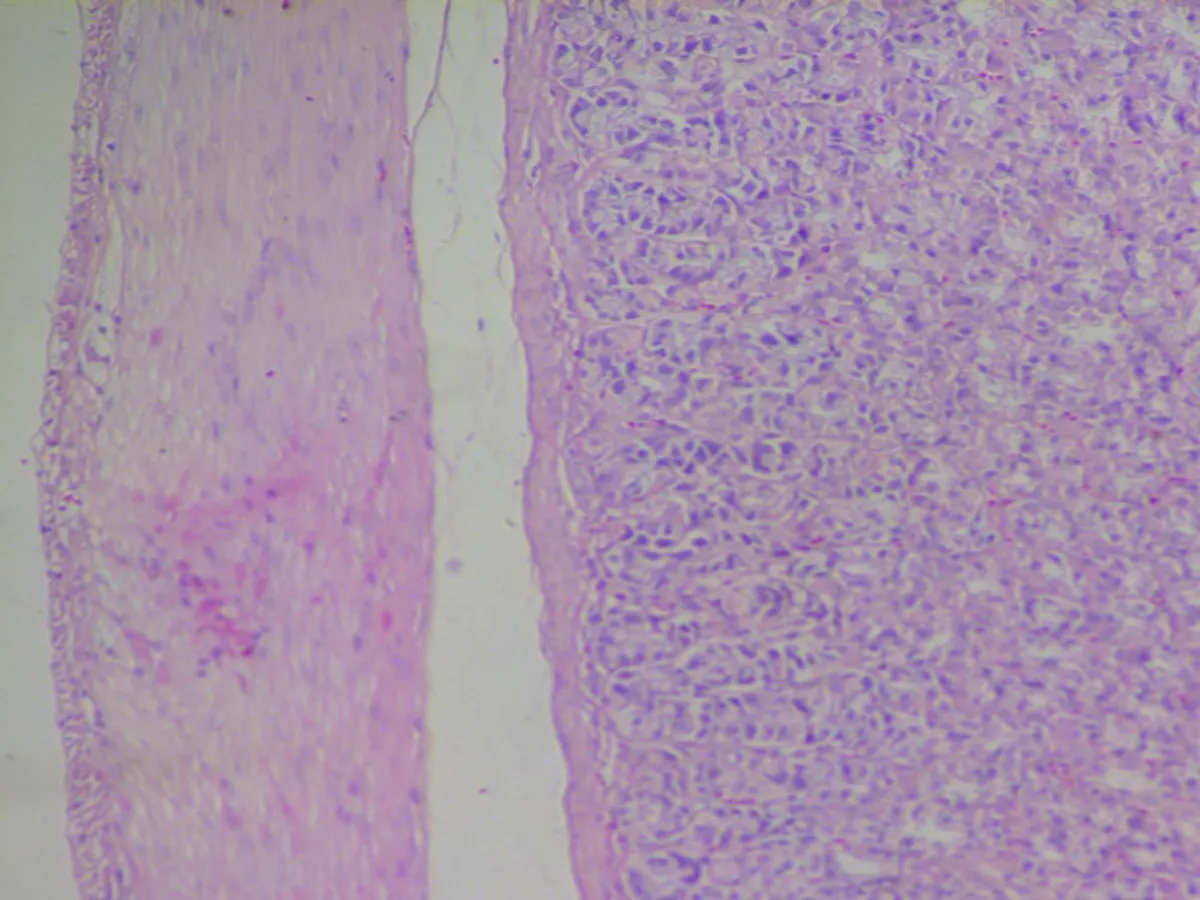
2.3.1 食管组织病理学特征 SO组、GER 1组、GER 2组食管未发现病变,与CON组无变化,此4组均为正常结构。GER 2组正常食管结构,可见为典型的复层鳞状上皮,除上皮细胞层内有少量炎症细胞外,结构和细胞层次未见明显异常。GER 3组食管黏膜下层中性粒细胞和淋巴细胞浸润,上皮基底细胞和棘细胞层增生。GER4组食管以淋巴细胞炎症为主,上皮部分或全层缺损分裂,底部覆以渗出物及肉芽组织,并可见食管上皮层不同程度增厚。同时部分血管发生改变出现水肿出血,炎症情况严重。以基底层及棘层细胞增生为主,乳头延长并有可见溃疡形成(图2)。
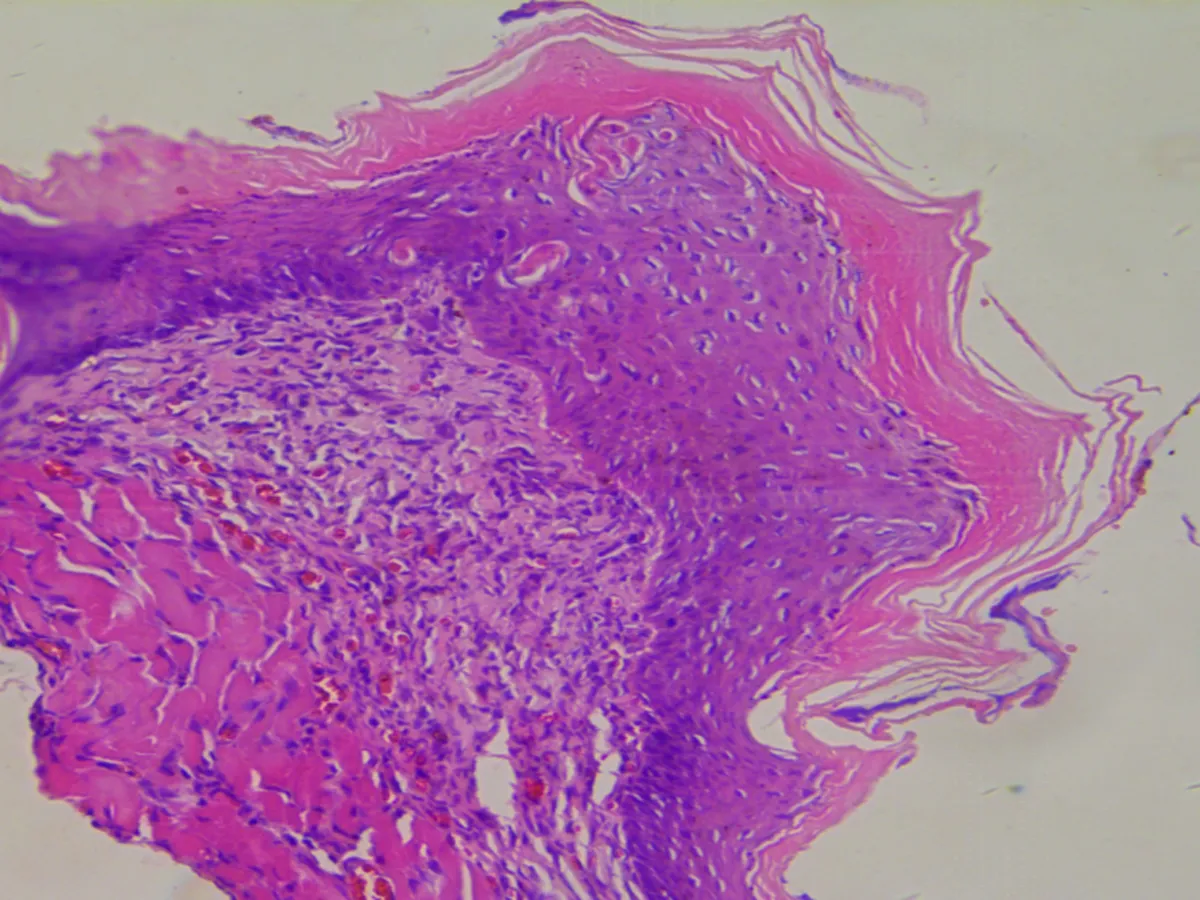
2.3.2 胃部病理组织学观察 GER1组、GER 2组与CON组、SO组胃部无变化,均为正常结构。GER 3组未观察到明显病变,而GER 4组胃部结构部分发生变化,如黏膜下以中性粒细胞为主的炎细胞浸润,黏膜固有膜间有炎症细胞浸润,胃与贲门交界处间质灶状炎细胞浸润(图3)。
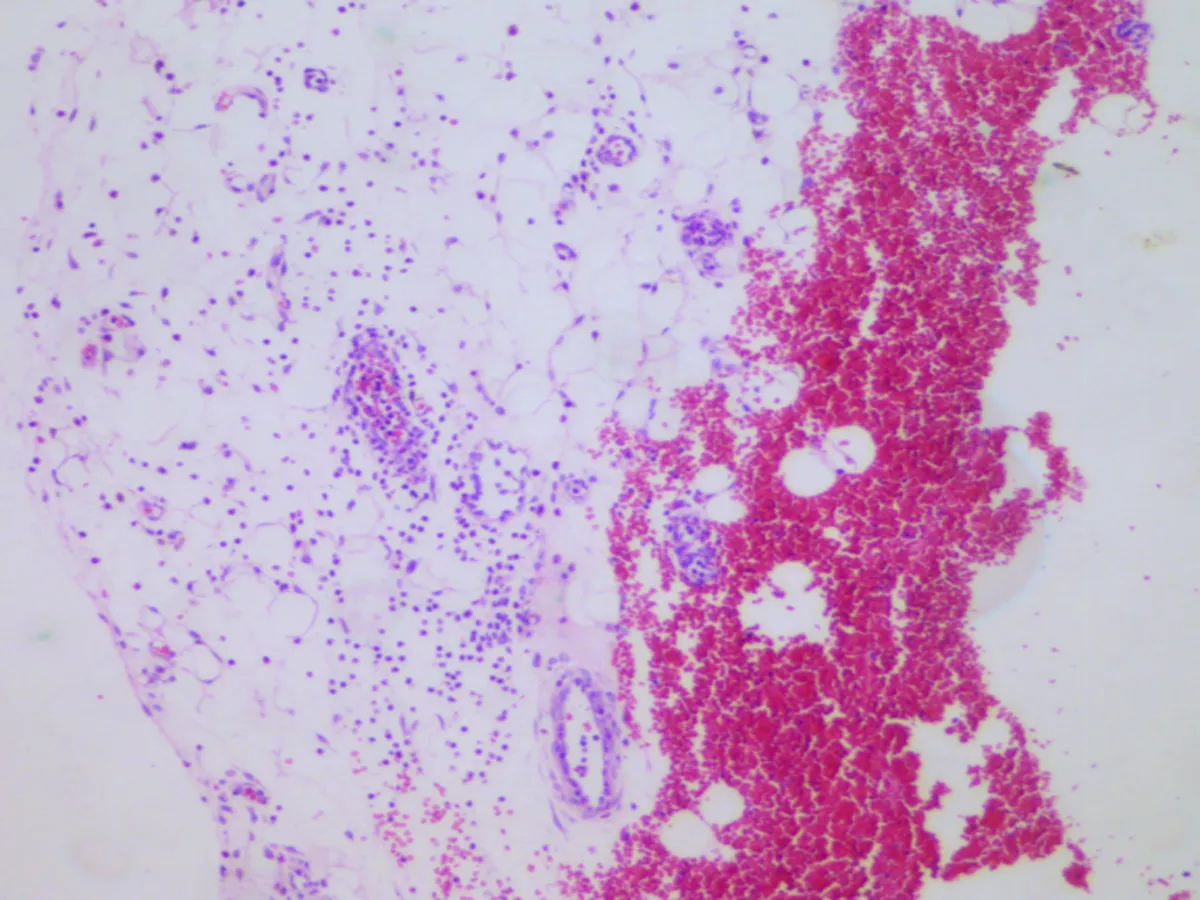
2.3.3 气管和肺部病理组织学观察 各组大鼠气管结构均正常,如CON组。各组大鼠肺部结构均正常,如CON组。在GER 1组中,发现2只大鼠肺部炎性细胞浸润及出血,根据炎症情况考虑为灌注造模液时呛咳所致,也有可能为造模成功后酸反流入肺部而引起的炎性细胞浸润,症状较轻(图4)。
a: GER 2组(HE,×100)
b: GER 3组(HE,×200)
c: GER 4组(HE,×100)

d: GER 4组(HE,×100)
图2各组大鼠的炎症情况在食管组织病理图
a: GER 1组(HE,×100)

b: GER 2组(HE,×200)

c: GER 3组(HE,×200)
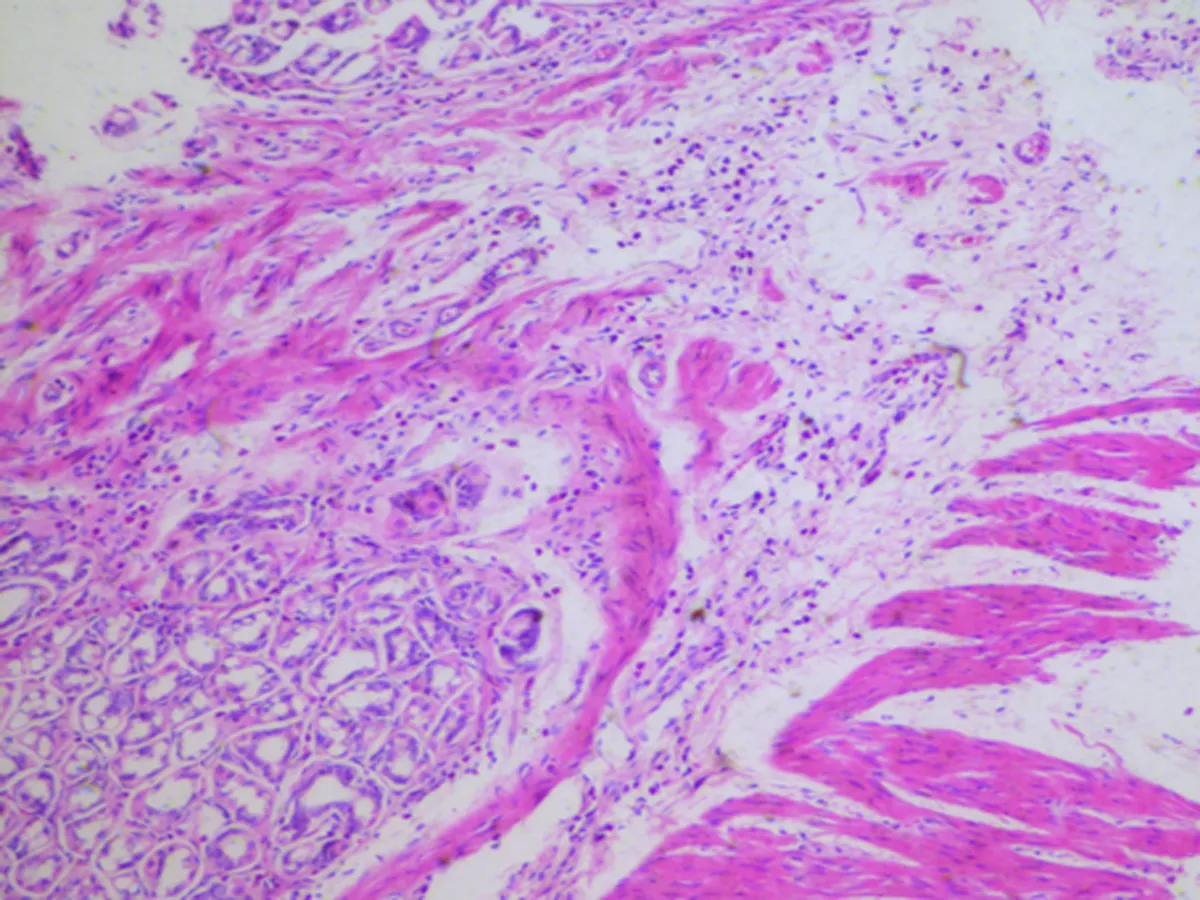
d: GER 4组(HE,×100)
图3各组大鼠的炎症情况在胃组织病理图
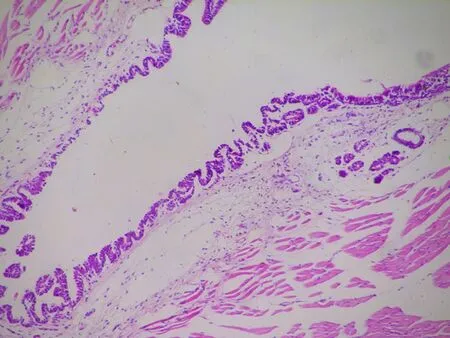
a: CON组气管(HE,×100)

b: CON组肺(HE,×100)
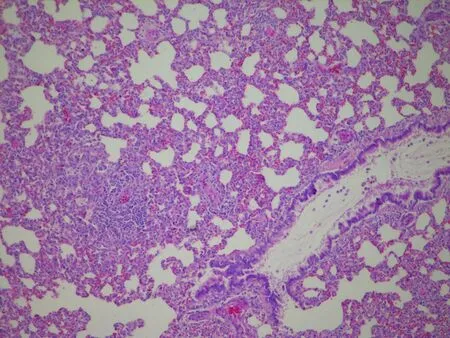
c: GER 1组肺(HE,×100)

d: GER 1组肺(HE,×100)
图4各组大鼠的炎症情况在气管、肺组织病理图
3 讨论
理想的动物模型需要保证较高的存活率和生存质量,方法应尽量简单易行,另一方面要病变形成率高,并符合研究需要。国内外研究者探究GERD模型制备时,想通过外源性酸类诱导造成胃食管炎,即向食管内灌注酸。由于持续灌注的内容物可以简单模拟胃食管反流的过程,又考虑到哮喘病人伴有GERD时多由胃酸引起,产生咳嗽反应将会使模型更符合临床表现。豚鼠的呼吸系统较为敏感,其高敏反应的靶器官为肺脏,能产生速发相和迟发相双相哮喘反应,因而成为模型常用的动物种属。
本研究实验选定豚鼠进行造模预实验。在预实验中豚鼠麻醉后缓慢灌注酸,因每日麻醉灌注再苏醒,体质量持续下降,连续多日死亡率较高,无法持续14 d酸灌注,死亡率达到80%以上。因无法成功复制,改用大鼠。
本研究对大鼠进行高浓度酸灌注,探讨能否形成GERD模型。考虑到大鼠耐受性强,容易无法形成反流性食管炎,盐酸溶液浓度需要与豚鼠有所区别,因而选择使用pH=3及pH=1的盐酸(含0.5%胃蛋白酶)。从一般观察及呼吸声音上判断是否存在反流,以及大鼠嘴边反流物流出,出现便溏及拉尾现象。GERD形成过程中存在诸多病理因素[12],从病因胃排空延缓、心理因素等加以改良,在功能性消化不良肝郁脾虚证动物模型得到启发,灌酸同时进行夹尾刺激[13]。结合中医胃食管反流的诊断病因结合,创新提出:病症结合的造模方式“酸灌注配合夹尾”。研究表明,该造模方式虽保证存活率和生存质量,但通过体质量、白细胞分类计数及组织病理学检测均与CON组差异无统计学意义。
同时,本研究对大鼠进行了手术造模改良:幽门半结扎,同时在贲门内部破坏括约肌。此手术法不造成食管贲门破裂,也不形成神经损伤,操作简单易于实行。在术中将玻璃棒从内穿过贲门,贲门通过时会有狭窄感,穿过贲门后进入食管后抽出。能在内部扩张贲门,将贲门括约肌松弛情况加剧。通过对体质量、白细胞分类计数和组织病理学检测,GRE 3组和GER 4组体质量低于SO组(P<0.05),且GER 3组、GER 4组白细胞计数,中性细胞及淋巴细胞等均明显升高(P<0.05)。从病理学检查情况来看,GER 4组造模后上皮层存在明显的增厚,黏膜层有大量的炎症细胞存在,更符合GERD模型特点。
手术造模方法对操作技术有较高要求,GER 3、GER 4组7 d内死亡4只,其中GER 3组2只,GER 4组2只,死亡原因主要是幽门梗阻、食管重度糜烂伴出血。而SO组恢复较快,术后几日进食饮水情况逐渐恢复。因此在手术时,幽门及十二指肠结扎时管径不可过小,建议使用4 mm管径为宜。贲门括约肌松弛时不可割破贲门,注意勿伤贲门上食管上迷走神经。
综上所述,贲门内部损伤并幽门半结扎,加贲门肌松弛方法手术操作成功率高,符合自然病程,是较为理想的胃食管反流大鼠模型。
