内因子及壁细胞抗体阴性的自身免疫性胃炎1例及文献复习
2019-03-27吴传楠张海涵刘世育陈光侠
吴传楠, 张海涵, 刘世育, 陈光侠
徐州医科大学附属徐州市立医院,江苏 徐州 221000
自身免疫性胃炎(autoimmune gastritis,AIG)目前尚无确切的金标准,诊断要点:(1)胃镜示胃体萎缩明显,胃窦无萎缩;(2)合并巨幼细胞性贫血(megaloblastic anemia,MA);(3)羟丁酸脱氢酶及乳酸脱氢酶显著升高;(4)内因子抗体(internal factor antibody,IFA ) 及壁细胞抗体(parietal cell antibody,PCA)阳性[1]。虽然AIG发病机制和IFA及PCA有关,但在ANTICO的一项血清学胃活检对AIG的诊断价值研究中发现,AIG中PCA的阳性者占45.8%,PCA、IFA均阳性只占12.9%[2]。AL-JABRI 等[3]研究发现,AIG中PCA阳性率为60%,且在系统性红斑狼疮等多种自身免疫性疾病中仍可检测出。LAHNER等[4]一项回顾性研究也发现,AIG中IFA抗体阳性率为27%,故IFA和PCA并非诊断AIG金指标。现报道1例IFA和PCA均阴性的AIG。
病例患者,女,85岁,因“上腹不适1年余”入院。患者自1年前始无明显诱因下出现上腹部不适,阵发性发作,无恶心、呕吐,纳差,双手略有麻木感。查体:神志清。贫血貌。结膜苍白,巩膜无黄染。心肺听诊无异常。腹平坦,剑突下有轻度压痛,无反跳痛,肝、脾肋下未及,胆囊未及肿大,无肝肾区叩击痛及移动性浊音,肠鸣音4次/min。双下肢无水肿。辅助检查:入院查血常规:白细胞1.86×109L-1、红细胞1.68×1012L-1、血红蛋白73 g/L、血小板103.00×109L-1。1周后复查血常规:白细胞2.18×109L-1、红细胞1.86×1012L-1、血红蛋白:75 g/L、血小板145.00×109L-1。营养性贫血检查:铁蛋白103.20 ng/ml、维生素B12 26.00 pg/ml、叶酸20.01 ng/ml。入院时查肝功能:羟丁酸脱氢酶433 U/L、乳酸脱氢酶513 U/L、总胆红素33.6 μmol/L、间接胆红素26.60 μmol/L。1周后复查肝功能组合:羟丁酸脱氢酶246 U/L、乳酸脱氢酶280 U/L、总胆红素15.6 μmol/L、间接胆红素12.20 μmol/L、直接胆红素3.4 μmol/L、幽门螺杆菌 (H.pylori)测定:碳呼气试验均阴性,快速尿素酶法检测阴性,血清H.pylori抗体阴性。血清标本采集及检测:胃蛋白酶原(PG)Ⅰ 4.83 μg/L、PGⅡ 2.78 μg/L、PGⅠ/Ⅱ 1.74、胃泌素17 44.75 pmol/L、胃H.pyloriIgG抗体:阴性;IFA及PCA阴性。胃镜:逆向萎缩特点,胃体胃底萎缩明显。胃体-胃底:红白相间,以白相为主,皱襞变平,局部消失,黏膜血管显露(见图1)。病理:胃体-胃底:黏膜慢性萎缩性炎,胃底腺的壁细胞和主细胞明显减少,见肠腺化生。胃窦:慢性中度浅表性炎(见图2)。
肌肉注射维生素B12 500 μg,qd,口服叶酸片10 mg/d,治疗后每7 d复查血常规网织红细胞计数,血红蛋白正常后,肌肉注射维生素B12 500 μg,每个月1次。
治疗结果如下: 3 d后食欲、双手麻木感开始改善。治疗7 d后复查红细胞、血红蛋白示开始上升,10 d后临床症状基本消失,30 d后恢复正常。随访4个月无明显不适。
本例AIG符合以下诊断要点:(1)胃镜示胃底、胃体萎缩明显,胃窦病理示慢性炎症、未见腺体萎缩;(2)维生素B12减少,存在MA;(3)PGⅠ、PGⅠ/Ⅱ均显著下降、胃泌素17显著升高。胃泌素17升高提示胃体萎缩明显;(4)羟丁酸脱氢酶及乳酸脱氢酶显著升高,符合AIG诊断[5]。
讨论根据《中国慢性胃炎共识意见》[6],依据病理结果分为非萎缩性胃炎和萎缩性胃炎。其中A型萎缩性胃炎又称AIG,多合并MA,胃镜下典型表现为胃体胃底萎缩,而胃窦正常。发病机制是胃H+-K+-ATP酶的自身免疫,其免疫学机制可能是体内存在内因子、壁细胞等多种抗体,导致维生素B12
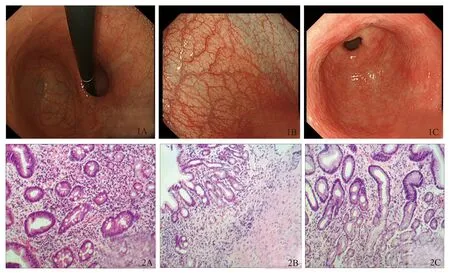
注:A:胃底; B:胃体; C:胃窦。
吸收障碍和胃酸分泌障碍[7]。AIG是一种CD4T细胞介导的疾病,CD4+和CD25+调节性T细胞在AIG疾病发生、发展过程中起至关重要的作用[8]。人类白细胞抗原(HLA)基因变异影像AIG的易感性,HLA-DRB 1*04和DQB 1*03等位基因可能是AIG的易感基因[9]。
下面对该例AIG患者进行分析,对其胃底及胃体黏膜萎缩及MA的特点进行讨论:
(1)AIG表现为胃体及胃底黏膜萎缩。检查包括胃镜组织活检,血清PG及胃泌素的测定。首先,普通胃镜示逆向萎缩特点,胃体胃底萎缩明显。表现为红白相间,以白相为主,皱襞变平,局部消失,血管透见。放大胃镜可见胃窦黏膜呈螺旋状上皮毛细血管网(SECN),排列规则,胃体黏膜SECN消失小静脉排列不规则[10]。组织学显示,胃体腺体密度降低,壁细胞和主细胞消失。胃窦为浅表性炎。此外,PG为胃蛋白酶的前体,其中PG Ⅰ、PGⅡ大量存在于胃体主细胞,当胃体腺萎缩时,主细胞减少,PG Ⅰ和PGⅡ含量下降。AIG胃窦黏膜没有萎缩,分泌胃泌素的G细胞常有显著增生。这是因为胃体黏膜萎缩者由于缺乏壁细胞而酸分泌减少,故胃窦腔中没有足够的酸度来抑制G细胞分泌胃泌素,所以导致高胃泌素。在胃泌素的多种生物活性成分中,胃泌素17含量最多,作用最重要。胃泌素17显著升高多提示胃体萎缩[11]。该患者PGⅠ、PGⅠ/Ⅱ、PGⅡ显著下降,胃泌素17显著升高,提示胃体萎缩。
(2)H.pylori感染是否会导致AIG尚有争议。AMEDEI 等[12]研究发现,H.pylori通过刺激T淋巴细胞水平的分子模拟机制,激活自身免疫机制,导致AIG发生。然而还有报道[13],在H.pylori感染的高发地区,AIG的发病率低。假设H.pylori感染可能导致和加重萎缩性胃炎的发生和发展,进一步影响维生素及叶酸的吸收,造成贫血的恶性循环,那么早期根除H.pylori可能会阻止黏膜的进一步进展。该患者多种方法查H.pylori均为阴性。提示H.pylori感染可能不是AIG巨幼贫发生的直接致病因素,但还有待大样本量的研究。
(3)AIG与MA的发生互为因果[14]。部分AIG患者存在IFA影响维生素B12的吸收,导致MA的发生。而MA同时会加重胃黏膜萎缩、肠化、异型增生的进展。MA患者症状缺乏特异性,故MA早期诊断困难,容易误诊。部分患者因食欲差在消化科就诊。① MA因叶酸和(或)维生素B12不足,导致细胞内DNA合成减缓,细胞核变大,核质疏松,但胞质内RNA及蛋白质的合成不受影响,造成RNA与DNA的比例失调,进而形成胞体巨大而核发育相对幼稚的巨型细胞,骨髓三系均可出现巨幼改变。本例患者出现了三系细胞减少,经补充维生素B12后,不仅血红蛋白升高,白细胞及血小板也有显著升高。且白细胞在治疗早期显著升高。② MA患者除有贫血表现外,还有舌面鲜红光滑、纳差、上腹不适、轻度黄疽等表现。本例患者舌面光滑,出现了总胆红素的轻度升高,以间接胆红素升高为主。分析原因可能为维生素B12缺乏导致无效造血,红细胞在骨髓内破坏,间接胆红素升高。经叶酸及维生素B12诊断性治疗,治疗2周后贫血及其他症状明显改善,可明确MA的诊断。③ AIG合并MA多有羟丁酸脱氢酶及乳酸脱氢酶显著升高,可能与骨髓的原位溶血有关。本例患者羟丁酸脱氢酶及乳酸脱氢酶升高,经补充维生素B12治疗1周后,有明显下降趋势,且发现其早于网织红细胞的变化,故此指标可帮助AIG评估治疗效果。
(4)关于AIG预后,AIG胃泌素17表达水平明显升高,SMITH等[15]研究表明,胃泌素17参与胃癌形成和生长的全过程,诱导胃黏膜细胞增殖、凋亡抑制及恶性转化。此外OSHIMA等[16]发现,AIG有并发胃类癌的可能,针对早期胃类癌,可进行胃镜下黏膜剥离术,预后良好。提示我们需要警惕胃癌、胃类癌的发生,应定期复查胃镜,早期予以实施ESD。除此之外,AIG常伴发其他自身免疫性疾病[17],常见的有1型糖尿病[18]、自身免疫性甲状腺炎[19]、系统性红斑狼疮[20]。
通过对本病例的诊治及文献复习,我们发现,在我国老年人AIG合并MA并不少见,临床医师在行胃镜检查时,应标准化操作,规范摄图,多点活检,若发现贫血且合并胃体萎缩的患者,应警惕AIG,进一步完善胃泌素、IFA及PCA,综合以上几个方面做出诊断。此外,对于不明原因的MA患者,要行胃镜检查。只要对本病有足够的认识,并对其诊断提高警惕,确诊并不难。该病治疗方法简单,经规律治疗,症状消失快,可明显改善患者生活质量。在疾病的随访过程中,定期复查胃镜,警惕胃类癌的发生。
