茄科劳尔氏菌单克隆抗体的制备及其特性鉴定
2019-03-26曾海娟谢曼曼丁承超王淑娟翟绪昭孙静娟董庆利
马 兰, 曾海娟, 谢曼曼, 胡 谦, 丁承超, 王淑娟, 翟绪昭, 孙静娟, 李 杰, 王 艳, 董庆利, 刘 箐
(上海理工大学 医疗器械与食品学院, 上海 200093)
茄科劳尔氏菌(Ralstoniasolanacearum,RS) 菌体呈短杆状,革兰阴性菌,属于假单胞菌科,劳尔氏菌属[1]。青枯病菌种内变异丰富,按不同的宿主范围分为5个不同的生理小种[2],分别侵染马铃薯、烟草,海里康、香蕉,马铃薯、番茄,姜和桑树。RS因广泛分布于各种地区,可引起番茄、茄子、辣椒、马铃薯等茄科蔬菜的青枯病害,成为多种农作物减产的主要原因。作为土传性细菌,RS能随土壤、灌溉水及宿主植株繁殖材料传播扩散,植株病害症状往往是发病晚期才显现,如若在侵染初期加强对 RS的检测,及时限制或清除病原菌,对青枯病的预防蔓延有重要意义。 目前,青枯病已被许多国家列为检疫对象,RS的检测也从传统的症状判断、微生物分离鉴定发展到免疫学如ELISA[3]、分子生物学诊断如PCR[4-6]。由于设备限制及技术要求等因素,当前的青枯病实际检测多以传统检测方法为主,其中微生物分离检测周期长且效率较低。相比较,免疫分析技术操作简便且分析时间短[7-8]。高特异性、高灵敏度的选择性单克隆抗体是免疫分析技术成功建立的关键因素之一。本研究选取青枯病菌GIM1.76作为免疫抗原制备抗青枯病菌的单克隆抗体,为后续建立RS免疫快速检测技术提供参考,以期降低番茄、茄子、辣椒、马铃薯等茄科农产品产量损失。
1 材料与方法
1.1 材料
1.1.1 菌株与培养基 ①RS宿主植物为生姜的4号生理小种菌株GIM1.71;RS宿主植物为马铃薯的3号生理小种菌株GIM1.74;RS宿主植物为木麻黄的2号生理小种菌株GIM1.76;RS宿主植物为桑树的5号生理小种菌株RS-5;RS宿主植物为番茄的1号生理小种菌株GMI1000,即RS标准菌株ATCC-BAA1114; 桑肠杆菌JX-6、苏云金芽胞杆菌SYJ。以上菌株均由江苏科技大学赠送,选用CPG(Casamino acid- Peptone-Glucose)培养基(葡萄糖5 g,水解酪蛋白1 g,蛋白胨10 g,双蒸水1 L)培养[9]。②瓜类细菌性果斑病菌燕麦嗜酸菌西瓜亚种标准菌株ATCC29625,野生菌株tw31、SD01、 PLSB1、00-1、99-5、xj112、plsb91,嗜酸菌魔芋亚种 ATCC33996、燕麦嗜酸菌卡特莱兰亚种NCPPB961、玉米细菌性条斑菌 ATCC19307,选用脑心浸液培养基培养。③梨火疫病菌QB0809、XL-4,选用LB培养基加蔗糖后培养。④玉米细菌性枯萎病菌QB0241、QB0242,选用魏氏培养基(酵母膏3 g,蛋白胨5 g,蔗糖10 g,磷酸二氢钾0.5 g,硫酸镁0.25 g,抗坏血酸1 g,双蒸水1 L)培养。⑤水稻细菌性谷枯病菌QB0017、QB0753、QB0755,选用LB培养基培养。
1.1.2 试剂 PCR相关试剂(Taq酶、DNTP、Mg2+、引物) (生工生物工程); DMEM培养基 (GIBCO公司);胎牛血清 (上海博升生物);青链霉素混合液、牛血清白蛋白 (Hyclone公司);聚乙二醇2000、二甲基亚砜、HRP标记的羊抗鼠二抗、8-AG、HAT培养基、HT培养基 (Sigma公司);液体石蜡、甘油、甲醛、考马斯亮蓝 G250、四乙基乙二胺、过硫酸铵、巯基乙醇、过氧化脲等 (国药集团)。
1.1.3 仪器与设备 PCR仪 (System 9700,美国Applied Biosystems公司); 凝胶成像仪 (G:BOX Chemi XR,英国Syngen公司); 纯水仪 (Milli-Q Academic A10,美国Millipore公司); 酶标仪 (SpectraMax/N2,美国Molecular Devices公司);蛋白纯化仪 (Biologic LP,美国Bio-Rad公司);电泳仪 (JY1000C,美国Bio-Rad公司);微量紫外分光光度计 (NanoDrop2000c,美国Thermo公司)。
1.2 方法
1.2.1 抗原准备 将5株RS分别接种于灭菌后的CPG液体培养基中,37 ℃摇床增菌,PCR扩增后进行琼脂糖凝胶电泳鉴定,以扩增核糖体基因序列(16S rDNA)为基础设计引物序列:RS-16S-F:TGTCCGGA AAGAAATCGCAC,RS-16S-R:CAGCACCTGTGTCCACTTTC,理论扩增片段大小为616 bp,由上海生工生物工程技术服务有限公司合成。选取GIM1.76于CPG液体培养基中增菌培养至饱和,离心弃上清后用PBS重悬,选OD600值为0.6(约1×109cfu/mL)时吸入注射器作为小鼠免疫原。
1.2.2 单克隆抗体的制备 ①小鼠免疫:每只小鼠腹腔注射0.3 mL免疫原,2周免疫1次,且第3次免疫1周后,断尾取血测效价,免疫效果不佳则继续免疫。选取效价最好的一只小鼠于冲击免疫1周后,眼球取血后脊椎脱臼处死小鼠,于超净工作台中无菌操作摘取脾脏,研磨冲洗出脾细胞,计数待细胞融合。眼球血液先在4 ℃放置后离心取血清,-20 ℃保存,以备检测抗体效价时作为阳性对照使用。②SP2/0骨髓瘤细胞的培养:融合前一个月用含8-AG的DMEM培养基进行SP2/0的复壮筛选,并培养3代以上。取状态良好的SP2/0注射到1周前被液体石蜡刺激的小鼠腹腔内(约105个/只)。待小鼠腹部膨大后,取腹水离心,在含8-AG的10% FBS完全培养基中筛选3代后扩大培养用做细胞融合,同时细胞于液氮罐中保存备用。③细胞融合及筛选:细胞融合前一天取健康小鼠的巨噬细胞作饲养层细胞并铺满10块96孔细胞培养板,为杂交瘤细胞提供基本的生长条件。 将SP2/0和脾细胞按1∶ 5的数量比混合后,逐滴加入1 mL 50%的PEG进行细胞融合,融合后以约105个/孔加入细胞培养板中,置于细胞培养箱中培养观察待处理。用1×HAT培养基进行杂交瘤细胞的筛选,待细胞长至70%~80%孔底后,用间接ELISA法对细胞上清液测定融合效果,选取显色后OD450数值高的孔稀释后进行亚克隆。亚克隆过程中改用1×HT培养基进一步筛选杂交瘤细胞,进行两次以上亚克隆,直至细胞能稳定分泌特异性强的抗体。④腹水抗体的制备及纯化:采用动物体内诱生腹水法[10],选用健康雌性小鼠腹腔注射液体石蜡。1周后,将扩大培养的生长状态好的杂交瘤细胞用无菌PBS重悬后,对小鼠进行腹腔注射。待腹部膨大后,抽取腹水离心取上清,-20 ℃保存待纯化。腹水先用饱和硫酸铵粗提沉淀并透析3次以上,然后用Protien G柱亲和层析纯化,最后将纯化后的抗体用SDS-PAGE进行纯度分析[11]。
1.2.3 单克隆抗体的特性分析 ①单抗的效价测定:分别对小鼠腹水、纯化后的单克隆抗体倍比稀释后采用间接ELISA法,每个梯度做2个平行,以阳性对照的OD450/阴性对照的OD450大于或等于2.1的最大稀释比例为该抗体的效价测定值。②单抗的亚型鉴定: 单抗的亚型鉴定按照抗体亚型测定试剂盒说明书进行,方法同间接 ELISA法,其中的酶标二抗换为所购试剂盒中抗体,测定纯化后抗体的亚型类型有IgA、IgG1、IgG2a、IgG2b、IgG3、IgM。③单抗的特异性鉴定: 采用间接ELISA法,测定抗体与其他4株RS及实验室现有其他玉米、水稻、水果等农产品致病菌株的结合情况。
2 结果与分析
2.1 菌株鉴定
以引物(RS-16S-F:TGTCCGGAAAGAAATCGCAC,RS-16S-R:CAGCACCTGTGTCCACTTTC)对5株茄科劳尔氏菌进行PCR扩增后,琼脂糖凝胶电泳实验理论扩增片段大小应为616 bp。鉴定结果如图1所示,5种RS在616 bp处均出现明显电泳条带,与设计的理论扩增片段大小保持一致,说明实验选用的免疫菌株是RS。

图1 5种茄科劳尔氏菌的PCR鉴定结果Fig.1 PCR identification of RS
2.2 单克隆抗体的制备及特性鉴定
2.2.1 小鼠血清效价 小鼠第4次免疫后断尾取血分别倍比稀释1 000、2 000、4 000、8 000、16 000、32 000、64 000、128 000、256 000、512 000、1 024 000、2 048 000倍,健康小鼠血清作为阴性对照,结果为0.084 09,阳性结果如表1所示。对所测数据进行处理分析后知,1、3号小鼠血清效价均是1∶512 000,2、4号小鼠血清效价均为1∶1 024 000,选择4号小鼠冲击免疫后做细胞融合实验。

表1 小鼠血清效价
2.2.2 细胞融合及杂交瘤细胞的筛选 对融合的细胞进行筛选并进一步亚克隆,最终得到3株可稳定分泌抗GIM1.76菌株的单克隆抗体(1C1B1C2E4、1B3C2G7C12、9D7C5E10F11)的杂交瘤细胞株,缩记为1C1、1B3、9D7。
2.2.3 小鼠腹水效价 采用间接ELISA法测定1C1、1B3、9D7的腹水抗体效价[12],阴性对照OD450为0.0618,阳性数据如图2所示。分析处理数据可知,1C1、1B3、9D7的腹水效价分别是1∶1 024 000、1∶64 000、1∶256 000。
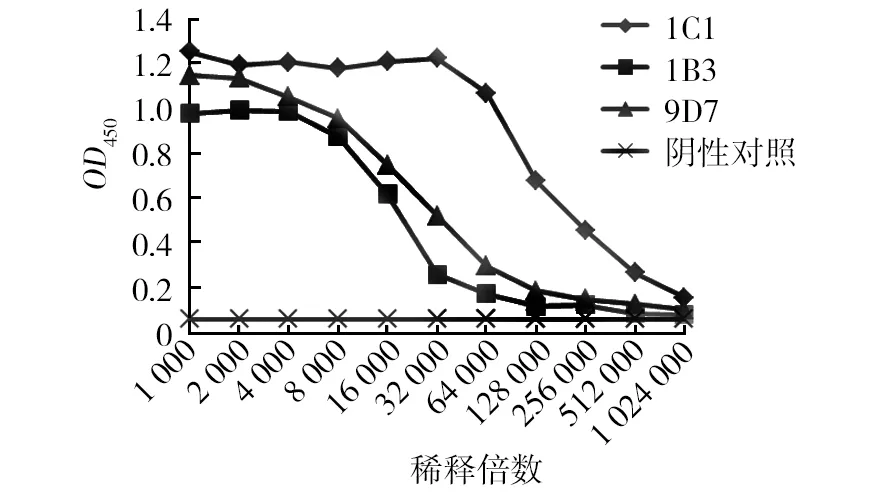
图2 小鼠腹水的效价Fig.2 Titers of mice ascites
2.2.4 单克隆抗体的纯化及纯度分析 小鼠腹水纯化后采用SDS-PAGE进行纯度鉴定,结果如图3所示,所得3株单抗均无明显杂蛋白,只有清晰的2条约50 kD的重链条带和26 kD的轻链条带,表明纯化效果较显著。
2.2.5 纯化后单克隆抗体的效价 测定纯化后抗体的效价,阴性对照OD450为0.060 3,阳性数值如图4所示。分析可知,纯化后1C1(3.651 mg/mL)、1B3(7.147 mg/mL)、9D7(2.560 mg/mL)的抗体效价分别为1∶32 000、1∶128 000、1∶64 000,抗体蛋白浓度折合成2 mg/mL后,1C1、1B3、9D7对应抗体效价大约为1∶17 529、1∶35 819、1∶50 000。
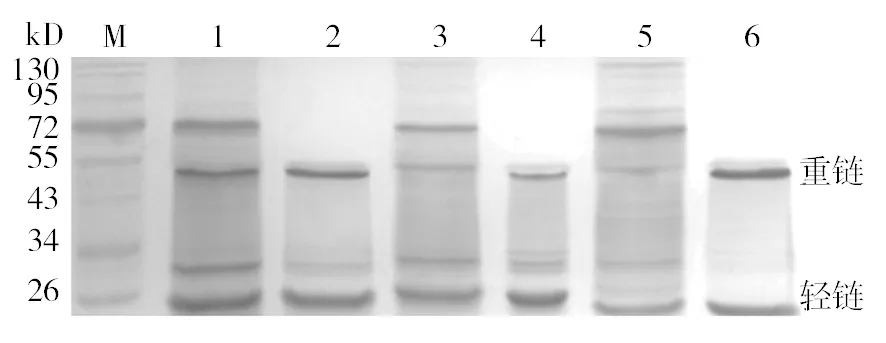
图3 单克隆抗体SDS-PAGE结果Fig.3 SDS-PAGE result of mice ascites and purified antibodiesM: 蛋白Marker;1:1C1纯化前;2:1C1纯化后;3:1B3纯化前;4:1B3纯化后;5:9D7纯化前;6:9D7纯化后M: Protein markers; 1: Pre-purified antibody-1C1;2: Post-purified antibody-1C1; 3: Pre-purified antibody-1B1;4: Post-purified antibody-1B1; 5: Pre-purified antibody-9D7; 6: Post-purified antibody-9D7
2.2.6 3株单克隆抗体的亚型鉴定 抗体亚型试剂盒测定结果如表2所示,数据表明3株抗体亚型均为IgG1。
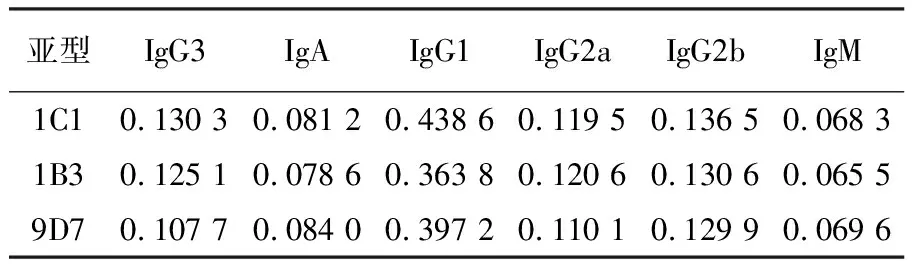
表2 抗体亚型测定结果
2.2.7 单克隆抗体的特异性鉴定 利用间接 ELISA法检测3株单克隆抗体对5种RS结合情况如表3所示,1C1和9D7均不能与RS-5结合,1B3不能结合1.74和 RS-5。此外,检测结果还表明3株单克隆抗体与本实验室现有14株其他玉米、水稻、水果等农产品致病菌株均无交叉情况。

表3 抗体的特异性分析
注:“+”表示能结合,“-”表示不能结合
3 讨 论
由于免疫分析技术是以抗原抗体的特异性结合为基础的,因而制备性能良好的单克隆抗体或者多克隆抗体是免疫分析技术应用于RS检测的关键。然而,已有研究表明,RS多克隆抗体缺乏足够的特异性。1988年,Griep等[13]从不同区域收集了与RS分类上相关的细菌和多种腐生细菌,结果发现制备的多抗与其多种菌株都存在交叉反应。2016年,白利叶等[14]利用对桑树有致病性的 RS菌株G12-50在胞内合成后 分泌并吸附在细胞壁周围的重要毒力因子-内切葡聚糖酶(EGL)制备多克隆抗体,使桑园对青枯菌的检测更加方便快速、实用,但此抗体只针对桑青枯病菌。
由于RS具有遗传多样性,且具有多种生化型,现在的单克隆抗体不能有效的选择区别这些RS菌株。早在1986年,蔡少华等[15]用从番茄、马铃薯、姜、油橄榄、甘薯、花生和桑树上分离的代表3个生理小种的9个RS菌株为抗原,分别以其全菌和胞壁糖蛋白提取物免疫小鼠,获得两类杂交瘤细胞系,但其分泌抗体特异性并不明确。1991年,谢云陆等[16]利用使生姜染病的 RS制备单克隆抗体和多克隆抗体并建立免疫荧光技术(IF)和 ELISA检测由RS引起的姜瘟病,该方法漏检率较高。1992年,谢云陆等[17]又利用使马铃薯染病的RS制备单克隆抗体并应用IF检测了RS在马铃薯种薯上的潜伏,灵敏度高达2×103~2×104cfu/mL,然而此抗体只针对使马铃薯致病的RS菌株。以上这些研究制备的单克隆抗体由于年代久远,RS的种内变异丰富,或者对可检RS覆盖面不全,又或者可检RS株不明,使得应用性能差。因此本研究致力于制备针对多种RS生理小种菌株特异性强的单克隆抗体。
近年来多种单抗制备技术如免疫蛋白制备抗体[18-19]、蛋白嵌合抗体制备[20]、转基因技术制备抗体[21]等已被开发应用,但由于这些技术尚未发展成熟,而且传统的单克隆抗体制备技术较成熟、操作简单,采用全菌免疫可以得到稳定性高的特异性抗体,因此,本研究仍然选用传统的单克隆抗体制备技术,先是用GIM1.76以0.3%甲醛灭活后免疫4只小鼠,4次免疫后小鼠血清测效价结果分别为1∶32 000、1∶8 000、1∶4 000和1∶4 000,可能是灭活的植物菌在小鼠体内很快被清除,不能引起持续的免疫刺激,导致整体免疫效果较差。于是重新选择4只生长状态良好的小鼠免疫GIM1.76活菌,4次免疫后小鼠血清效价分别为1∶512 000、1∶512 000、1∶1 024 000和1∶1 024 000,表明活菌可以引起小鼠较强的免疫反应。细胞融合并经多次筛选后,获得3株单克隆抗体,其中1C1和9D7能够和实验室现有的4株RS特异性结合,1B3能够与其中3株RS结合。3株抗体均与本实验室桑肠杆菌 JX-6、苏云金芽胞杆菌 SYJ及实验室现有11株燕麦嗜酸菌卡特莱兰亚种、燕麦嗜酸菌西瓜亚种、嗜酸菌魔芋亚种、玉米细菌性条斑菌,梨火疫病菌 QB0809、XL-4,玉米细菌性枯萎病菌 QB0241、 QB0242,水稻细菌性谷枯病菌 QB0017、QB0753、 QB0755均不产生交叉反应。这项研究对建立青枯病菌的检测方法意义重大,为后期开发青枯病菌检测试剂盒或试纸条提供了前提条件,也可应用于开发青枯病菌免疫学检测的其他相关技术,为番茄、茄子、生姜、马铃薯等众多农产品青枯病的有效防治提供参考。
