婴幼儿乳糖不耐受研究进展
2019-03-18李洋洋刘捷曾超美
李洋洋 刘捷 曾超美
乳糖(lactose)是人类和哺乳动物乳汁中特有的碳水化合物,是由葡萄糖和半乳糖组成的双糖。在婴幼儿生长发育过程中,乳糖不仅可以提供能量,还参与大脑的发育进程。人们摄入乳糖后需要乳糖酶(lactase)将其分解成单糖后才可以被吸收。如果因各种原因导致摄入的乳糖不能或不能完全被分解吸收而产生的消化道症状称之为乳糖不耐受(lactose intolerance,LI)。其关键是乳糖酶的相对或绝对缺乏。LI在中国婴幼儿中发病率极高,可达46.9%~70.0%,其最常见的症状为腹泻,如若不引起重视可导致慢性腹泻、营养不良、贫血、骨质疏松等长期危害。故本文就LI的发病机制、临床分型、诊断方法及治疗进展进行综述。
一、LI的发病机制
1. 乳糖的消化吸收:乳糖是以单体分子形式存在于乳中的唯一双糖,由葡萄糖和半乳糖通过1,4-糖苷键连接而成,经乳腺内乳糖合成酶作用产生。以人乳中含量最为丰富,约为7.2 g/100 ml,牛乳中的含量为4.7 g/100 ml。乳糖主要在空回肠消化吸收,通过小肠上皮细胞刷状缘分泌的乳糖酶将其水解为葡萄糖和半乳糖,后通过细胞的主动转运而吸收。葡萄糖主要为机体提供能量,而半乳糖以糖苷键结合于神经酰胺上,形成半乳糖脑苷脂,从而参与大脑的发育。婴儿期是神经发育的关键期,因此,乳糖对婴儿期的神经系统的发育至关重要。
2. 乳糖酶的发育及遗传特点:乳糖酶又称β-半乳糖苷酶,是由小肠上皮细胞刷状缘分泌,其活性从十二指肠近端段向远端段逐渐增加,在空肠或近段回肠达高峰,末段回肠乳糖酶活性较低。乳糖酶的编码基因lactasegene(LCT) 位于2号染色体长臂上(2q21-22),长度约50 kb。胎龄8周时,小肠上皮细胞内乳糖酶已经开始表达,胎龄12周起就可在肠道中检测到乳糖酶,从胎龄34周起直至足月,乳糖酶的表达逐渐到达高峰,足月儿乳糖酶发育基本成熟,而后从生后数月开始乳糖酶的活性逐渐下降。在澳大利亚土著居民中,生后6个月到1岁,尽管有些婴儿尚未断奶,但可继发乳糖的消化能力下降。然而,在某些人群如北欧,尤其是瑞典和丹麦(>90%),乳糖酶活性持久表达而不下降。现已明确,乳糖酶活性的差异是由遗传多态性引起的,是由对LCT具有顺式作用的多态元件控制。由于乳糖酶活性的不同,人群中存在三种基因型[1],即纯合乳糖酶持续性(homozygous lactase persistent,LP)、纯合乳糖酶非持续性(homozygous lactase non-persistent,LNP)和杂合子(heterozygotes)(见表1)。LNP是人群中最常见的表型,约占65%~70%[2]。LP的遗传特性是由LCT上游增强子区域中的等位基因的变异造成的,多种不同的功能等位基因逐渐被发现,在不同的人群中表现出显著的多样性。表1中列举的C/T 13910的突变基因位于LCT基因上游的14 kb,早在2002年已被阐述[3]。LP表型仅在长期使用牛奶和奶制品的人群中常见,是强烈定向选择的结果,在亚洲国家中少见。LNP是中国最常见的表型,几乎占100%。现已明确,乳糖酶的活性在足月新生儿中是高的,之后由于基因的多态性使信使RNA的高表达或低表达,从而导致了乳糖酶活性的持续性或非持续性[4]。
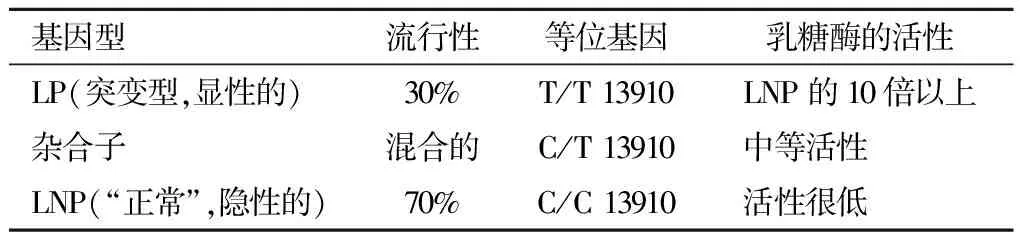
表1 导致乳糖酶活性的不同基因型
3. LI的发病机制及临床表现:乳糖酶与其他双糖酶相比,成熟最晚、含量最低、最易受损、修复最慢。乳糖摄入后,在乳糖消化吸收的任一环节出现问题,均可导致肠腔内乳糖浓度的异常升高。过高的乳糖浓度使肠腔内渗透压升高,从而导致渗透性腹泻。同时,未消化的乳糖进入结肠段,肠道内菌群会将乳糖分解为乳酸等有机酸,进一步提高肠腔渗透压,并释放氢气、甲烷等气体,刺激肠道蠕动,加重腹泻,并且出现腹胀、腹痛等临床症状。而释放的氢气一部分弥散进入血循环,通过呼吸运动由肺排出,这也成为乳糖氢呼气实验的临床基础。
乳糖酶缺乏时并不一定都出现临床症状。乳糖酶的活性与多种因素有关,一般不会完全消失,有的患儿由于乳糖摄入量少等原因没有出现临床症状,称为乳糖吸收不良(Lactose malabsorption)。而LI主要指因乳糖酶缺乏导致乳糖吸收障碍而出现腹泻、腹胀、呕吐、腹痛等临床症状。Levitt等[5]将LI定义为摄入12 g乳糖负荷后出现临床症状而摄入等量安慰剂不出现症状。其特点是在摄入乳糖后出现消化道症状,且症状的严重程度与摄入乳糖的量有关。婴儿LI的临床表现以腹泻为主,呈黄或青绿色、蛋花汤样或稀糊状含气样便,有酸臭味,腹泻次数多少不等,多者可达数十次,重症者甚至出现粘液血便及小肠坏死。而另一方面,急性或慢性腹泻导致肠黏膜受损后亦可引起乳糖酶生成减少,可继发LI,进一步加重症状。另外,因为乳糖在肠道内经过发酵生成的乳酸可协助人体对铁、钙、锌等微量元素的吸收,长期LI患儿会演变成迁延性或慢性腹泻,因而可以限制正常的生长发育,造成营养不良、贫血、骨质疏松等后果。
母乳中乳糖含量明显高于牛乳,故母乳喂养儿常常会发生腹泻,之前被诊断为生理性腹泻。临床上发现这些婴儿在换用免乳糖奶粉后腹泻会明显好转。因此,有学者认为生理性腹泻可以归因于LI,但仍需科学设计的大样本临床试验证实。
二、LI的临床分型
1.发育性乳糖酶缺乏(developmental lactase deficiency):又称为相对乳糖酶缺乏症,此型主要见于胎龄小于34周的早产儿。因为34周以下早产儿乳糖酶发育尚未成熟,所以早产儿对乳糖的耐受性相对较差。早在20世纪90年代,Shulman等[6]就提出乳糖酶活性增加是肠道成熟的标志,而早期喂养可能促进早产儿乳糖酶活性增加[7]。乳糖酶的活性可能与多种因素相关,如胎龄、出生体重、喂养方式和开奶时间等,但具体调控机制不详[8]。
2.先天性乳糖酶缺乏(congenital lactase deficiency):此型患儿较为罕见,文献报道的病例很少,是LI较严重的类型,多为常染色体隐形遗传,典型的特点是出生时乳糖酶活性低下或缺乏,而其他双糖酶和小肠上皮细胞的组织学结构是正常的[9-10]。该类型患儿生后早期即可发病,吃奶后明显,可出现水样腹泻、腹胀、营养不良等,可在早期出现脱水、电解质紊乱甚至危及生命,仅能通过无乳糖奶粉喂养改善症状。
3.原发性乳糖酶缺乏(primary lactase deficiency):也称为成人型低乳糖酶症(adult-type hypolactasia biopsy)。该型患儿出生时大多乳糖酶正常,随着年龄的增长,乳糖酶活性逐渐下降,成年时乳糖酶活性降至出生时的5%~10%。此种类型是LI及乳糖吸收不良的最常见原因。但全世界不同种族人群发病率不同,亚种人发病率接近100%,白种人发病率最低,约为2%~15%[11]。但并不是所有的原发性乳糖酶缺乏者均会出现临床症状。因为婴幼儿以含乳糖较多的母乳或牛乳为主食,所以该年龄段的临床症状较明显。较大儿童及成人不是以乳糖为主要饮食,故摄入少量乳糖尚不至于引发临床症状。
4.继发性乳糖酶缺乏(secondary lactase deficiency):所有可以使小肠粘膜上皮细胞受损的疾病均可以继发乳糖酶的缺乏,从而引起LI的症状,如感染性腹泻、窒息缺氧、克罗恩病、胃肠手术等。轮状病毒肠炎也常继发乳糖酶缺乏,随着疾病的恢复,损伤的小肠粘膜上皮细胞也逐渐恢复,乳糖酶活性可逐渐提高。
三、LI常用的诊断方法
目前,国内还没有把乳糖酶缺乏的实验室诊断作为必要的诊断依据,国内仅有少数医院通过检测大便乳糖及大便 pH 值来诊断乳糖酶缺乏。临床上多以诊断性去乳糖治疗或添加乳糖酶等试验性诊断治疗方法来观察症状是否好转来考虑或排除LI。常用的诊断方法有如下几种。
1. 乳糖耐量实验:乳糖被乳糖酶分解产生半乳糖和葡萄糖,乳糖耐受者血糖会出现明显的峰值,若乳糖酶缺乏不能分解乳糖产生葡萄糖,则血清葡萄糖水平呈现平滑曲线。该方法需要服用负荷量的乳糖(成人50 g,儿童1~2 g/kg),分别在-5 min,0 min,15 min,30 min,45 min和60 min后测定血浆葡萄糖浓度,如果血糖上升幅度大于1.4 mmol/L提示乳糖耐受,反之则考虑乳糖吸收不良[12]。该方法可以受到胃排空、葡萄糖代谢情况、肠蠕动等相关因素的影响。一项Meta分析显示,该实验的灵敏度为0.94(95%CI:0.9~0.97),特异度为0.90(95%CI:0.84~0.95)[13]。因目前临床上末梢血糖监测手段较为普遍,因此该方法用于婴幼儿甚至新生儿的LI检测较为方便。但是早产儿对LI情况较为严重时不建议应用该方法。
2. 大便还原糖及pH值测定:未消化的乳糖进入结肠后,肠道内菌群会将乳糖分解为乳酸、脂肪酸等有机酸,使大便呈酸性,因此测定大便中还原糖及pH值可用来判断乳糖分解的程度。可以用醋酸铅氢氧化铵法或者改良班氏试剂法来定性测定大便还原糖,一般认定还原糖(++)即为阳性。大便pH值<5.5为LI的证据。该方法简便、操作性强,缺点是留取大便时需要新鲜标本,稀便时液态大便不能渗漏至尿布上,婴幼儿留取标本较困难,且还原糖的测定读取结果判断颜色时有主观因素的存在。该方法可用于人群的普筛,也可用于早产儿LI的检测。
3. 尿半乳糖的测定:乳糖在小肠中被分解为葡萄糖和半乳糖,半乳糖经小肠上皮细胞吸收后大部分经肝脏转化为葡萄糖或者合成半乳糖苷参与脑苷脂的形成,小部分经尿液排出体外。测定尿中半乳糖含量是LI、遗传性肝病、半乳糖血症等代谢性疾病的常用方法之一[14]。该实验先让患儿排空膀胱,然后在负荷量乳糖后测定尿半乳糖含量。该方法的灵敏度和特异度较高,且具有无创、方便等优势,可用于婴幼儿甚至新生儿LI的诊断。
4. 乳糖氢呼气实验:体内未消化的乳糖可被分解产生氢气,由肺部排出,而正常情况下人体并不产生氢气,故而可以测定呼出氢气的水平而间接判定乳糖吸收的情况。测定基础氢气值后摄入负荷量乳糖,3 h内测定呼气中氢气浓度,与基础值比较升高>0.02 mmol/L(20 ppm)即为阳性,表示存在乳糖酶缺乏。该方法是成人诊断LI的最常用方法。但是,当小肠细菌过度生长时,易出现假阳性;当结肠存在不产气的细菌时,可以出现假阴性结果[15]。Ruzsanyi等[16]对32个患儿进行前瞻性研究发现有12个患儿氢呼气实验阳性,而仅有5人有LI的症状,这5人中仅有3人乳糖耐量实验阳性,4人有LI的症状但是氢呼气实验阴性,提示该实验可能有较高的假阳性率和假阴性率。此方法简便、易操作,且无创,但是需要呼吸运动的配合,婴幼儿因为哭闹、过度换气等原因难以配合,故不适用于小婴儿。
5. 血半乳糖测定:空腹进食负荷量乳糖(儿童2 g/kg,成年人50 g)后测定血半乳糖浓度,如果服乳糖后40 min血半乳糖浓度<0.3 mmol/L则提示乳糖吸收不良。
6. 基因检测:多用于遗传学研究,未在临床广泛推广。
7. 小肠活检乳糖或乳糖酶测定:该方法为侵入性检查,对婴幼儿来说操作不易,且家长难以接受,临床应用较少。
四、LI的治疗手段
LI的治疗与其临床分型密切相关,对于先天性乳糖酶缺乏应终身禁食乳糖,而继发性乳糖酶缺乏者以治疗原发病为主。不是所有的LI患儿均需要治疗,若患儿消化道症状不严重,也不影响生长发育,一般不需要特殊治疗。但如症状严重,如腹泻次数较多(4 次/日)、体重增加缓慢的新生儿和婴幼儿,需采取相应治疗措施。
1.饮食回避:主要包括低乳糖或去乳糖配方奶喂养,需要根据症状轻重来选择哪一种喂养方式。去乳糖配方奶系优质牛乳蛋白配方,不含乳糖,用麦芽糖糊精或玉米淀粉等碳水化合物代替乳糖,同时蛋白质、脂肪、维生素、微量元素等配方奶粉的成分仍保留。对于先天性乳糖酶缺乏患儿需长期应用去乳糖奶粉喂养;对于原发性乳糖酶缺乏者,因其临床症状与进食乳糖的量密切相关,如有严重症状可先应用去乳糖奶粉喂养,待症状缓解后可选用低乳糖配方奶喂养,之后可逐渐增加摄入乳糖量或少量多次以增加乳糖耐受性。
2. 添加乳糖酶:去乳糖配方奶喂养对缓解LI有较好的效果,但因乳糖可以参与神经系统发育、微量元素如钙、铁、锌的吸收等过程,因而一般来说无乳糖饮食2周后要逐渐过渡到低乳糖饮食直至患儿耐受。应用乳糖酶制剂治疗LI理论上可以克服无乳糖饮食的缺点,它可以使患儿,尤其对于发育性乳糖酶缺乏的早产儿,无需改变原有饮食结构,保证婴幼儿继续从母乳中获得抗体等有益成分,增强患儿免疫力,缩短病程,促进病情恢复。有文献报道每天服用1 500 u的乳糖酶可改善胃肠道症状、使呼气实验中氢气的水平降低,然而仍然需要相关研究证实[17]。Erasmus等[18]给早产儿以早产儿配方奶粉喂养的同时添加乳糖酶,结果发现早产儿体重增长和血清白蛋白水平高于对照组,但对身长、头围、耐受性、新生儿坏死性小肠结肠炎(NEC)发生没有影响。给LI的婴幼儿补充乳糖酶在国外早已开始应用,现如今国内一些医院也开始应用乳糖酶治疗LI的婴幼儿,在喂奶同时给予乳糖酶,取得了较好的治疗效果。但是乳糖酶价格相对昂贵,这也是在国内没有普遍应用的原因之一。
目前已经投放市场的乳糖酶产品,一种是克鲁维酵母制备的乳糖酶,另一种是黑曲霉制备的真菌乳糖酶。克鲁维酵母菌的乳糖酶的最适pH值为6.0~7.0;来源于黑曲霉乳糖酶的最适pH为3.5~4.0。酵母乳糖酶作用温度在35℃左右,霉菌最适作用温度一般在50℃以上,最高可达60℃。目前商业用酶源一般认为酵母(如乳酸克鲁维酵母、脆壁克鲁维酵母)最为安全。由于受乳糖酶最适pH的限制,单纯进食乳糖酶易被胃酸破坏而影响疗效,最好同时进食乳糖酶和奶粉或母乳,因此对于母乳喂养儿的家长来说最好先将母乳挤出,加用乳糖酶后再喂到婴儿口中,这一过程需注意避免污染。
3. 益生菌:益生菌进入人体后,在肠道中分泌β-半乳糖苷酶,改善机体对乳糖的代谢吸收;使胃排空速度和肠转运时间减慢,延长小肠内残存乳糖酶消化乳糖的时间,促进乳糖分解吸收;也可加强结肠酵解作用,以此改善LI的临床表现。益生菌主要包括乳酸菌(如乳酸杆菌、双歧杆菌)以及其它如链球菌、肠球菌、拟杆菌中的某些菌株。近年来国内外多项研究均表明,益生菌可缓解LI的症状[19-20]。目前应用最多的益生菌主要有双歧杆菌与乳酸杆菌。
4. 其他:钙与乳糖可形成络合物,当乳糖被消化生成乳酸后,肠道的pH 值就会降低,进而促进钙的吸收。同样有机酸与锌结合可促进锌的吸收,当婴幼儿体内的乳糖发生不耐受时,锌的吸收就会受到影响。国内有小样本量的研究表明,LI可影响钙、铁、锌的吸收[21]。故可以根据临床表现适量添加铁剂、钙剂、锌剂等,避免长期LI继发的贫血、骨质疏松等表现。
综上所述,LI的发病机制为乳糖酶的相对或绝对缺乏,在中国婴幼儿中较常见,严重的LI可引起较严重的不良后果。然而因其临床症状并无特异性,临床医生需注意与腹泻、腹胀等相关症状进行鉴别,及时有效地做出判断及处理。对于LI的治疗以低/去乳糖喂养或添加乳糖酶为主,可以加用益生菌。基因治疗目前处于实验研究中,相信将来能成为LI症治疗的有效手段。
