双羧型1,8-萘酰亚胺探针与DNA的 键合行为及抗肿瘤作用
2019-03-11娄珀瑜
娄珀瑜, 刘 振, 孙 洋, 冉 鸣
( 1. 西安文理学院 服务地方研究院, 陕西 西安 710065; 2. 西安文理学院 化学工程学院, 陕西 西安 710065;3. 四川师范大学 化学与材料科学学院, 四川 成都 610066)
在癌症作为威胁人类生命健康的主要疾病之一的今天,探讨高效低毒抗肿瘤药物的机制具有非常重要的意义.该领域目前在以DNA作为靶点的抗肿瘤小分子药物研究方面关注颇多[1-2].萘酰亚胺类化合物具有强烈荧光、良好热稳定性及较高量子效率等特征,可用来作为潜在的光敏生物单元以及抗肿瘤剂[3-4].自3-硝基单萘酰亚胺类衍生物被证明能有效嵌入DNA之后[5],已研制出进入临床实验的米托萘胺[6]和氨萘非特[7]等药物,随后研发出的双萘酰亚胺能够提高嵌入剂分子与DNA的亲和力并形成稳定的复合物[8],在此基础上研制出的依利萘法德[9]和双萘法德[10]已处于临床研究阶段.
本研究设计合成了新型1,8-萘酰亚胺衍生物,通过红外光谱、紫外可见吸收光谱、荧光光谱、圆二色谱和热变性实验对合成化合物与小牛胸腺DNA(Ct-DNA)的键合行为进行了研究,同时利用四甲基偶氮唑蓝(MTT)法检验了合成化合物对Bel-7402、HL-60、A549以及Hela等4种细胞的体外抗肿瘤活性.此工作为研究嵌入单元与链接基之间的特异性提供了实验和理论依据,同时也为其他化合物链接基的分子设计奠定一定的基础.
1 实验部分
1.1主要试剂4-溴-1,8-萘酐、四氢糠醇、CTAB(溴化十六烷基三甲胺)、乙二胺、丙二胺、丁二胺、戊二胺、己二胺、甲醇、无水乙醇等均购自上海阿拉丁试剂有限公司;小牛胸腺DNA(染发剂质量分数90%)购自Sigma试剂公司;DNA的PBS标准溶液(ρ=10.0 mg/mL,pH值7.4)自制;实验用水为二次去离子水.
1.2主要仪器IS50傅里叶变换红外光谱(美国热电公司),Q2000差示扫描量热仪(美国TA公司),AVANCF300MHz核磁共振仪(德国布鲁克公司),F-7000荧光光谱仪(日本日立公司),UV-2550PC紫外光分光光度计(日本岛津公司),Chirascan圆二色谱(英国应用光物理公司),ANKETGL-16C离心机(上海安亭科学仪器厂),PHS-3C型精密pH计(上海精密科学仪器有限公司).

图 1 目标产物合成路线
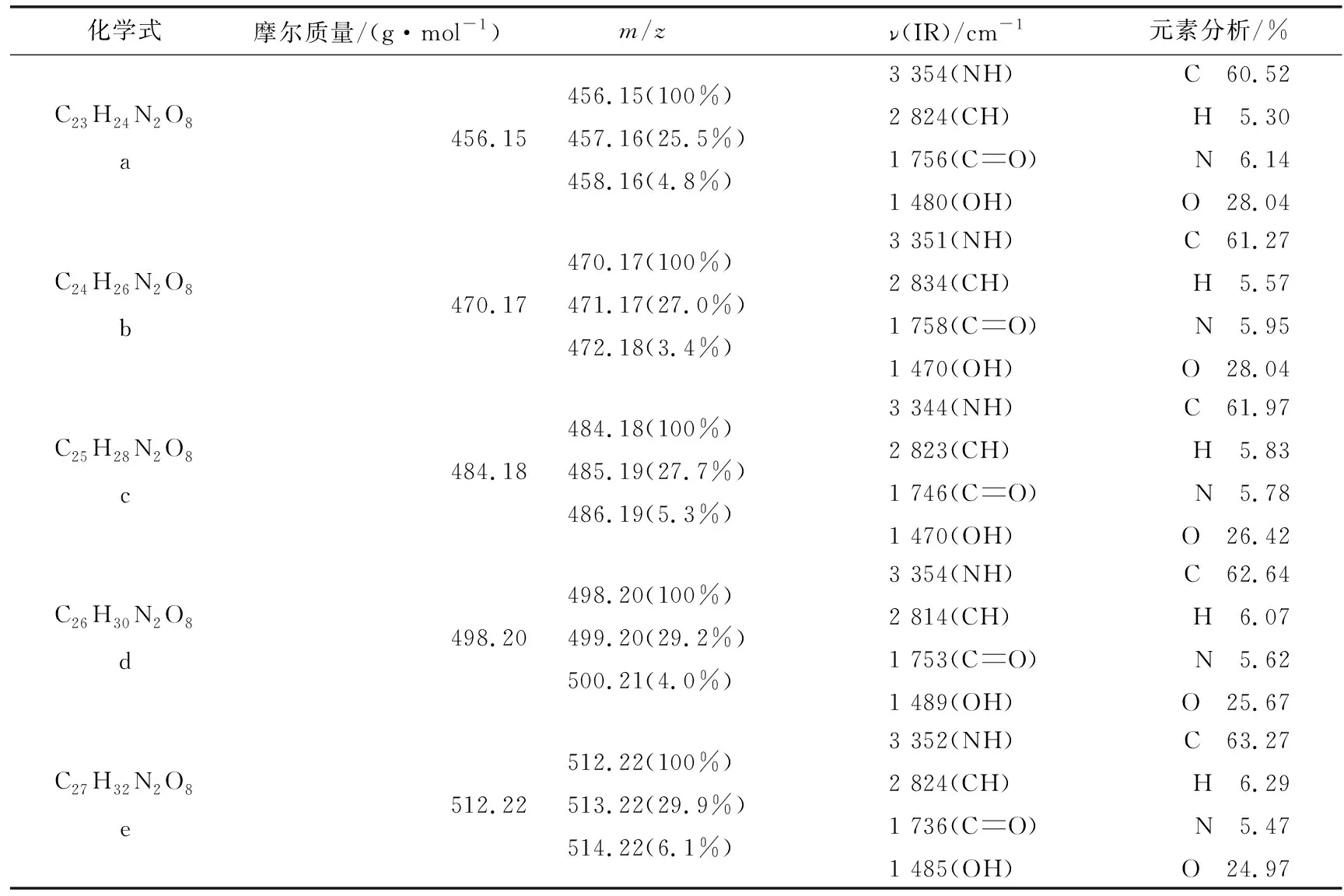
化学式摩尔质量/(g·mol-1) m/zν(IR)/cm-1元素分析/%C23H24N2O8a456.15456.15(100%)457.16(25.5%)458.16(4.8%)3 354(NH)2 824(CH)1 756(CO)1 480(OH)C 60.52H 5.30N 6.14O 28.04C24H26N2O8b470.17470.17(100%)471.17(27.0%)472.18(3.4%)3 351(NH)2 834(CH)1 758(CO)1 470(OH)C 61.27H 5.57N 5.95O 28.04C25H28N2O8c484.18484.18(100%)485.19(27.7%)486.19(5.3%)3 344(NH)2 823(CH)1 746(CO)1 470(OH)C 61.97H 5.83N 5.78O 26.42C26H30N2O8d498.20498.20(100%)499.20(29.2%)500.21(4.0%)3 354(NH)2 814(CH)1 753(CO)1 489(OH)C 62.64H 6.07N 5.62O 25.67C27H32N2O8e512.22512.22(100%)513.22(29.9%)514.22(6.1%)3 352(NH)2 824(CH)1 736(CO)1 485(OH)C 63.27H 6.29N 5.47O 24.97
1.3萘酰亚胺探针的合成如图1,按照文献[11]报道的方法制备中间产物1,其结构经化学和光谱法(1H NMR,IR)表征后与文献报道相一致.接着在圆底烧瓶中加入中间产物1(2 mmol)、四氢糠醇(5 mL)、CTAB(0.13 g)以及二甲基氨基乙醇(10 mL),60 ℃下搅拌加热6 h,以0.5 mol/L的乙醇溶液(溶剂氯仿)萃取得到不同链长的黄色固体2(a~e).最后以二氯甲烷为溶剂,体积分数为10%的乙酸乙酯为流动相进行柱层析,各个探针表征数据如表1.
2 结果与讨论
2.1探针对Ct-DNA红外光谱的影响在Ct-DNA中分别滴加a~e探针,在波长为1 000~5 000 cm-1测其红外光谱,如图2所示.
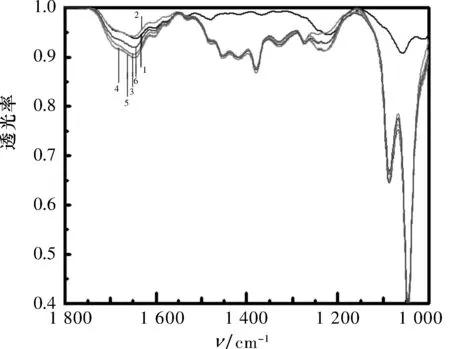
1: DNA; 2: a+DNA; 3: b+DNA;
可以看出,Ct-DNA分别在1 100和1 800 cm-1处因ON振动出现吸收峰,当Ct-DNA加入荧光探针后,在1 100和1 800 cm-1处出现了明显强吸收.此现象可以说明,加入的探针被Ct-DNA包围后,可能在Ct-DNA表面同Ct-DNA结合,也可能嵌插到Ct-DNA内部.由于在1 100 cm-1处吸收强度变化十分明显,故此处探针以嵌插的方式同Ct-DNA结合的可能性较大.此外,随着探针链长增加,吸收强度逐渐减小,说明探针与Ct-DNA的键合作用随探针链长的增加而减弱,这与文献[12]中的报道一致.
2.2探针对Ct-DNA紫外可见吸收光谱的影响在5个5 mL比色管中分别加入2 mL 0.5 mg/mL的Ct-DNA,再分别加入0、10、20、30和40 μL探针溶液,室温放置15 min后,以Ct-DNA溶液为参比,扫描300~500 nm处的紫外吸收光谱如图3所示.
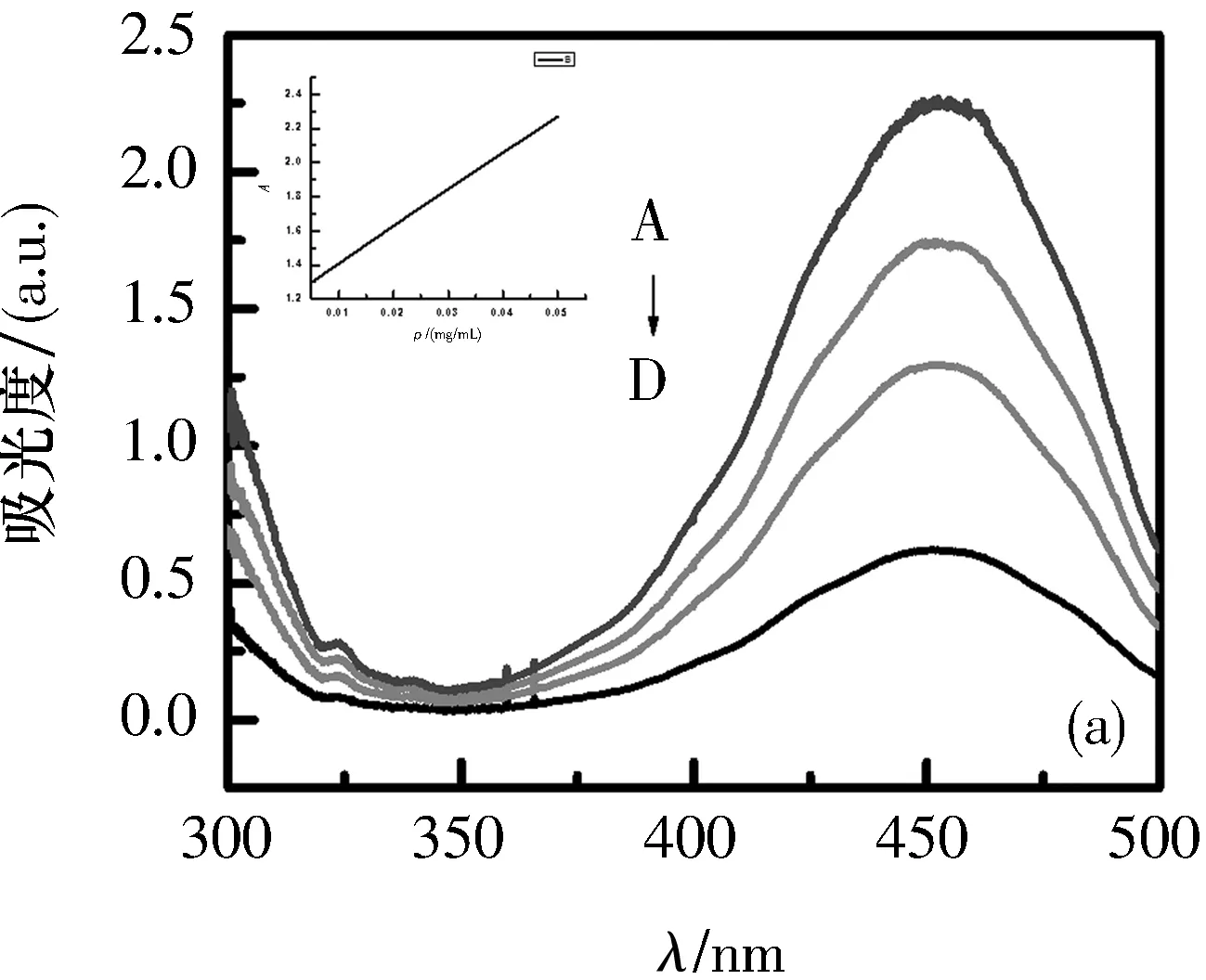

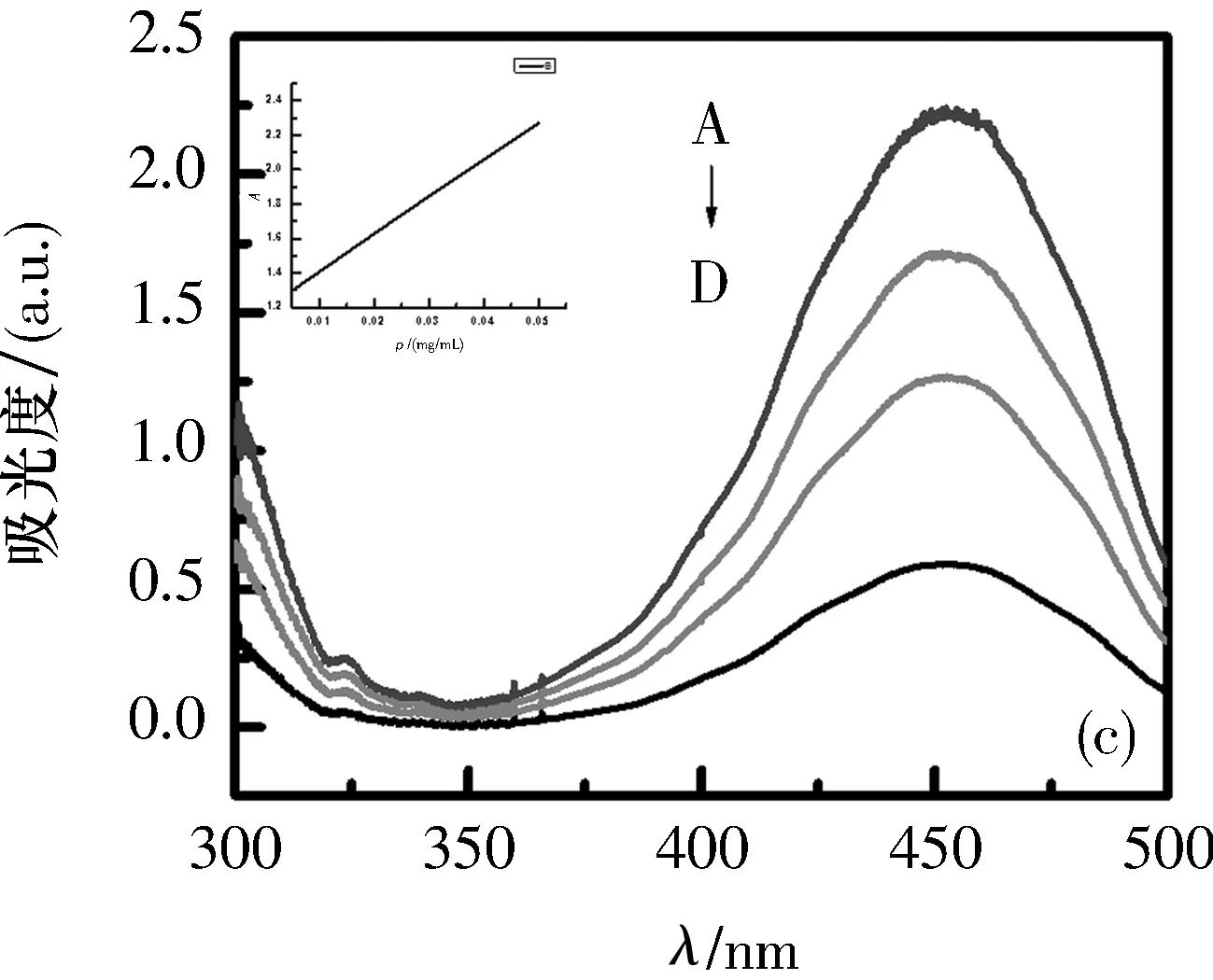

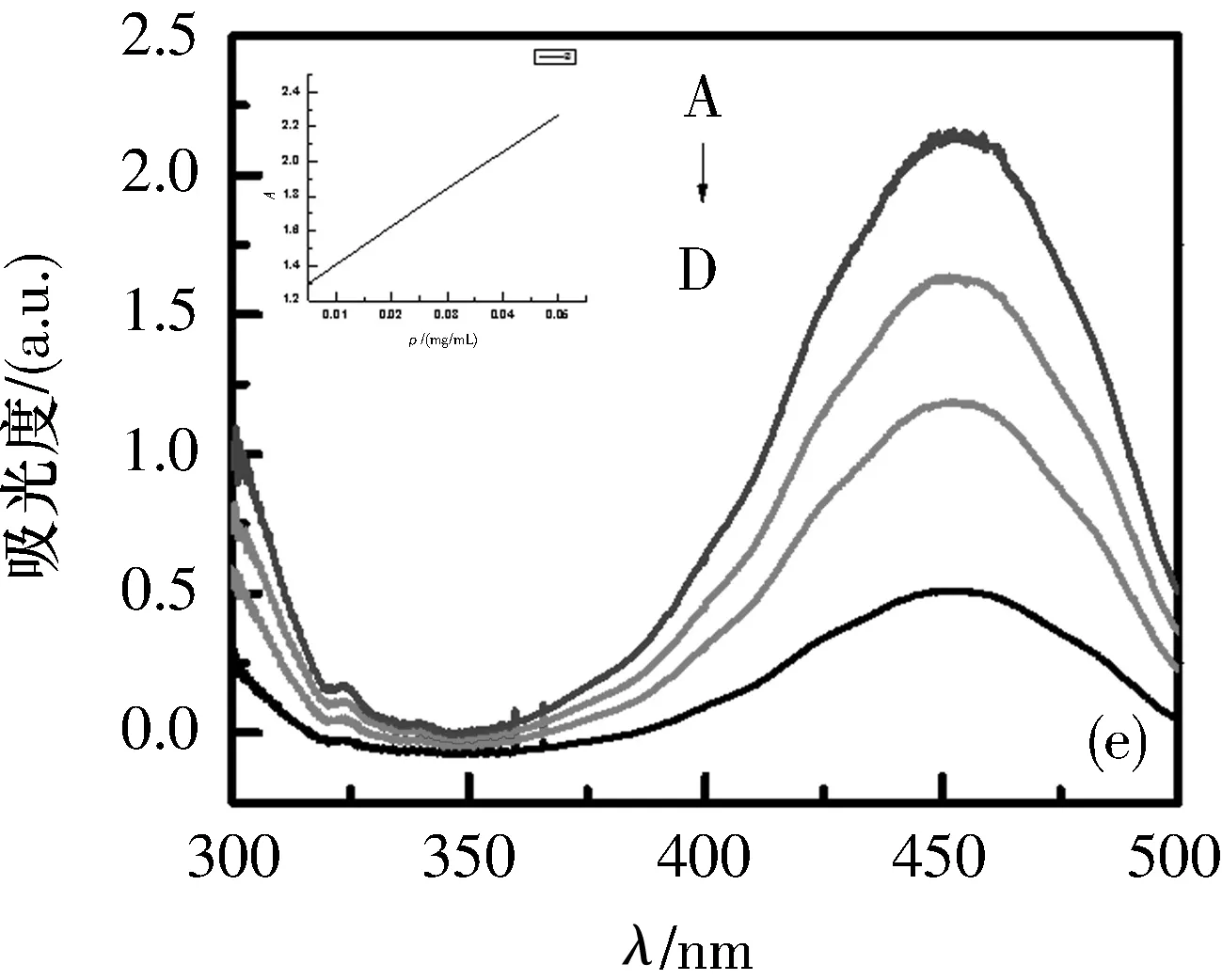
V(DNA)=2 mL; A~D=10、20、100、200 μL
在探针a~e与Ct-DNA的键合紫外可见吸收光谱图中,可以看到在450 nm处出现强吸收峰,这是由于n→π*跃迁而产生.探针a~e的吸收强度随着探针体积的增大而增大,最大吸收峰表现出不太明显的蓝移,这是由探针与Ct-DNA键合后的疏水作用而引起的.图3中随着侧链长度的增长,吸光度的变化不很明显.
实验数据的曲线拟合处理如下式
A=Kc+b,
(1)
其中,A为吸光度,c为探针浓度.
数据处理结果如表2所示,可以得知探针a~e与Ct-DNA的结合常数在0.539 1、0.528 4、0.498 7、0.534 5和0.522 4处.
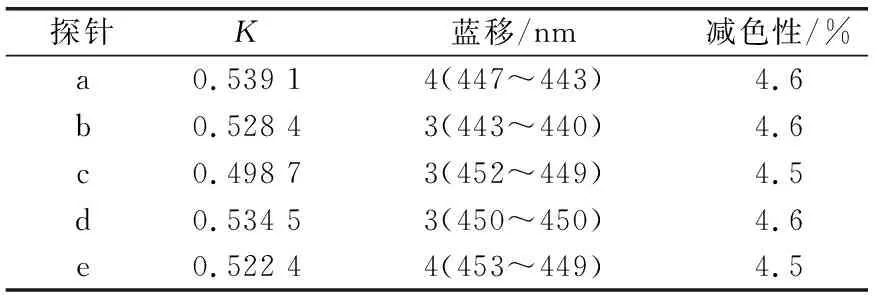
表 2 通过紫外可见吸收光谱研究探针a~e与 Ct-DNA作用的键合常数K与光照性质
根据图3和表2,可以表明探针a~e与Ct-DNA的结合表现出相似的键合型.由此可以猜测,不同侧链长度的探针a~e对Ct-DNA的键合性能有很弱的影响.但是,通过对a~e探针的相对比较,探针a的吸收强度比其他探针稍微大一些.由此可以说明,探针a与其他探针相比能够更好地嵌入到Ct-DNA中.
2.3探针对Ct-DNA荧光发射光谱的影响在5个5 mL比色管中分别加入2 mL 0.5 mg/mL的Ct-DNA,再分别加入0、10、20、30和40 μL的探针溶液.室温放置15 min后,以Ct-DNA溶液为参比,扫描350~650 nm荧光发射光谱,如图4所示.
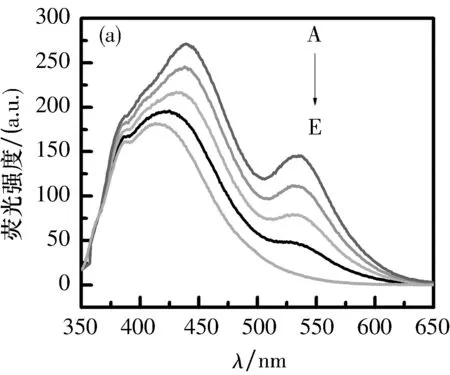
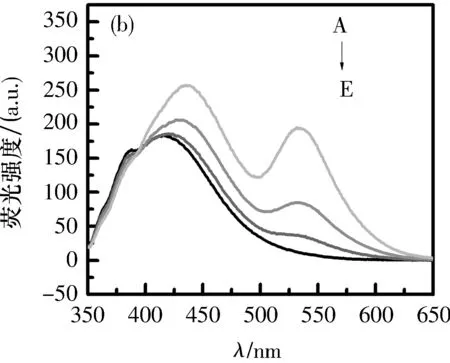

在探针Ct-DNA荧光谱图中,420 nm周围出现高频,这表明随着探针体积增加,亲水作用明显增强,在谱图中明显出现了约10 nm的红移.在图5的(a)、(b)图中产生一组新发射峰,说明探针a、b与Ct-DNA可能发生了嵌入作用,而其他探针可能发生的是表面结合作用.由于探针a比探针b的荧光发射强度大,使得探针a能更好嵌入Ct-DNA中.
探针与Ct-DNA结合激发态分子间碰撞所发生的相互作用过程可以用探针与Ct-DNA作用的动态增强过程来反映,用Stern-Volmer方程[13]描述为
F0/F=1+KSVca,
(2)
其中,F0和F分别为探针与Ct-DNA作用前后的荧光强度,KSV为荧光增强常数,用来衡量探针的增强速率,ca表示探针的浓度.
对于探针与Ct-DNA作用的热力学函数[14-17],利用如下公式进行计算:
ln(K2/K1)=(1/T1-1/T2)ΔH/R,
(3)
ΔG=-RTlnK=ΔH-TΔS,
(4)
其中,R为气体常数,T为温度,K为结合常数.当温度变化不大时,焓变ΔH可以看做是一个常数,结果见表3.
表3中呈现的不同温度下的热力学数据均有△H<0,表明探针与Ct-DNA的结合释放热量.通过文献[18]总结出的生物大分子与小分子结合力类型的热力学规律可知,对于疏水作用力而言,△H>0,△S>0;对于氢键或者范德华力而言,△H<0,△S<0;对于静电作用力而言,△H<0.由于表3的数据均小于0,可知探针与Ct-DNA的结合是焓熵协同驱动过程,且以氢键与静电作用力结合为主.Takenaka等[19]报道药物与Ct-DNA发生嵌插结合的显著特征是氢键作用,也更进一步证明探针与DNA的结合方式是嵌插.

表 3 探针与Ct-DNA不同温度下作用的结合常数及热力学参数
由此推断,探针与Ct-DNA相互作用过程是放热的焓熵协同驱动过程.当探针Ct-DNA相互作用时,探针的双羧基插入DNA的双螺旋结构的碱基对之间,以氢键和静电作用进行相互作用.
2.4探针对Ct-DNA圆二色光谱的影响在5个5 mL比色管中分别加入2 mL 0.5 mg/mL的Ct-DNA,再分别加入0、10、20、100和200 μL的探针溶液.室温放置15 min后,以Ct-DNA溶液为参比,扫描200~300 nm荧光发射光谱,如图5所示.
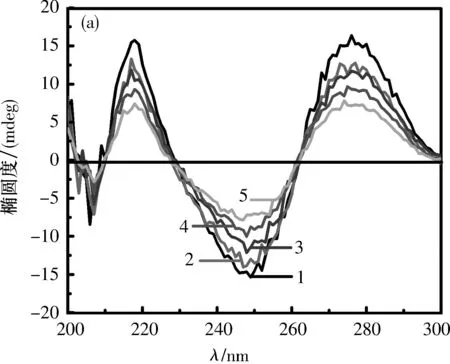


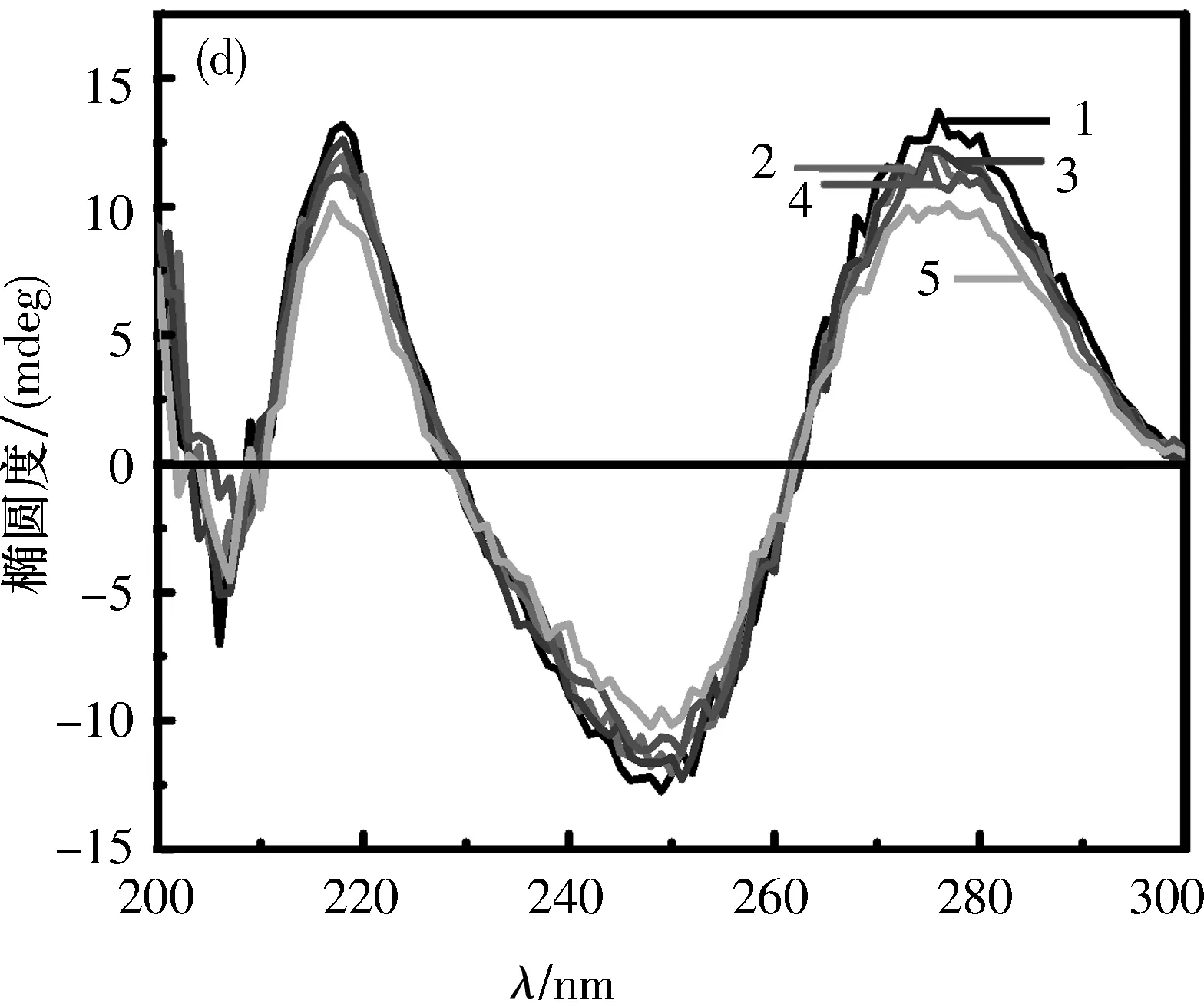

μmol/L
分析结果可见,正峰表示Ct-DNA的碱基堆积程度,负峰表示Ct-DNA的螺旋松散程度[20].Ct-DNA的圆二色谱在276 nm处有一正峰,在243 nm处有一负峰,a~e加入均可引起圆二色谱正峰增强、负峰减弱,表明该类化合物可以嵌入Ct-DNA分子[21].经对比分析可知,随着合成物连接基长度的增加,探针正峰和负峰强度增加和减弱程度呈下降趋势,即e 2.5探针与Ct-DNA作用的热分析在25~120 ℃范围内,以3 ℃/min的升温速率,对所得探针与Ct-DNA进行了热重-差热分析,如图6所示.纯Ct-DNA在36 ℃左右开始放热,在45 ℃左右放热基本结束.当将探针加入Ct-DNA中后,从40 ℃左右开始放热,a~e探针分别在78、70、69和68 ℃放热基本结束.探针a与Ct-DNA放热最多,说明探针a与Ct-DNA的结合更紧密,为嵌插作用.其他探针与Ct-DNA可能进行表面结合作用或沟槽结合作用.此现象表明,探针与Ct-DNA作用随着链长的增加而减弱,其中探针a与Ct-DNA的作用最紧密,这与前面各图谱的结果相符合. 图 6 探针与Ct-DNA作用的DSC曲线 2.6抗肿瘤作用研究利用四甲基偶氮唑蓝(MTT)染色法分别测定了探针a~e对A549、Hela、Bel-7402和HL-60细胞体外抗肿瘤活性.在以顺铂为阳性对照时,由表4的数据可以看出,对A549和Hela细胞株,增长探针侧链,细胞毒性变化很大,但随侧链增长呈下降趋势;对于Bel-7402和HL-60细胞株,探针侧链的增长造成的细胞毒性变化很小,探针活性同时呈下降趋势,其中,乙二胺修饰的A549细胞株的探针a为3.23 μmol/L,优于阳性对照顺铂.因此探针与Ct-DNA分子的键合行为发现探针a对Ct-DNA有较好的抗肿瘤活性. 2.7探针嵌入DNA过程模拟图由于小分子对核酸主要有非共价键结合、共价键结合和剪切作用3种方式,因此通过对图6中各光谱曲线的分析,探针对Ct-DNA的作用可能存在的结合方式如图7所示. 图 7 探针与Ct-DNA可能的结合方式 图7显示表面结合的探针作用于Ct-DNA双螺旋结构的外壁,无选择性;沟槽结合是探针与Ct-DNA的大沟或小沟的碱基对边缘直接作用;嵌插结合是探针中的平面成分嵌入Ct-DNA的碱基之间. 通过缩合取代反应合成新型双羧基型1,8-萘酰亚胺类化合物,并研究了其与Ct-DNA的结合作用及结合模式.光谱研究结果表明探针以嵌插方式与Ct-DNA结合,并且随着烷基链增加,诱发疏水作用增强从而导致嵌插入Ct-DNA的双螺旋结构和碱基堆积力等结合作用减弱.热力学研究结果表明,随着探针烷基链的增加,放热逐渐减少,结合作用减弱,烷基链最短的探针a同时具有较强的肿瘤细胞毒性作用.以上实验结论说明探针a与Ct-DNA的嵌插结合更紧密,其他探针与Ct-DNA可能进行表面或沟槽结合作用. 综上所述,双羧基型1,8-萘酰亚胺类化合物的合成为新型肿瘤抑制剂的开发以及抗肿瘤活性机制研究提供了实验依据和理论基础.
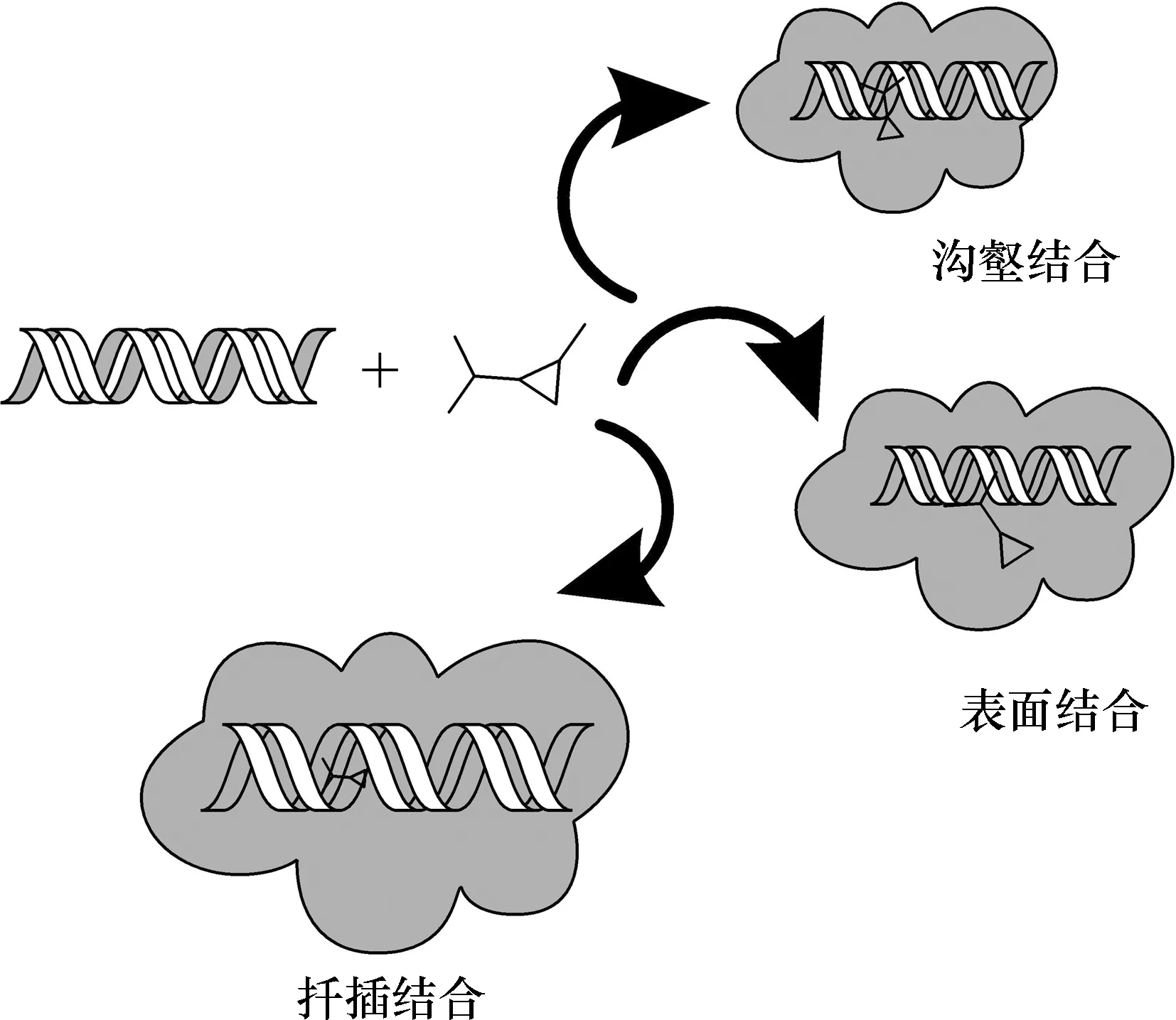
3 结论
