嗜水气单胞菌感染青鱼肝脏的蛋白质组学分析
2019-03-11刘问
刘 问
(湖州师范学院生命科学学院, 浙江省水生生物资源养护与开发技术研究重点实验室, 湖州 313000)
青鱼(Mylopharyngodon piceus)是我国传统淡水养殖的“四大家鱼”之一, 具有生长快、产量高、肉味鲜美等特点, 深受广大消费者的喜爱。据统计,2017年我国养殖青鱼年产量达6.32×108kg, 主产区为江苏、安徽、江西、浙江、湖北等省[1]。随着青鱼养殖业的快速发展, 养殖面积不断扩大, 集约化程度不断提高, 养殖水质易恶化, 在养殖过程中青鱼病害频发, 其中以嗜水气单胞菌(Aeromonas hydrophila)感染引起的病害最为严重, 造成了较大的经济损失[2—6]。嗜水气单胞菌广泛存在于淡水、污水及土壤中, 是淡水养殖鱼类的主要致病菌。在嗜水气单胞菌侵入鱼体后, 先在肠道内增殖, 再经门动脉循环进入肝脏、肾脏及其他组织, 引起肝脏、肾脏等器官以及血液病变, 继而出现全身症状。在我国, 嗜水气单胞菌是危害养殖鱼的种类最多、影响区域最广、流行季节最长、发病率和死亡率高、造成经济损失最严重的细菌性病原[7—13], 对我国水产养殖业构成了严重威胁。
鱼类肝脏具有分泌胆汁、排毒、储存糖元等功能, 是机体维持生理机能最核心的器官之一。在鱼体受嗜水气单胞菌侵染后, 肝脏表现出不同程度的病理变化, 如肿大、充血或失血等, 显微镜检可见血源性色素沉着、肝细胞肿胀、变性、坏死、崩解等症状。目前, 鲜见应用蛋白质组学方法研究嗜水气单胞菌对鱼体肝脏的分子致病机制方面的报道。本研究采用iTRAQ蛋白质组学技术, 通过分析嗜水气单胞菌感染青鱼前后青鱼肝脏组织蛋白表达的变化, 及差异表达蛋白主要参与的生物过程及信号通路等, 探讨嗜水气单胞菌对青鱼的致病机制。
1 材料与方法
1.1 实验动物
健康青鱼购自浙江湖州市某养殖场, 平均体重为186 g, 养殖水温为(26±1)℃ 。
1.2 主要仪器
Easy nLC色谱系统(Thermo Scientific)、Q Exactive质谱仪(Thermo Scientific)、AKTA Purifier 100纯化仪(GE Healthcare)、Multiskcan FC酶标仪(Thermo Scientific)、低温高速离心机(Eppendorf 5430R)、真空离心浓缩仪(Eppendorf Concentrator Plus)、MP Fastprep-24匀浆仪(MP Biomedicals)、超声破碎仪(宁波新芝JY92-II)、Votex振荡器(上海琪特QT-1)。
1.3 青鱼感染试验
采用致病性嗜水气单胞菌菌株BCK0712(由本实验室分离自发病青鱼), 腹腔注射感染健康青鱼,注射剂量为7.60×105cfu/g组织, 每组注射5尾青鱼,对照组注射生理盐水, 实验水温为26℃。在注射24h后, 采集感染组和对照组青鱼肝脏, 分装后-80℃冻存。同时对感染组和对照组的青鱼进行细菌分离和鉴定, 对其是否感染嗜水气单胞菌进行确认。
1.4 蛋白质提取及酶解
取50—100 mg肝脏组织加入1 mL SDT裂解液(4%SDS, 100 mmol/L Tris-HCl, 1 mmol/L DTT,pH7.6), 匀浆后超声破碎, 沸水浴15min, 14000×g离心40min, 取上清。采用BCA法进行蛋白质定量。分装样品, -80℃冻存。
取30 μL蛋白质溶液, 分别加入DTT至终浓度为100 mmol/L, 沸水浴5min, 冷却至室温。加入200 μL UA缓冲液(8 mmol/L尿素, 150 mmol/L Tris-HCl, pH 8.0)混匀, 14000×g离心15min, 弃上清。加入100 μL IAA缓冲液(100 mmol/L IAA于UA), 振荡混匀, 室温避光反应30min, 离心, 弃上清。加入100 μL UA缓冲液, 14000×g离心15min (重复2次)。加入100 μL 25 mmol/L NH4HCO3溶液, 14000×g离心15min (重复2次)。加入40 μL Trypsin溶液(40 μg Trypsin于40 μL 25 mmol/L NH4HCO3溶液), 振荡1min, 37℃放置 16—18h。离心取上清, 测定OD280。
1.5 iTRAQ试剂标记
各样品分别取100 μg肽段, 按照AB SCIEX公司iTRAQ标记试剂盒说明书进行标记。
1.6 强阳离子交换色谱分离
将每组标记后的肽段混合, 采用AKTA Purifier 100进行分级(A液: 10 mmol/L KH2PO4, 25% ACN,pH 3.0; B液: 10 mmol/L KH2PO4, 500 mmol/L KCl,25%ACN, pH 3.0)。进柱后以1 mL /min的速率进行梯度洗脱, 梯度洗脱如下: 0—22min, B液线性梯度从0—8%; 22—47min, B液线性梯度从8%—52%;47—50min, B液线性梯度从52%—100%; 50—58min, B液维持在100%; 58min以后, B液重置为0。洗脱过程中监测214 nm的吸光度值, 将每个组分脱盐并冻干。
1.7 质谱分析
高效液相色谱采用纳升流速的HPLC液相系统Easy nLC进行分离(A液: 0.1%甲酸水溶液;B液: 0.1%甲酸乙腈水溶液, 其中乙腈为84%)。色谱柱以95%的A液平衡, 样品上样到上样柱(Thermo Scientific Acclaim PepMap100, 100 μm×2 cm, nano-Viper C18), 经过分析柱(Thermo scientific EASY column, 75 μm×10 cm, 3 μm, C18-A2)分离, 流速为300 nL/min。梯度洗脱如下: 0—50min, B液线性梯度从0—35%; 50—55min, B液线性梯度从35—100%; 55—60min, B液维持在100%。
质谱鉴定样品经色谱分离后用Q-Exactive质谱仪进行质谱分析。分析时长为60min, 检测方式为正离子, 母离子扫描范围是300—1800 m/z。一级质谱分辨率: m/z为200时70000, AGC target为3e6, 一级最大(Maximum) IT为10ms, 扫描范围数(number of scan ranges)为1, 动态排除(Dynamic exclusion)为40.0s。多肽和多肽碎片的质量电荷比按以下方法采集: 每次全扫描(full scan)后采集10个碎片图谱, 二级质谱激活类型(MS2 Activation Type)为HCD, 隔离窗(Isolation window)为2 m/z。二级质谱分辨率: m/z为200时17500, 微碎片图谱数(microscans)为1, 二级Maximum IT为60ms, 规一化碰撞能量(Normalized collision energy)为30eV, 填充率(Underfill ratio)为0.1%。
1.8 数据分析
用软件Mascot 2.2和Proteome Discoverer 1.4进行查库鉴定及定量分析。本实验使用的数据库为NCBI_Cyprinidae_420850_20161102.fasta (序列总数: 420850)。搜索参数设置如下: 胰蛋白酶消化;胰酶消化最多允许2个漏切点; 一级离子质量容差为0.002%; 二级离子质量容差为0.1 Da; 固定修饰分别为Carbamidomethyl (C)、iTRAQ8plex (K)和TRAQ8plex (N-term); 可变修饰为Oxidation (M)和iTRAQ8plex (Y)。依据蛋白质丰度水平, 当差异倍数≥1.2(上调)或≤0.83(下调), 且经统计检验其P<0.05 时, 视为差异表达蛋白质。
1.9 生物信息学分析
采用数据库中的注释信息, 分析筛选出来的差异表达蛋白, 通过GO (Gene Ontology)分析数据库(http//www.geneontology.org/)进行GO分析, 从参与的生物过程(Biological process, BP)、分子功能(Molecular function, MF)及细胞组分(Cellular Component, CC)三个方面进行显著性分析。通过KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库(http//www.kegg.jp/kegg/pathway.html)分析差异表达蛋白主要参与的生化代谢途径和信号转导途径。
1.10 感染青鱼的组织病理分析
取注射感染嗜水气单胞菌BCK0712菌株24h后的青鱼和对照组青鱼, 解剖后取其肝脏组织, 用4% 多聚甲醛固定, 石蜡包埋后进行切片, 以苏木精-伊红染色法染色, 中性树胶包埋, 显微镜观察和拍照。
2 结果
2.1 感染青鱼的发病症状
健康青鱼在注射感染嗜水气单胞菌24h后, 出现了体色发黑、鳃盖充血、鳍基充血、内脏充血、肛门红肿、肠腔内有气体、腹腔内积有红色腹水等症状(图 1)。
2.2 差异表达蛋白统计
本实验共鉴定到肽段14905个, 鉴定到蛋白数量为4475个。通过分析, 筛选到青鱼肝脏组织的差异表达蛋白共计188 个, 其中表达上调的差异蛋白70 个(表 1按差异显著性列出前21个), 表达下调的差异蛋白118个(表 2按差异显著性列出前55个)。
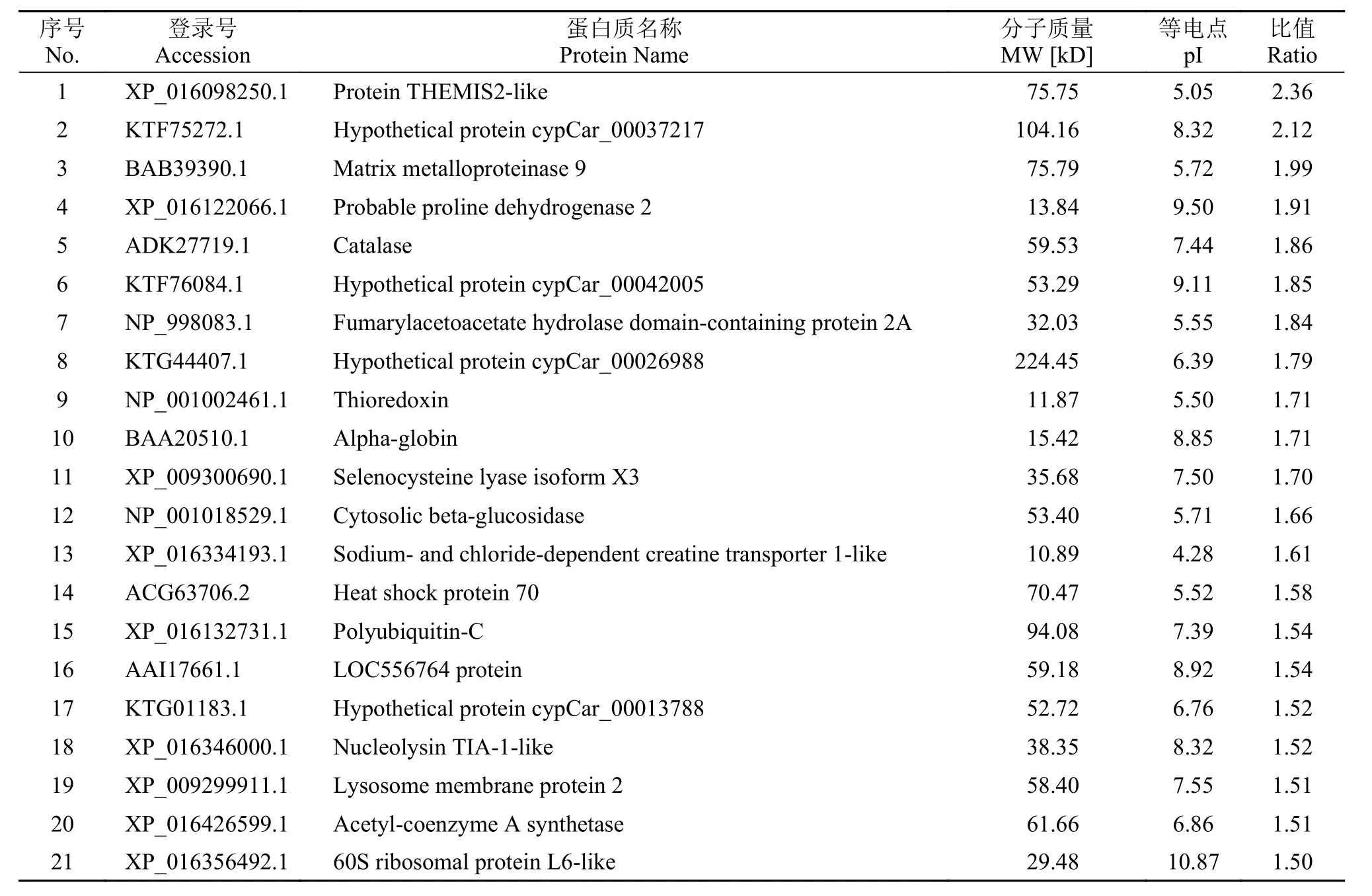
表 1 在嗜水气单胞菌感染青鱼后青鱼肝脏组织表达上调的差异蛋白Tab. 1 Up-regulated proteins in liver of A. hydrophila infected black carp
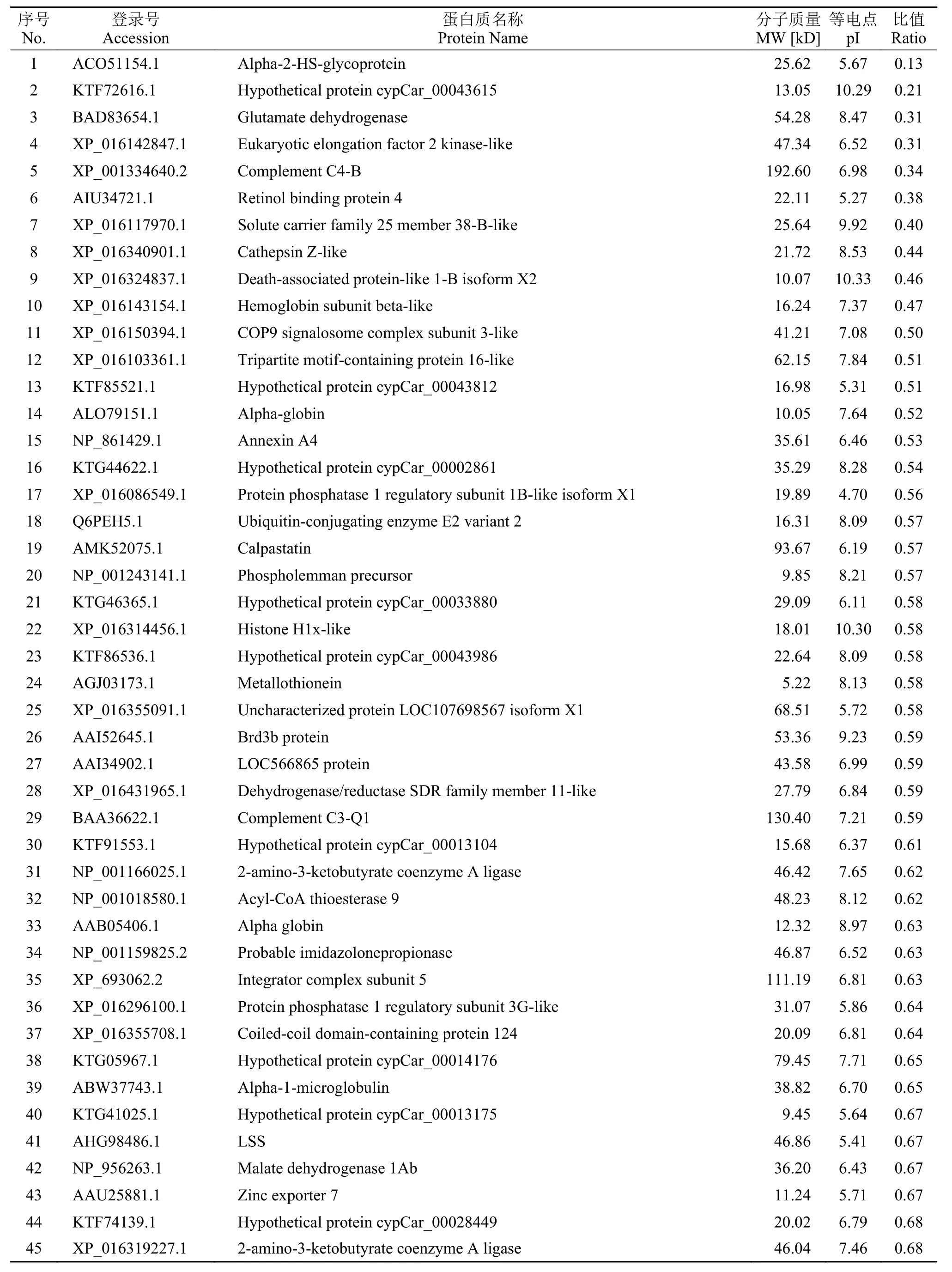
表 2 在嗜水气单胞菌感染青鱼后青鱼肝脏组织表达下调的差异蛋白Tab. 2 Down-regulated proteins in liver of A. hydrophila infected black carp

续表 2
上调表达蛋白包括选择性胸腺细胞相关蛋白2样蛋白(Protein THEMIS2-like)、基质金属蛋白酶-9(Matrix metalloproteinase 9)、脯氨酸脱氢酶2(Proline dehydrogenase 2)、过氧化氢酶(Catalase)、延胡索酰乙酰乙酸水解酶(Fumarylacetoacetate hydrolase domain-containing protein 2A)、硫氧还蛋白(Thioredoxin)、α-珠蛋白(Alpha-globin)、硒代半胱氨酸裂解酶X3亚型(Selenocysteine lyase isoform X3)、β-葡萄糖苷酶(Cytosolic beta-glucosidase)、Na+/Cl-依赖性肌酸转运蛋白样蛋白1(Sodium- and chloride-dependent creatine transporter 1-like)、热休克蛋白70(Heat shock protein 70)、多聚泛素C (Polyubiquitin-C)、核溶素样蛋白TIA-1(Nucleolysin TIA-1-like)、溶酶体相关膜蛋白2(Lysosome membrane protein 2)、乙酰辅酶A合成酶(Acetyl-coenzyme A synthetase)、似60S核糖体蛋白L6(60S ribosomal protein L6-like)等。
下调表达蛋白包括α2热稳定性糖蛋白(Alpha-2-HS-glycoprotein)、谷氨酸脱氢酶(Glutamate dehydrogenase)、真核生物延长因子2激酶(Eukaryotic elongation factor 2 kinase-like)、补体C4-B (Complement C4-B)、视黄醇结合蛋白4(Retinol binding protein 4)、溶质载体家族25成员38样蛋白(Solute carrier family 25 member 38-B-like)、组织蛋白酶Z(Cathepsin Z-like)、死亡相关蛋白样蛋白1-B X2亚型(Death-associated protein-like 1-B isoform X2)、血红蛋白β亚单位样蛋白(Hemoglobin subunit betalike)等。
2.3 生物信息学分析
为深入分析嗜水气单胞菌感染对青鱼肝脏组织蛋白表达的影响, 对差异表达蛋白质进行GO功能分析, 差异蛋白参与的“生物过程”主要集中在单组织过程(Single-organism process)、细胞内过程(Cellular process)、代谢过程(Metabolic process)、生物学调控(Biological regulation)等; “分子功能”主要集中在结合活性(Binding)和催化活性(Catalytic activity)等; “细胞组分”主要集中在细胞(Cell)、细胞部分(CEll part)和细胞器(Organelle)等(图 2)。
KEGG通路分析表明, 青鱼肝脏组织的差异表达蛋白主要参与补体和凝血级联反应(Complement and coagulation cascades)、剪接体(Spliceosome)、细胞内吞作用(Endocytosis)、氧化磷酸化(Oxidative phosphorylation)、碳代谢(Carbon metabolism)、精氨酸和脯氨酸代谢(Arginine and proline metabolism)、色氨酸代谢(Tryptophan metabolism)等通路(图 3), 其中补体和凝血级联反应通路富集最为显著(图 4)。
2.4 差异表达蛋白的qRT-PCR验证
选取差异表达蛋白补体C3和热休克蛋白70(HSP70), 用qRT-PCR检测其在mRNA水平上的变化。结果显示, 在嗜水气单胞菌感染青鱼后, 青鱼肝脏组织中补体C3基因的mRNA表达水平下调,HSP70基因的mRNA表达水平上调(图 5), 这与iTRAQ结果变化趋势一致。
2.5 感染青鱼的组织病理变化
感染嗜水气单胞菌的青鱼和健康青鱼的肝脏组织切片于显微镜下观察, 可见病鱼肝脏组织发生了明显的病理变化, 主要表现为肝细胞边界不分明、细胞核固缩、肝板排列紊乱、有出血现象等(图 6A); 而健康青鱼肝脏切片显示肝细胞多角形、排列紧密、细胞边界明显(图 6B)。
3 讨论
iTRAQ联合液相色谱串联质谱技术是近年发展起来的功能强大的比较蛋白质组学技术之一, 用于寻找差异表达蛋白, 为生理病理机制研究提供线索, 也可用于分子标志物的筛选研究[14]。本实验应用iTRAQ蛋白质组学技术, 研究了青鱼感染嗜水气单胞菌前后肝脏组织蛋白质表达的变化, 结果共筛选到188个差异表达蛋白, 其中70个(占37%)差异蛋白表达上调, 118个(占63%)差异蛋白表达下调, 表达下调的蛋白占比较高. 分析与免疫相关的差异蛋白, 上调表达蛋白有选择性胸腺细胞相关蛋白样蛋白、基质金属蛋白酶-9、热休克蛋白70、过氧化氢酶、硫氧还蛋白等, 下调表达蛋白有补体C1、补体B/C2B、补体C3-Q1和补体C4-B等。

图 2 青鱼肝脏组织差异表达蛋白的GO功能分析Fig. 2 GO analysis of differently expressed proteins in liver of black carp
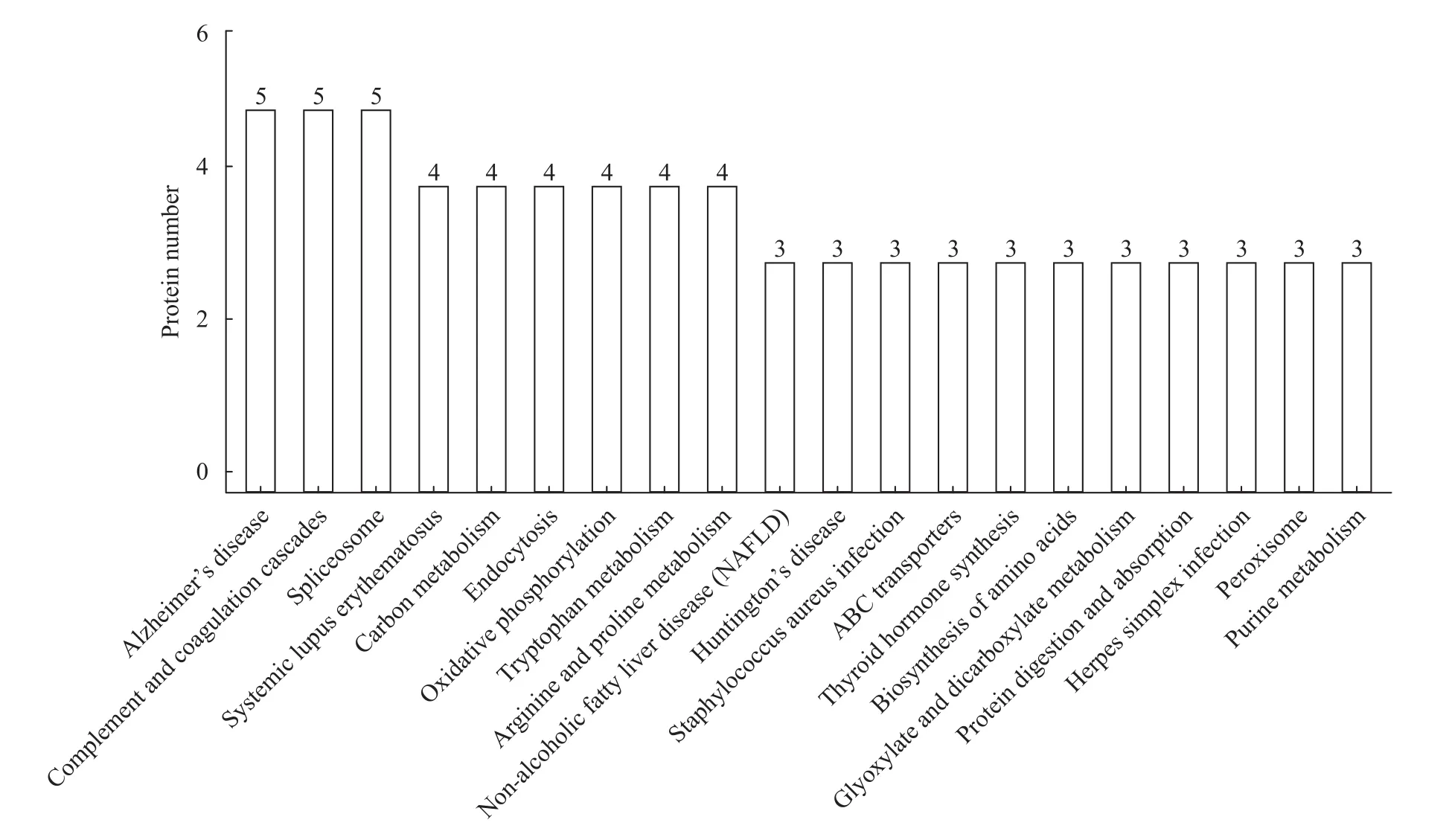
图 3 青鱼肝脏组织差异表达蛋白的KEGG通路分析(前20条)Fig. 3 KEGG pathway analysis of differently expressed proteins in liver of black carp (top 20)

图 4 补体和凝血级联反应通路(差异表达蛋白以粗体标注)Fig. 4 Schematic drawing of the pathway of coagulation and complement cascades (the bold fonts indicate differently expressed proteins)
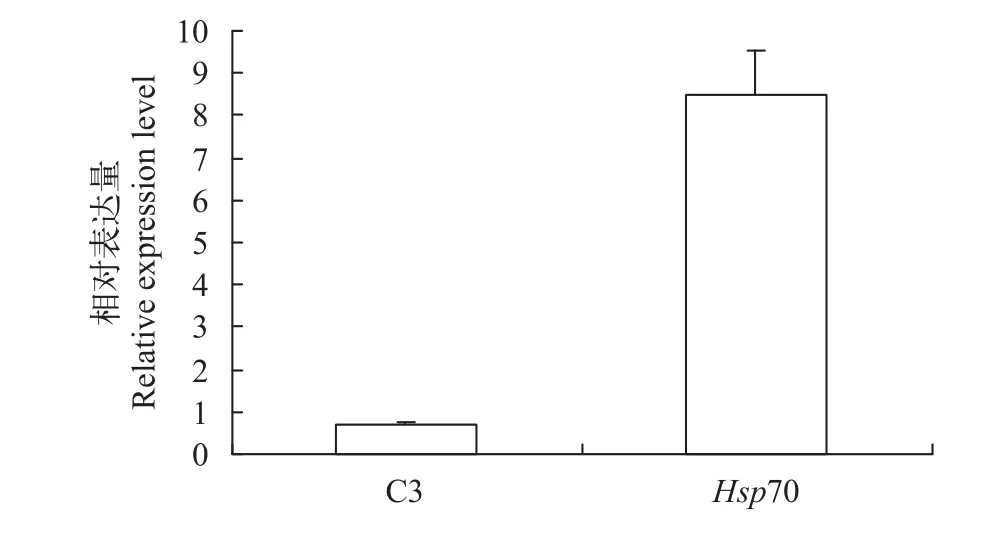
图 5 嗜水气单胞菌感染青鱼后青鱼肝脏补体C3和Hsp70 mRNA的相对表达量Fig. 5 Relative expression of C3 and Hsp70 genes in liver of A.hydrophila infected black carp
选择性胸腺细胞相关蛋白(THEMIS2)调控着巨噬细胞Toll样受体信号转导和细胞因子的产生,在巨噬细胞炎症反应中发挥着关键作用[15]。青鱼在受到嗜水气单胞菌感染后, 肝脏组织THEMIS2的上调表达, 提示THEMIS2可能参与了调控巨噬细胞炎症反应, 从而增强机体免疫应答, 以应对病原体的感染。
基质金属蛋白酶-9 (MMP-9)属于基质金属蛋白酶家族(MMPs), MMPs是一类蛋白水解酶, 可降解细胞外多种基质成分。近年来, 随着基础研究的不断深入, MMPs在炎症中的作用越来越受重视.MMPs能通过多种途径调节炎症性反应的进程, 通过改变化学因子的功能和重要的促炎症性细胞因子的生物可利用性, 从而促进炎症细胞募集[16]。研究表明, MMP-9主要由炎性细胞(如巨噬细胞)分泌[17], 且MMP-9的过表达与炎症初期释放的某些炎性介质呈正相关[18]。推测本实验嗜水气单胞菌感染导致鱼体炎性介质的释放增加, 肝脏MMP-9表达上调, 细胞外基质和基膜的降解进一步加重, 炎性细胞的浸润加剧, 从而加重了炎性反应。
热休克蛋白(HSPs)是一类存在于所有生物体比较保守的蛋白, 在遇到外界刺激时, 能诱导或增强表达, 以保护细胞免受损害[19]。HSP70是HSPs家族中表达最广泛的蛋白, 具有促进蛋白质的合成、折叠、运输, 清除变性蛋白, 抗细胞凋亡和介导细胞免疫功能以及信号传导因子的作用[20]。HSP70在正常细胞中水平较低, 在应激状态下可明显升高。吉富罗非鱼(Oreochromis niloticus)感染链球菌48h内,HSP70 mRNA在脾脏中表达升高, 感染24h后HSP70 mRNA表达量是正常脾脏组织的5.5倍多[21]。万文菊等[22]用溶藻弧菌(Vibrio alginolyticus)感染剑尾鱼(Xiphophorus helleri), 结果在感染濒死鱼脾脏内检测到HSP70基因强烈表达。研究表明,HSP70还是重要的抗原提呈调节因子, 可促进T细胞介导的免疫反应, 产生细胞因子, 加强NK细胞的杀伤作用, 以及介导NF-κB/IκB/IKK信号通路。青鱼在感染嗜水气单胞菌后, 肝脏HSP70的表达出现上调, 提示青鱼处于病原菌感染、肝组织损伤等病理应激状态, 升高的HSP70可激活机体的免疫应答反应, 调控免疫细胞因子的活性。
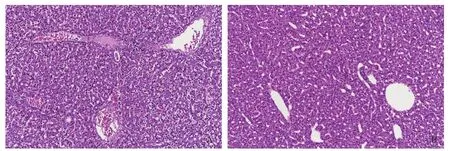
图 6 感染嗜水气单胞的青鱼肝脏组织切片(200×)Fig. 6 Hispathological characteristic of liver of black carp infected with A. hydrophilia
过氧化氢酶(CAT)存在于所有已知动物的各组织中, 特别在肝脏中以高浓度存在。它能催化过氧化氢分解为分子氧和水, 清除体内的过氧化氢, 从而使细胞免于遭受过氧化氢的毒害, 是生物防御体系的关键酶之一。硫氧还蛋白(Trx)是一类氧化还原调节蛋白, 可通过对细胞内被氧化的二硫键的还原来修复机体的氧化损伤, 还可与其他氧化还原系统协调配合, 消除体内过多的活性氧[23]。赵静等[24]分析了齐口裂腹鱼(Schizothorax prenanti)感染嗜水气单胞菌后血清CAT活力变化, 结果显示在感染初期, CAT活力明显增强, 48h时达到峰值。严林飞等[25]研究表明, 大黄鱼(Larimichthys crocea)感染鳗弧菌(Vibrio anguillarum)后肝组织中CAT基因的表达随着时间的推移而变化明显, 感染后12h达到最高(7.48倍)。本实验青鱼肝脏CAT和Trx的表达上调,说明嗜水气单胞菌感染可能引起机体产生大量活性氧自由基和过氧化氢, CAT和Trx的上调表达可清除体内过量的活性氧, 进而防止它们对机体细胞造成损伤。
补体系统是存在于血清、组织液和细胞膜表面的的一组不耐热的经活化后具有酶活性的蛋白质, 参与了机体的特异性和非特异性免疫, 在抗微生物防御反应、免疫调节及介导免疫病理的损伤性反应中发挥重要作用。补体系统各成分通常以非活性状态存在, 当其被激活物质活化之后, 才表现出生物学活性。目前已发现3条补体激活途径:经典途径、替代途径和凝集素途径。 3条途径起点各异, 但存在相互交叉, 并且有共同的末端通路, 即膜攻击复合物(MAC)的形成及其溶解细胞效应。由于鱼类进化地位的特殊性, 关于其补体系统的研究越来越受到众多学者的重视。研究表明硬骨鱼类存在补体激活的3条途径, 补体的溶菌活性是硬骨鱼类清除细菌的一个重要机制。 Li等[26]的研究表明迟缓爱德华氏菌(Edwardsiella tarda)通过抑制补体替代途径的活化逃避宿主的攻击。人类某些疾病可引起总的补体含量或单一成分含量发生变化, 因此对补体水平的测定, 对疾病的诊断具有一定意义。青鱼在感染嗜水气单胞菌后, 肝脏中的补体C1、补体B/C2B、补体C3-Q1和补体C4-B均呈下调表达, 这些补体成分参与了补体活化的3条激活途经。在通路分析中, 与青鱼补体和凝血级联反应通路相关的差异蛋白个数最多, 其中包含补体B/C2B、补体C3-Q1和补体C4-B等。以上结果提示在青鱼受细菌感染后, 肝脏中的补体系统的活化受到了抑制, 机体对病原菌的杀灭作用降低, 免疫功能下降。
此外, 方献平等[27]研究发现三角鲂和团头鲂对嗜水气单胞菌的响应蛋白质多集中在糖类合成代谢、丙酮酸代谢、碳水化合物合成分解、转录翻译和氧化还原等生物过程中, 并且这些应答蛋白质参与了结构分子活性、核糖体结构组成、维生素连接、辅酶连接、血红素连接、氧气转运相关蛋白活性等分子功能. 本实验筛选到的差异表达蛋白,除与免疫相关的蛋白外, 其他蛋白种类与三角鲂和团头鲂的响应蛋白相似。
综上所述, 本研究应用iTRAQ蛋白质组学技术,定量分析了青鱼感染嗜水气单胞菌前后肝脏蛋白质组的表达变化, 并对差异表达蛋白在参与的生物学过程、分子功能、细胞定位以及参与的通路等进行归纳整理, 研究结果为深入揭示嗜水气单胞菌的分子致病机制奠定了理论基础。
