过氧自由基氧化对米糠蛋白结构和功能性质的影响
2019-03-11尤翔宇黄慧敏吴晓娟
尤翔宇,黄慧敏,吴晓娟,吴 伟*
(稻谷及副产物深加工国家工程实验室,中南林业科技大学食品科学与工程学院,湖南 长沙 410004)
米糠是稻谷籽粒的精华所在,虽然只占稻谷质量的6%~8%,却集中了64%的稻谷营养素和90%以上的人体必需元素[1]。米糠中蛋白质质量分数约为11%~17%,米糠蛋白过敏性低,氨基酸组成合理,生物效价高,特别适合开发婴幼儿配方食品[2]。米糠蛋白还具有良好的溶解性、乳化性、起泡性等功能性质,是一种极具开发潜力的植物蛋白[3-4]。米糠中含有12%~22%油脂以及活性较强的脂肪水解酶和脂肪氧合酶,在米糠贮藏和加工过程中,脂肪水解酶可快速水解米糠油形成游离脂肪酸,使得米糠快速水解酸败;形成的游离多不饱和脂肪酸在米糠内源脂肪氧合酶的作用下发生脂质过氧化反应,导致米糠氧化酸败[5-6]。脂质过氧化反应较为复杂,其中活性物质主要包括脂质自由基和活性脂质氧化产物[7],这些活性物质具有氧化米糠蛋白的能力,在米糠贮藏过程中可导致米糠蛋白结构[8]、功能性质[9]和消化性质[10]发生剧烈变化,但目前尚不清楚脂质自由基和活性脂质氧化产物分别对米糠蛋白氧化造成多大程度的影响。已有研究表明,2,2’-盐酸脒基丙烷(2,2’-azobis(2-amidinopropane),AAPH)有氧热分解产生的过氧自由基是脂质过氧化反应中最主要的自由基中间体[11]。Wu Wei[12]和Ye Lin[13]等分别采用AAPH在有氧条件下热降解产生的过氧自由基氧化大豆蛋白和花生蛋白,均发现过氧自由基会对蛋白质结构和性质产生重要影响,但目前还鲜见过氧自由基氧化米糠蛋白的研究报道。因此,本研究采用AAPH在有氧条件下热降解产生的过氧自由基代表米糠氧化酸败中产生的脂质自由基,研究脂质自由基氧化对米糠蛋白结构和功能性质的影响,以期更深入地了解米糠蛋白的氧化机理,为合理开发米糠蛋白提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜米糠 湖南长沙霞凝国家粮食储备库。
AAPH(纯度97%) 上海Macklin公司;5,5’-二硫代二硝基苯甲酸(5,5’-dithiobis(2-nitrobenzoic acid),DTNB)、1-苯氨基萘-8-磺酸(均为分析纯) 美国S i g m a-A l d r i c h公司;三羟甲基氨基甲烷(tris(hydroxymethyl)aminomethane,Tris)、甘氨酸(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
Sorvall LYNX 6000高速落地离心机 美国Thermo Fisher公司;FD5-4冷冻干燥机 美国GOLD-SIM公司;IRTracer-100傅里叶红外光谱仪、LC-20A高效液相色谱仪 日本岛津公司;F4600荧光分光光度计 日本日立公司;Healthcare SE260电泳仪 美国GE公司;Nano ZS纳米粒度分析仪 英国Malvern公司。
1.3 方法
1.3.1 米糠蛋白提取
参考吴伟等[8]方法提取米糠蛋白。新鲜米糠除杂过40 目筛,随后与正己烷以料液比1∶5(g/mL)混合脱脂,重复脱脂5 次。将脱脂米糠和去离子水以1∶10(g/mL)混合,用2 mol/L NaOH溶液调节pH值至9.0,40 ℃、120 r/min搅拌提取4 h,随后4 ℃、8 000 r/min离心20 min,取上清液用2 mol/L HCl溶液调pH值至4.0,静置20 min后,4 ℃、8 000 r/min离心20 min得到米糠蛋白沉淀,去离子水洗涤3 次后将蛋白沉淀分散于5 倍体积的去离子水中,用2 mol/L NaOH溶液调节pH值至7.0,采用截留分子质量3 500 u的透析袋透析24 h脱盐,最后冷冻干燥得到纯度为83.75%的米糠蛋白。
1.3.2 过氧自由基氧化米糠蛋白制备
参考Wu Wei等[12]的方法制备过氧自由基氧化米糠蛋白。将米糠蛋白分散于0.01 mol/L pH 7.4的磷酸盐缓冲液(含有0.5 mg/mL NaN3)中,配制成蛋白质量浓度为10 mg/mL的溶液。将一定质量的AAPH溶解于米糠蛋白溶液中,使得AAPH浓度分别为0、0.1、1、3、6 mmo1/L和10 mmo1/L,然后将混合液在37 ℃避光条件下恒温水浴搅拌振荡反应24 h。随后将溶液置于冰浴中降温至4 ℃以下,再将溶液在4 ℃去离子水中采用截留分子质量3 500 u的透析袋透析24 h除去残余未反应的AAPH,最后冷冻干燥得到过氧自由基氧化米糠蛋白,将其置于4 ℃条件下贮存待用。
1.3.3 米糠蛋白羰基含量测定
参考Sun Weizheng等[14]的方法测定氧化米糠蛋白羰基含量。将0.50 g氧化米糠蛋白溶于25 mL 0.05 mol/L pH 8.0的Tris-HCl缓冲液中,采用考马斯亮蓝比色法测定溶液中蛋白质含量。取0.35 mL蛋白质溶液和1 mL 2 mol/L的HCl溶液(含10 mmol/L 2,4-二硝基苯肼)混合,同时以不加2,4-二硝基苯肼为空白对照,20 ℃水浴2 h后加入0.45 mL 40%三氯乙酸溶液,混匀后静置0.5 h,然后4 ℃、10 000 r/min离心20 min,将沉淀加入到1.5 mL乙醇-乙酸乙酯(1∶1,V/V)混合溶液中,在4 ℃、10 000 r/min 离心20 min,洗涤沉淀3 次,随后将沉淀溶解于1.0 mL 0.1 mol/L pH 8.0的Tris-HCl缓冲液(含6 mol/L盐酸胍)中,37 ℃水浴20 min后测定波长367 nm处吸光度,以摩尔消光系数22 000 L/(mol•cm)计算每毫克蛋白质中羰基含量。
1.3.4 米糠蛋白游离巯基和二硫键含量测定
采用DTNB比色法测定米糠蛋白的游离巯基和二硫键含量[12]。将0.25 g氧化米糠蛋白溶于50 mL 8 mol/L尿素Tris-Gly溶液中,采用考马斯亮蓝比色法测定溶液中蛋白质含量。取4 mL蛋白质溶液加入160 μL含4 mg/mL DNTB的pH 8.0的Tris-Gly缓冲液,以不加DNTB为对照,在412 nm波长处测定吸光度,以摩尔消光系数13 600 L/(mol·cm)计算游离巯基含量。另取4 mL蛋白质溶液加入0.2% β-巯基乙醇溶液处理2 h后,再加入8 mL 12%的三氯乙酸溶液沉淀蛋白质1 h,10 000 r/min离心10 min,用三氯乙酸溶液重复洗涤沉淀3 次后,将沉淀溶于6 mL Tris-Gly缓冲液中,以不加DNTB为对照,在412 nm波长处测定吸光度,以摩尔消光系数13 600 L/(mol•cm)计算总巯基含量。总巯基与游离巯基差值的1/2即为二硫键含量。
1.3.5 米糠蛋白二酪氨酸含量测定
参考Cui Xuhai等[15]的方法测定米糠蛋白的二酪氨酸含量。将氧化米糠蛋白样品溶于0.02 mol/L、pH 6.0的磷酸盐缓冲液中,制备1 mg/mL蛋白质溶液,在325 nm激发波长和395 nm发射波长处测量荧光强度,狭缝宽度为5 nm。
1.3.6 米糠蛋白傅里叶红外光谱分析
参考Liu Yongle等[16]的方法。在室温、干燥环境中将2 mg氧化米糠蛋白样品与200 mg KBr研磨混合均匀后压片5 min制成透明薄片,采用傅里叶红外测定仪进行扫描。扫描波数范围400~4 000 cm-1,分辨率4 cm-1,扫描次数为64 次。
1.3.7 米糠蛋白内源荧光光谱分析
参考Wu Wei等[12]的方法对米糠蛋白进行内源荧光光谱分析。将氧化米糠蛋白溶解于0.01 mol/L pH 7.0磷酸盐缓冲液中,采用考马斯亮蓝比色法测定溶液中蛋白质含量,用磷酸盐缓冲液将蛋白质量浓度稀释到0.1 mg/mL。采用F-4600型荧光光谱仪在激发波长280 nm条件下扫描300~500 nm之间的发射光谱(狭缝宽度2.5,灵敏度为1),以0.01 mol/L pH 7.0磷酸盐缓冲液作空白。
1.3.8 米糠蛋白表面疏水性测定
采用1-苯氨基萘-8-磺酸作为荧光探针法测定米糠蛋白的表面疏水性[12]。将0.45 g氧化米糠蛋白溶于30 mL 0.05 mol/L pH 8.0的Tris-HCl缓冲液中,采用考马斯亮蓝比色法测定溶液中蛋白质含量,并将蛋白质溶液稀释为蛋白质量浓度在0.005~0.50 mg/mL之间的5 个不同梯度。取不同质量浓度蛋白溶液4 mL,分别加入50 μL 8 mmol/L 1-苯氨基萘-8-磺酸溶液,在激发波长390 nm、发射波长470 nm处测定荧光强度。以荧光强度对蛋白质量浓度作图,曲线初始阶段的斜率即为米糠蛋白的表面疏水性指数。
1.3.9 米糠蛋白凝胶电泳分析
参考Wu Wei等[12]的电泳方法。浓缩胶4%,分离胶12.5%;电极缓冲液含0.1%十二烷基硫酸钠(pH 8.3)、0.384 mol/L Gly、0.05 mol/L Tris;样品溶解液为0.01 mol/L pH 8.0 Tris-HCl缓冲液,含2%十二烷基硫酸钠、10%甘油、0.02%溴酚蓝、5% β-巯基乙醇;样品质量浓度1.5 mg/mL,上样量10 μL。电泳采用0.75 mm凝胶板,开始时电流为10 mA,样品进入分离胶后调为25 mA。
1.3.10 米糠蛋白分子质量测定
将氧化米糠蛋白分散于0.05 mol/L磷酸盐缓冲液中(pH 7.2,含0.05 mol/L NaCl),配制成蛋白质量浓度为10 mg/mL的溶液,随后过孔径0.45 μm的醋酸纤维素膜,收集滤液。采用LC-20A高效液相色谱仪对样品进行分析。色谱柱:TSKgel SW G4000 SWXL(7.8 mm×300 mm,8 µm);检测器:Waters 996光电二极管阵列检测器;流动相:0.05 mol/L磷酸盐缓冲液(pH 7.2,含0.05 mol/L NaCl);检测波长280 nm;流速1 mL/min;柱温25 ℃。
1.3.11 米糠蛋白粒径分布测定
将氧化米糠蛋白溶于0.01 mol/L pH 7.0的磷酸盐缓冲液中,蛋白质质量浓度为1 mg/mL,随后在25 ℃条件下采用纳米粒度分析仪测定米糠蛋白溶液的粒径分布。
1.3.12 米糠蛋白持水性、持油性测定
参考Benelhadj等[17]的方法,持水性表示为吸收水的质量占样品的质量的百分比,持油性表示为吸收油的质量占样品质量的百分比。
1.3.13 米糠蛋白起泡能力和泡沫稳定性测定
参考Zhu Songming等[18]的方法,气泡能力表示为泡沫体积占溶液体积的百分比,泡沫稳定性表示为静置30 min后的泡沫体积占初始泡沫体积的百分比。
1.3.14 米糠蛋白乳化性和乳化稳定性测定
参考Zhang等[19]的方法,在波长500 nm处测定新制备的和静止30 min的米糠蛋白-大豆油乳状液的吸光度,按公式(1)、(2)计算:
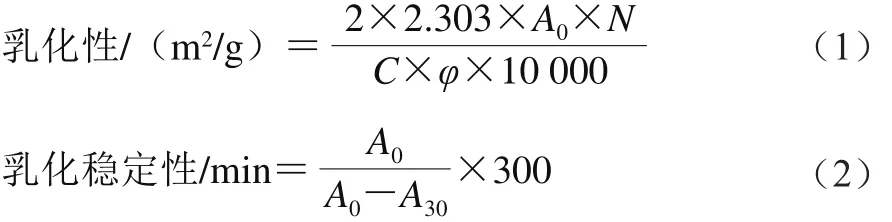
式中:N为稀释倍数;C为样品溶解液中蛋白质质量浓度/(g/mL);φ为油相所占的体积分数/%。
1.4 数据处理与统计分析
所有实验平行测定3 次。数据采用Microsoft Excel 2003软件和Origin 7.5软件进行处理,结果以表示。指标比较采用最小显著差异法,取95%置信度(P<0.05)。
2 结果与分析
2.1 过氧自由基氧化对米糠蛋白氧化程度的影响
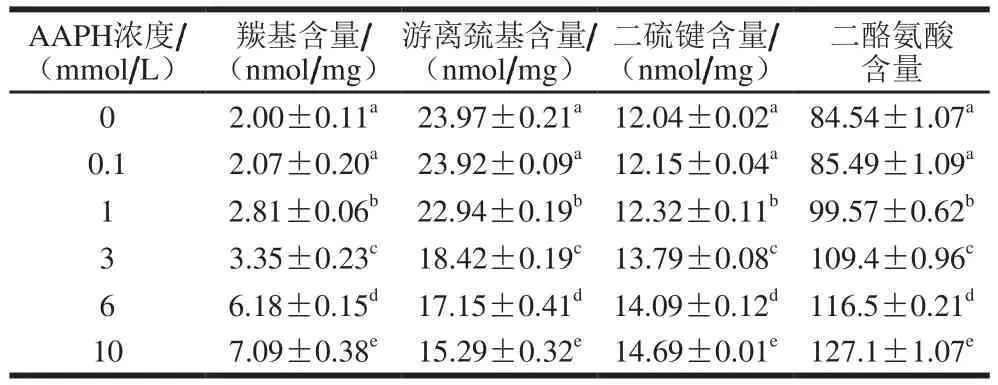
表1 不同浓度AAPH形成的过氧自由基氧化米糠蛋白羰基、游离巯基、二硫键和二酪氨酸含量Table 1 Carbonyl, free sulfhydryl, disulfide, and dityrosine contents of rice bran protein oxidatively modified by peroxyl radicals derived from different concentrations of AAPH
为研究实际的米糠酸败程度对米糠蛋白氧化程度和结构特征的影响,吴伟等[8]以新鲜米糠为原料,在室温条件下贮藏不同时间得到不同酸败程度的米糠,以制备米糠毛油的酸价作为米糠贮藏时间的选择依据,研究发现新鲜米糠在室温条件下贮藏0、1、3、5、10 d制备米糠毛油酸价分别为4.03、14.65、22.54、25.72 mg/g和30.38 mg/g(以KOH计),这些酸价数值在我国生产的绝大部分米糠毛油酸价范围(15~40 mg/g)内[20],对应制备的米糠蛋白羰基含量分别为1.76、2.74、4.13、5.85 nmol/mg和9.16 nmol/mg。蛋白质羰基含量是衡量蛋白质氧化程度最常用的指标,本实验将新鲜米糠贮藏0、1、3、5、10 d制备米糠蛋白羰基含量与过氧自由基氧化米糠蛋白羰基含量对比,从而确定AAPH的添加浓度分别为0、0.1、1、3、6 mmo1/L和10 mmo1/L,不同浓度AAPH形成的过氧自由基氧化米糠蛋白羰基含量如表1所示,当AAPH浓度从0 mmol/L增加到10 mmol/L时,米糠蛋白羰基含量从2.0 nmol/mg增加到7.09 nmol/mg,表明浓度逐渐增大的AAPH形成的过氧自由基导致米糠蛋白逐渐氧化。过氧自由基能够诱导蛋白质主肽链和氨基酸残基侧链基团形成蛋白质过氧自由基,随后通过酰胺化等途径导致蛋白质形成羰基化合物[21]。
蛋白质巯基和酪氨酸残基是对氧化较为敏感的基团,但蛋白质羰基含量不能表征蛋白质巯基和酪氨酸残基的氧化程度,本实验采用游离巯基和二硫键含量表征米糠蛋白巯基氧化程度,采用二酪氨酸含量表征米糠蛋白酪氨酸残基的氧化程度,结果如表1所示,随着AAPH浓度的增加,米糠蛋白游离巯基含量从23.97 nmol/mg逐渐减小到15.29 nmol/mg,二硫键含量则从12.04 nmol/mg逐渐增加到14.69 nmol/mg,二酪氨酸含量从84.54逐渐增加到127.1,表明浓度逐渐增大的AAPH形成的过氧自由基导致米糠蛋白巯基和酪氨酸残基逐渐氧化。依据氧化环境和氧化强度的改变,过氧自由基攻击蛋白质巯基可发生可逆氧化反应,也可发生不可逆氧化反应[22-23]。过氧自由基首先与巯基反应生成亚磺酰自由基,亚磺酰自由基随后与分子氧形成硫醇自由基,硫醇自由基进一步氧化形成二硫键,造成蛋白质氧化程度增加[24],这一阶段是可逆氧化反应,而不可逆氧化反应则生成亚磺酸和磺酸等[25]。表1中游离巯基含量的下降程度明显大于二硫键的增加程度,表明游离巯基既发生了可逆氧化也发生了不可逆氧化。蛋白质酪氨酸残基易受过氧自由基攻击而和空间位置相邻的酪氨酸残基共价交联,形成二酪氨酸[26]。
2.2 过氧自由基氧化对米糠蛋白二级结构的影响
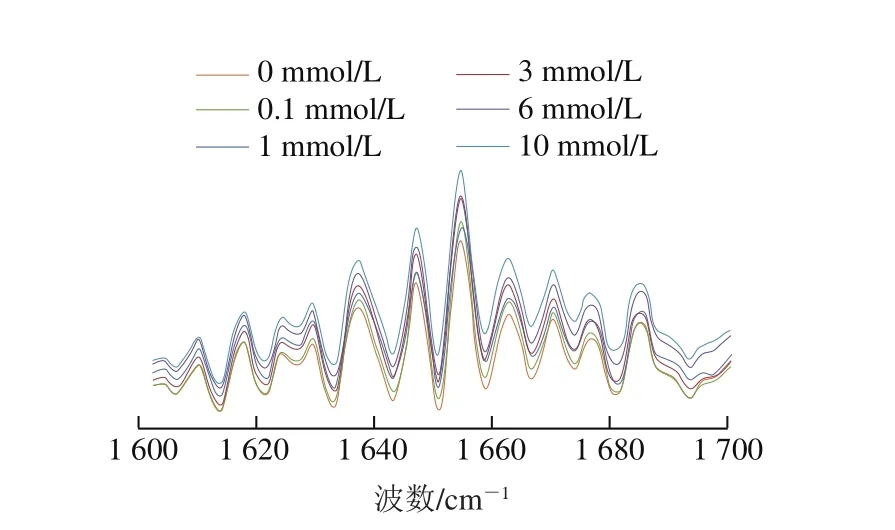
图1 不同浓度AAPH形成的过氧自由基氧化对米糠蛋白去卷积酰胺I带的影响Fig. 1 Effect of oxidative modification by peroxyl radicals derived from different concentrations of AAPH on the deconvolution amide I band of rice bran protein
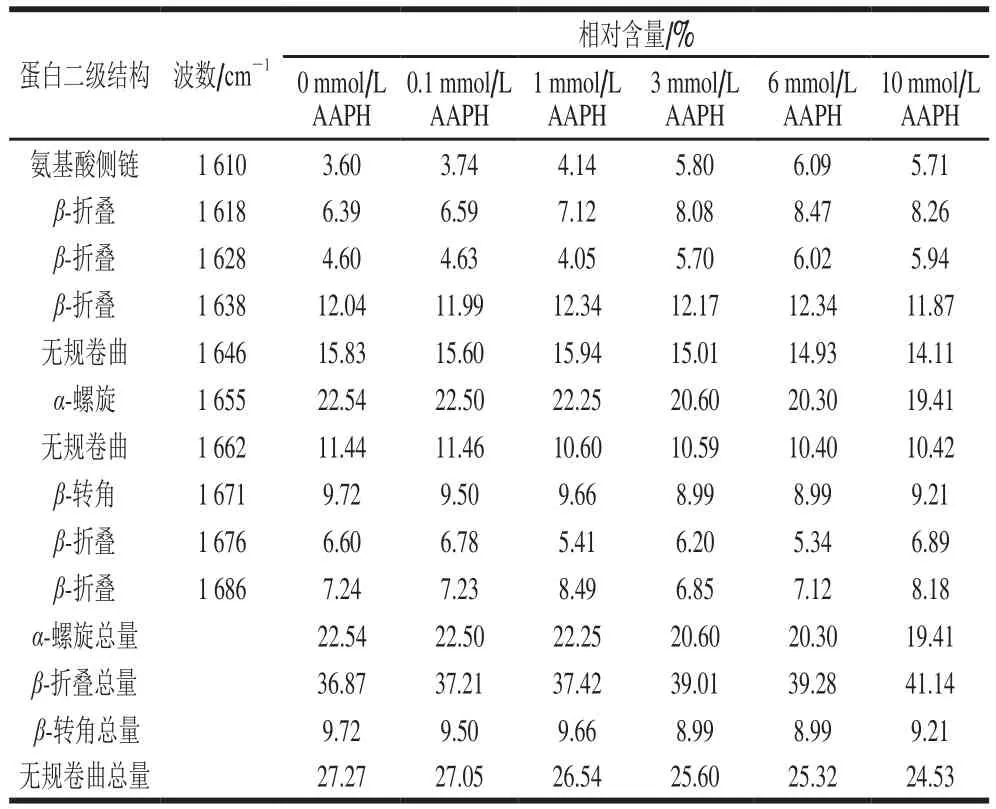
表2 不同浓度AAPH形成的过氧自由基氧化对米糠蛋白二级结构组成的影响Table 2 Effect of oxidative modification by peroxyl radicals derived from different concentrations of AAPH on the secondary structure composition of rice bran protein
傅里叶变换红外光谱是表征蛋白质二级结构的主要技术方法之一,尤其是酰胺I带(1 700~1 600 cm-1),是反映蛋白质二级结构变化最常用的谱带[27]。米糠蛋白去卷积酰胺I带谱图如图1所示,参考Liu Yongle等[16]的方法对谱图进行Gaussian拟合,分离重叠吸收峰,均得到10 个特征吸收峰,如表2所示。1 610 cm-1是由氨基酸侧链(尤其是酪氨酸残基等)产生的特征吸收峰[28]。1 618、1 628 cm-1可归属于蛋白质β-折叠平行排列产生的特征吸收峰,而1 638、1 676、1 686 cm-1可归属于蛋白质β-折叠反平行排列产生的特征吸收峰[29]。1 655 cm-1的强吸收峰通常认为是各种蛋白质中α-螺旋结构的C=O伸缩振动产生的[16,30]。在1 646 cm-1和1 662 cm-1的特征吸收峰可认为是随机结构产生的,而1 671 cm-1的特征吸收峰可认为是β-转角结构产生的[31]。结果显示,随着AAPH浓度增加,β-折叠结构相对含量由36.87%上升到41.14%,而α-螺旋结构相对含量由22.54%降低到19.41%,同时无规卷曲结构相对含量也由27.27%降低到24.53%。吴伟等[8]在研究新鲜米糠贮藏0、1、3、5、10 d后制备米糠蛋白的二级结构组成时发现,随着新鲜米糠贮藏时间的延长,米糠蛋白二级结构中α-螺旋和β-折叠结构含量下降,无规卷曲和β-转角结构含量上升,与本实验过氧自由基氧化米糠蛋白二级结构变化趋势有所出入,这是由于新鲜米糠贮藏过程产生的脂质自由基和活性脂质氧化产物均可氧化修饰米糠蛋白,而本实验仅以过氧自由基代表脂质自由基氧化修饰米糠蛋白。Sun Weizheng等[28]研究氧化对肌原纤维蛋白乳化性能的影响时也发现,随着氧化剂浓度的增加,肌原纤维蛋白β-折叠、α-螺旋和无规卷曲结构含量呈现出与本实验类似的变化趋势,氨基酸侧链总量呈现先增加后略微下降的趋势。氨基酸侧链含量的增加,可能是由于低浓度AAPH会诱导蛋白质结构展开,尤其是疏水基团的暴露[28];但如前所述,随着AAPH浓度增加,酪氨酸氧化形成二酪氨酸,且暴露出的疏水基团在氧化和疏水相互作用下形成聚集体,这都会导致1 610 cm-1的振动减弱,即显著降低氨基酸侧链的含量。
2.3 过氧自由基氧化对米糠蛋白内源荧光光谱的影响
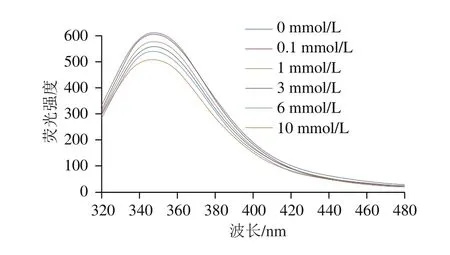
图2 不同浓度AAPH形成的过氧自由基氧化对米糠蛋白内源荧光光谱的影响Fig. 2 Effect of oxidative modification by peroxyl radicals derived from different concentrations of AAPH on the intrinsic fl uorescence of rice bran protein
如图2所示,随着AAPH浓度的增加,最大内源荧光强度从610.1下降到506.5,内源荧光强度下降16.98%,最大荧光峰位从349.4 nm蓝移到344.4 nm。吴伟等[8]在研究新鲜米糠贮藏0、1、3、5、10 d后制备米糠蛋白的内源荧光光谱时发现,随着新鲜米糠贮藏时间的延长,米糠蛋白最大内源荧光强度下降13.57%,最大荧光峰位从349 nm蓝移到347 nm。由此可见,过氧自由基氧化米糠蛋白内源荧光光谱变化趋势与新鲜米糠贮藏导致蛋白质氧化时的米糠蛋白内源荧光光谱变化趋势较为类似。蛋白质中色氨酸残基具有较低的单电子氧化势能,极易被过氧自由基氧化成为犬尿氨酸,从而降低蛋白质内源荧光强度[12]。此外,内源荧光光谱中最大荧光峰位蓝移表明米糠蛋白中色氨酸残基微环境非极性增强,这可能是由于过氧自由基氧化米糠蛋白形成聚集体,从而避开外部极性环境造成的[12]。
2.4 过氧自由基氧化对米糠蛋白表面疏水性的影响
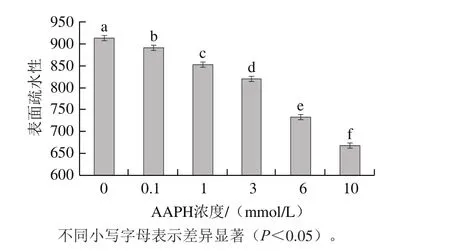
图3 不同浓度AAPH形成的过氧自由基氧化对米糠蛋白表面疏水性的影响Fig. 3 Effect of oxidative modification by peroxyl radicals derived from different concentrations of AAPH on the surface hydrophobicity of rice bran protein
如图3所示,随着AAPH浓度的增加,米糠蛋白的表面疏水性从913.4逐渐下降到668.3。吴伟等[8]在研究新鲜米糠贮藏0、1、3、5、10 d后制备米糠蛋白的表面疏水性时发现,随着新鲜米糠贮藏时间的延长,米糠蛋白表面疏水性由908.6逐渐下降至598.3,与本实验过氧自由基氧化米糠蛋白表面疏水性变化趋势类似。Wu Wei等[12]采用过氧自由基氧化大豆蛋白时发现其表面疏水性呈现类似的变化趋势,并认为过氧自由基先诱导疏水侧链的氨基酸残基转化为亲水基团,再随之进入蛋白质内部,诱导内部氨基酸残基氧化,造成蛋白质去折叠和疏水基团外露,暴露的疏水基团通过疏水相互作用形成聚集体,致使蛋白质的表面疏水性下降。
2.5 过氧自由基氧化对米糠蛋白电泳图谱的影响
张敏等[32]采用Osbron法分级提取米糠蛋白,并通过凝胶电泳测定其分子质量,结果为清蛋白(52.85、76.51、95.43 ku)、球蛋白(76.51、103.12 ku)、谷蛋白(14、20、36.29 ku)和醇溶蛋白(14 ku)。如图4所示,米糠蛋白亚基分子质量与张敏等[32]分析的结果略有差异,较明显的条带有14~16、25、36~38、49、70 ku和100 ku左右。随着AAPH浓度的增加,电泳图各泳道之间没有出现条带增减现象,且各条带颜色深浅也没有显著变化,表明过氧自由基氧化没有导致米糠蛋白亚基结构发生明显变化。吴伟等[8]在研究新鲜米糠贮藏0、1、3、5、10 d后制备米糠蛋白的电泳图时发现,随着新鲜米糠贮藏时间的延长,米糠蛋白逐渐氧化形成聚集体,并且二硫键和非二硫共价键共同参与氧化聚集体的形成,这可能是由于新鲜米糠贮藏过程形成的活性脂质氧化产物具有较强共价修饰米糠蛋白的能力。
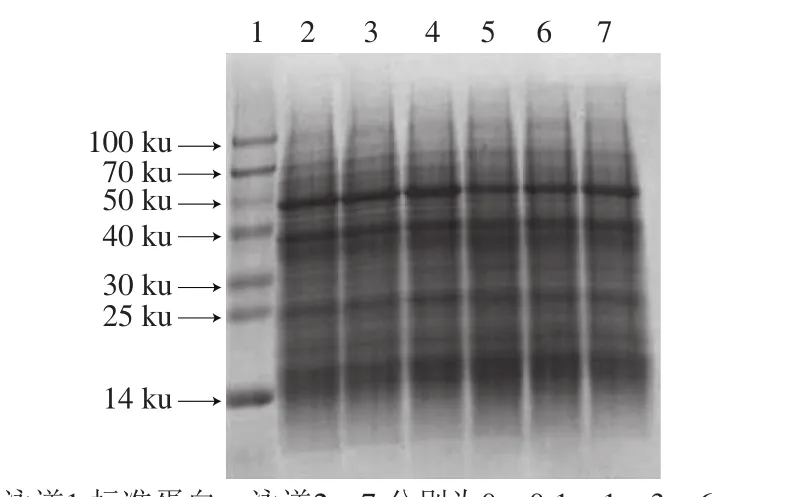
图4 不同浓度AAPH形成的过氧自由基氧化米糠蛋白电泳图Fig. 4 Electrophoresis of rice bran protein oxidatively modified by different concentrations of AAPH-derived peroxyl radicals
2.6 过氧自由基氧化对米糠蛋白分子质量分布和粒径分布的影响
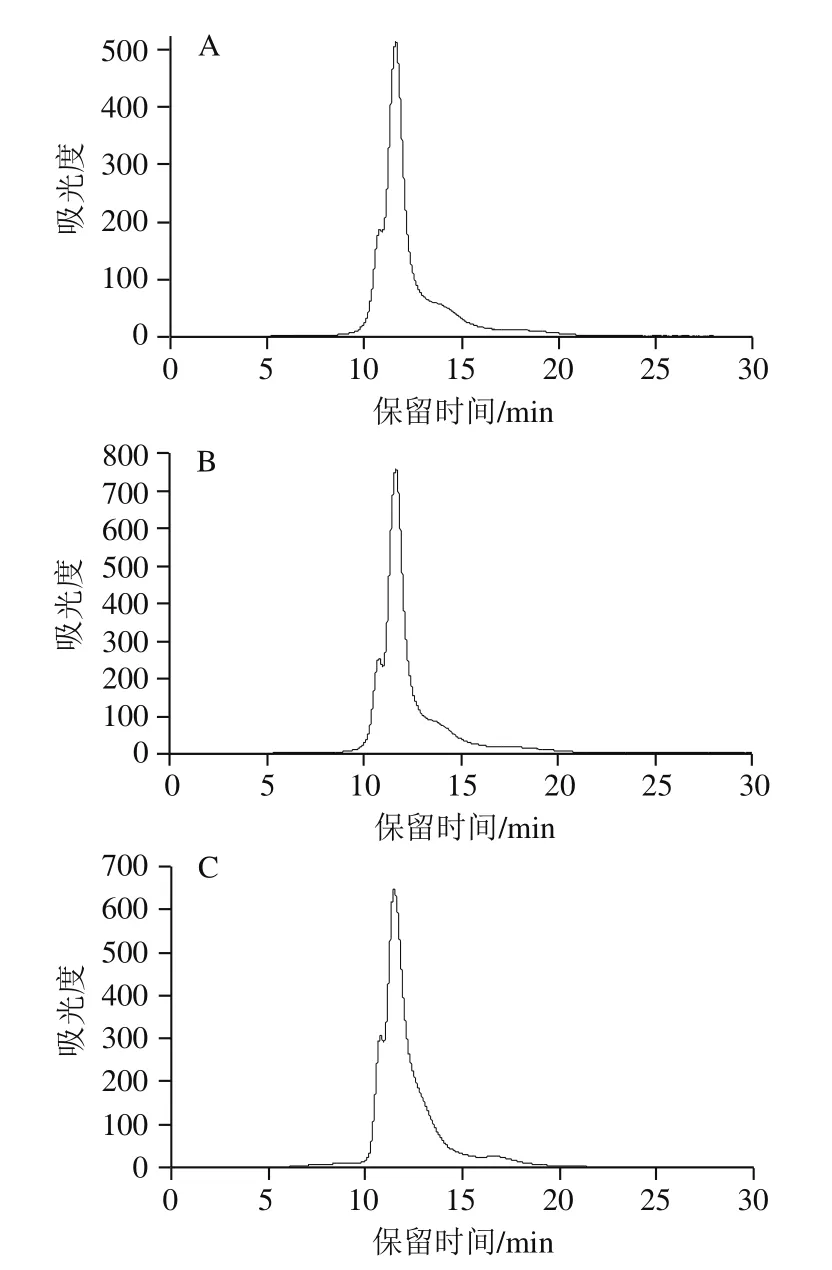
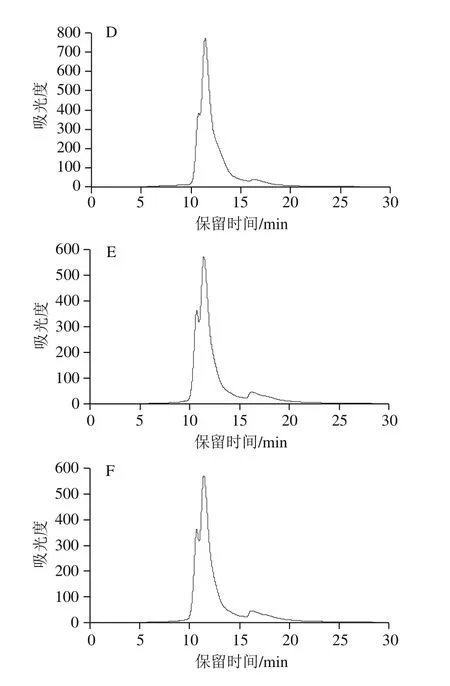
图5 不同浓度AAPH形成的过氧自由基氧化米糠蛋白分子质量分布Fig. 5 Molecular mass distribution of rice bran protein oxidatively modified by different concentrations of AAPH-derived peroxyl radicals
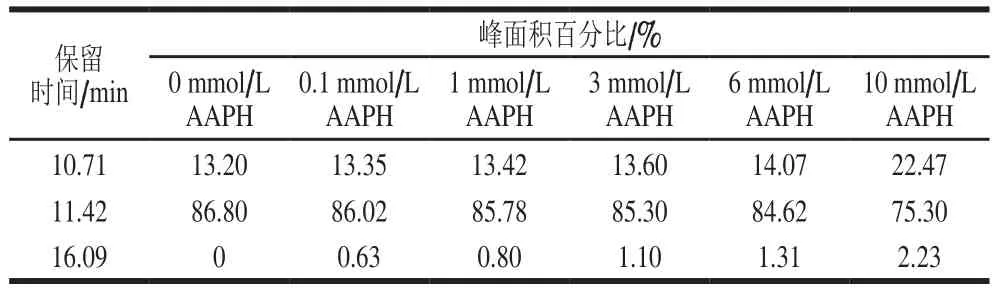
表3 过氧自由基氧化对米糠蛋白分子质量分布的影响Table 3 Effect of oxidative modification by peroxyl radicals on the molecular mass distribution of rice bran protein
如图5、表3所示,未氧化米糠蛋白(AAPH浓度为0 mmol/L)分子质量分布图中有2 个吸收峰,对应的保留时间分别为10.71 min和11.42 min。吴伟等[33-34]提取的米糠球蛋白和谷蛋白在相同的高效液相色谱条件下保留时间分别为10.81 min和11.35 min,并且由于分子质量分布图中每个吸收峰起止对应的保留时间跨度较大,因此推测保留时间10.71 min吸收峰可能是分子质量较大的米糠球蛋白、清蛋白以及米糠蛋白聚集体,保留时间11.42 min吸收峰可能是分子质量较小的米糠谷蛋白和醇溶蛋白。随着AAPH浓度的增加,米糠蛋白分子质量分布图中保留时间10.71 min峰面积百分比逐渐增加,保留时间11.42 min峰面积百分比逐渐下降,并且在保留时间为16.09 min新增一个吸收峰,对应分子质量较大的肽类物质,表明过氧自由基氧化一方面使得米糠蛋白聚集,另一方面可切断蛋白质主肽链,形成分子质量较小的肽类物质,这与Wu Wei等[12]研究过氧自由基氧化对大豆蛋白分子质量分布影响相同。吴伟等[8]在研究新鲜米糠贮藏0、1、3、5、10 d后制备米糠蛋白的分子质量分布图时发现,随着新鲜米糠贮藏时间的延长,米糠蛋白在保留时间5.70 min出峰面积百分比显著增加,保留时间5.70 min吸收峰对应分子质量在1 000 ku左右的高分子质量聚集体。这可能是由于新鲜米糠贮藏过程中除形成脂质自由基,还形成了丙二醛等其他活性脂质氧化产物,相比于活性脂质氧化产物,代表脂质自由基的过氧自由基聚集米糠蛋白能力较差。吴伟[35]在系统研究脂质氧化产物对大豆蛋白结构的影响时也发现,相比于脂质氢过氧化物和活性醛,脂质自由基氧化使得大豆蛋白形成可溶聚集体的能力最低。
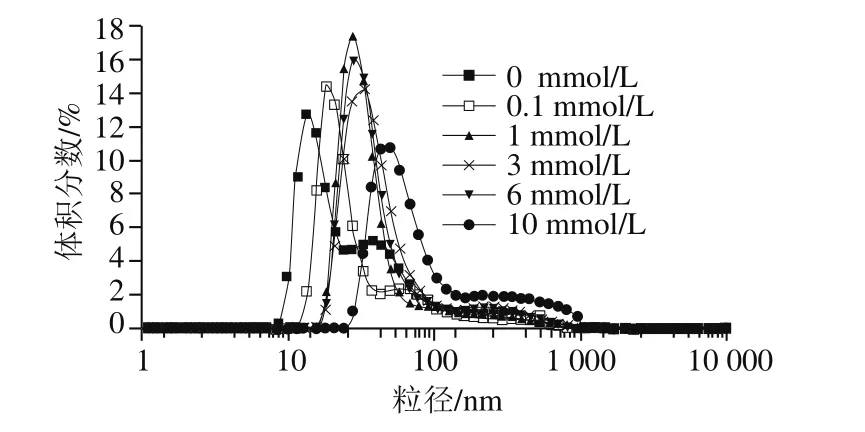
图6 不同浓度AAPH形成的过氧自由基氧化对米糠蛋白粒径分布的影响Fig. 6 Effect of oxidative modification by peroxyl radicals derived from different concentrations of AAPH on the particle size distribution of rice bran protein
如图6所示,随着AAPH浓度的增加,氧化米糠蛋白粒径分布曲线逐渐向大尺寸方向偏移,平均粒径从127.9 nm增加到179.9 nm,表明浓度逐渐增大的AAPH形成的过氧自由基导致米糠蛋白逐渐形成可溶聚集体。Ye Lin等[13]研究不同浓度AAPH氧化条件下花生蛋白的粒径分布时,也认为是花生蛋白氧化形成的可溶性聚集体导致粒径增加。
2.7 过氧自由基氧化修饰对米糠蛋白功能性质的影响
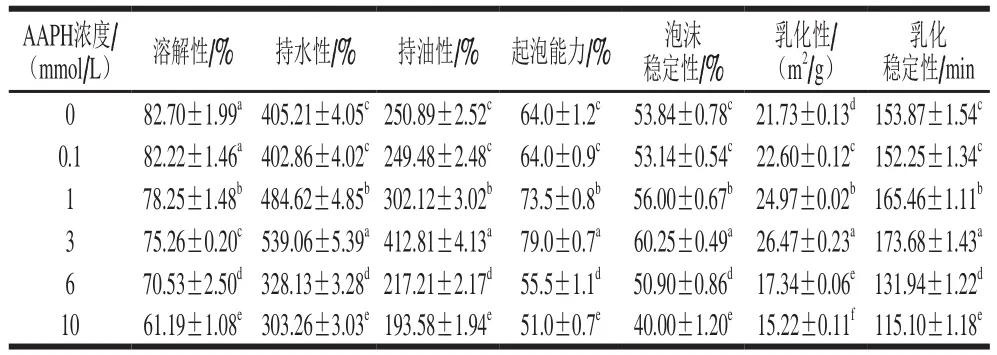
表4 不同浓度AAPH形成的过氧自由基对米糠蛋白功能性质的影响Table 4 Effect of oxidative modification by peroxyl radicals derived from different concentrations of AAPH on functional properties of rice bran protein
如表4所示,随着AAPH浓度的增加,氧化米糠蛋白的溶解性逐渐下降,氧化米糠蛋白持水性、持油性、起泡能力、泡沫稳定性、乳化性和乳化稳定性都是先增加后下降,均在AAPH浓度为3 mmol/L时达到最大值。蔡勇建等[9]在研究新鲜米糠贮藏0、1、3、5、10 d后制备米糠蛋白的功能性质变化时发现,随着新鲜米糠贮藏时间的延长,米糠蛋白溶解性逐渐下降,米糠蛋白持水性、持油性、起泡能力、泡沫稳定性、乳化性和乳化稳定性先增加后下降。由此可见,过氧自由基氧化米糠蛋白功能性质变化趋势与新鲜米糠贮藏导致蛋白质氧化时的米糠蛋白功能性质变化趋势一致。
当AAPH浓度较低时(≤3 mmol/L),米糠蛋白氧化程度较低,米糠蛋白空间结构略微展开,蛋白质分子柔性增加,此时米糠蛋白溶解性变化幅度较小,较多的水分子有机会进入米糠蛋白内部,从而增加持水性;米糠蛋白暴露出来的部分疏水基团可与脂质结合,增加其持油性;持水性和持油性的改善使得略微展开的米糠蛋白分子易于吸附到气-液界面,形成黏弹性能好和稳定性强的界面蛋白膜,从而提高米糠蛋白的起泡性质和乳化性质[9]。当AAPH浓度较高时(>3 mmol/L),米糠蛋白氧化程度较高,米糠蛋白结构展开程度加大,暴露出较多的疏水基团,暴露出的疏水基团通过疏水相互作用形成不可溶聚集体,增加米糠蛋白分子的刚性,降低米糠蛋白的结构稳定性,使得米糠蛋白溶解性、持水性和持油性显著下降,并使得米糠蛋白界面稳定性下降,从而降低米糠蛋白的起泡性质和乳化性质[9,19]。
3 结 论
以米糠蛋白为原料,采用不同浓度AAPH有氧热分解产生的过氧自由基氧化米糠蛋白,研究过氧自由基氧化对米糠蛋白结构和功能性质的影响。结果表明:随着AAPH浓度的增加,米糠蛋白羰基、二硫键、二酪氨酸含量逐渐增加,游离巯基含量逐渐减少,表明过氧自由基导致米糠蛋白发生了一定程度的氧化。随着AAPH浓度的增加,米糠蛋白二级结构组成发生较大变化,α-螺旋、无规卷曲相对含量下降,β-折叠相对含量增加,氨基酸侧链总量呈现先增加后略微下降的趋势。米糠蛋白的表面疏水性下降、内源荧光峰值下降且发生蓝移,这表明米糠蛋白色氨酸残基被氧化修饰形成聚集体。过氧自由基氧化对蛋白质亚基结构影响较小,但可使得米糠蛋白聚集,也可造成米糠蛋白主肽链部分断裂形成多肽,但过氧自由基氧化以形成米糠蛋白聚集体为主导。过氧自由基氧化引发米糠蛋白结构变化的同时,也导致其功能性质发生变化,随着AAPH浓度的增加,米糠蛋白溶解性逐渐降低,持水性、持油性、起泡能力、泡沫稳定性、乳化性和乳化稳定性均出现先上升后下降的趋势,当AAPH浓度为3 mmol/L时达到最大值。
