转录因子EB调节机制的研究进展
2019-03-06范宜俊
范宜俊 刘 伟
转录因子TFEB(transcription factor EB)作为MiT家族中最主要的因子之一,参与溶酶体的形成,溶酶体-自噬途径和溶酶体胞吐的调节。TFEB在体内广泛存在,TFEB介导的溶酶体-自噬途径的调控在神经退行性疾病、肿瘤和代谢性疾病等多种疾病的病因和治疗中都有着关键性的作用,因此对TFEB的调控机制的研究在各种疾病的治疗中也具有展望性的意义。
一、TFEB的介绍
1. MiT家族成员的介绍: MiT家族中已有四个成员被鉴定出来:MiTF(microphthalmia-associated transcription factor, MiTF),TFEB,TFE3和TFEC。MiTF/TFE的所有成员都具有对其二聚化非常重要的高度相似的碱性螺旋-环-螺旋-亮氨酸拉链(basic helix-loop-helix leucine zipper, bHLH-ZiP)结构域,bHLH-ZiP结构域介导MiT家族成员形成同源或异源二聚体,进而参与靶基因转录的激活[1]。MiTF/TFE成员形成异二聚体的过程具有严格的调控,有研究发现在MiTF/TFE成员的ZiP域内存在一个保守的三残基位移,在此引入了一个注册外的亮氨酸拉链,使得MiTF/TFE成员之间只进行特定的异二聚化,同时防止与其他的bHLH-Zip域结合。然而相比异源二聚体,MiTF/TFE的同源二聚体的功能仍然未知[2]。
2. TFEB的结构特点: TFEB是由476个氨基酸残基组成的蛋白质,主要包括富谷氨酰胺、螺旋-环-螺旋(helix-loop-helix, HLH)、亮氨酸拉链(leucine-zipper, LZ)和富脯氨酸等模体。TFEB能以二聚体的形式与DNA结合,通过识别启动子 E-box、M-box启动相应基因的转录,发挥其生理功能。最初TFEB被确定为MiTF/TFE家族中具有调节众多溶酶体和自噬基因表达能力的唯一成员,广泛表达于各类细胞,参与多种生物功能,近年来发现MiTF/TFE家族中的另一成员TFE3在应激条件下的部分组织中对溶酶体自噬也有着调节作用[3]。
二、TFEB的功能
1. TFEB对溶酶体基因表达的调控: 溶酶体是进行细胞降解和系统回收的重要组成部分,是维持细胞稳态的必要条件[4]。最初溶酶体被描述为降解细胞内废物的静态细胞器,但后来认为溶酶体可以通过调节基因的表达调节其生物的合成与功能[5]。Sardiello等[5]对溶酶体基因的启动子分析得到E-box样回文序列(GTCACGTGAC)即协调溶酶体表达和调控(coordinate lysosomal expression and regulation, CLEAR)元件的基序,显示CLEAR元件直接与TFEB的bHLH转录因子结合。因此,TFEB的表达将会导致溶酶体的数量增加和效能升高,从而增强溶酶体的分解代谢活性。TFEB能诱导溶酶体的胞吐作用,Medina等[6]发现TFEB通过激活Ca2+通道蛋白MCOLN1可使Ca2+流入细胞内,促使溶酶体与质膜融合。溶酶体贮积症时TFEB的过表达可促使细胞内的代谢废物排至细胞外。
2. TFEB对细胞自噬的调控: TFEB与自噬基因的启动子区结合,诱导自噬体的生物合成和自噬体-溶酶体融合以及自噬底物的降解[6]。以此为基础,TFEB在缓解肝毒性药物造成的肝脏损伤[7]、治疗糖尿病患者的肾脏损害[8-9]和增强胃肠道肿瘤的治疗效果和预后恢复等方面都起着非常重要的作用[10-11]。
TFEB过表达可促进体内脂滴的清除和线粒体损伤的降解,表明该转录因子在调节细胞器特异性自噬如脂肪自噬和线粒体自噬中也起作用[12]。Uchida等[13]发现在对大鼠静脉内注射脂多糖后导致的炎症反应中,TFEB的激活所诱导的细胞自噬在角膜细胞防御中起到了重要作用。TFEB能通过诱导溶酶体激活来调节免疫功能,TFEB激活后会抑制MHC Ⅰ类介导的外源性抗原表达,同时增强MHC Ⅱ类呈递抗原,进而影响树突状细胞通过MHC途径与T细胞结合呈递外源性抗原的过程来影响免疫应答[14]。最近发现,在乙醇诱导的肝脏损伤模型小鼠中组织的总TFEB和核TFEB水平低于正常组,溶酶体的生物合成能力降低,而Torin-1(mTOR活性抑制剂)作用后可以提高肝组织的TFEB水平,降低乙醇对肝的损伤和脂肪变性,提示提高TFEB水平可能将对乙醇所致的酒精性脂肪肝起到保护作用[15]。
三、TFEB的调控
转录因子TFEB进入胞核后调控下游基因的表达,广泛参与各种生理病理活动。其自身的核转位也受到体内外各种蛋白分子的调节。
1. 雷帕霉素复合物1对TFEB的调控: 一般来说,正常状态下TFEB以非活性状态存在于胞质中[16],而在饥饿或溶酶体功能出现障碍时,TFEB迅速转位至细胞核并激活其下游靶基因的转录。TFEB的细胞定位和活性状态与其是否磷酸化有着密切的关系。TFEB蛋白中的两个特定的丝氨酸残基(即Ser142[17-18]和Ser211[17,19-20])在TFEB的亚细胞定位中发挥关键作用。当这两个丝氨酸残基都被磷酸化时,TFEB在胞质中保持无活性状态[19-20],并且磷酸化的Ser211会与伴侣蛋白14-3-3结合后停留在胞质中,抑制TFEB的核转位[20]。
哺乳动物雷帕霉素复合物1(mTORC1)和细胞外信号调节激酶2(ERK2,也称为MAPK1)是饥饿条件下能使大多数细胞内的TFEB去磷酸化的主要蛋白激酶[20-21]。Sancak等[22-23]发现mTORC1的激活发生在溶酶体膜上。在营养物质充足的情况下,V-ATPase复合物促进溶酶体信号复合物小Rag GTP蛋白的活化,mTORC1的组件Raptor与激活的Rag GTPases结合,并被募集到溶酶体膜上,通过GTPase Rheb促进其活性。同时大量的TFEB也被活化的Rag GTP蛋白复合物募集到溶酶体膜上,通过mTORC1促进TFEB的S142、S211位点磷酸化[24]。当机体转于饥饿状态或应激时,溶酶体腔内的氨基酸含量降低使Rag GTPases失活,mTORC1变得无活性并随后从溶酶体膜释放,TFEB的S142、S211位点失去抑制并去磷酸化,与伴侣蛋白14-3-3分离。去磷酸化的TFEB进入胞核与核内CLEAR序列结合,促进下游溶酶体基因的表达,增强溶酶体的生物合成及生理功能[25],见图1。
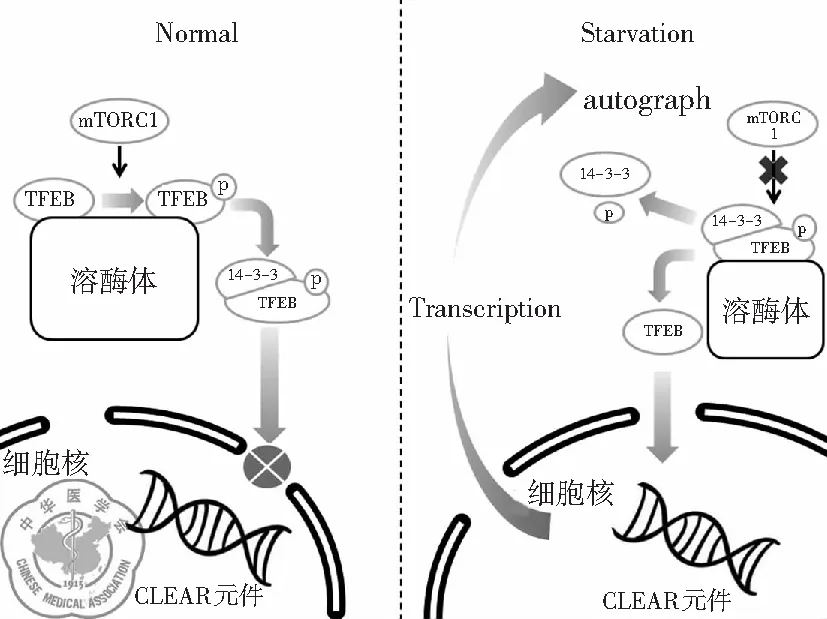
图1 mTORC1对TFEB的调控
2. 外源性氧化剂的负反馈调节: Medina等[26]发现溶酶体基因表达的过程伴随着溶酶体内的Ca2+而发生。变化通过Ca2+通道黏脂蛋白1(mucolipin1, MCOLN1)释放入胞浆激活磷酸酶、钙调磷酸酶,钙磷酸酶又将TFEB去磷酸化并促进其向核移位。当MCOLN1减少时,则会抑制溶酶体Ca2+释放和钙调磷酸酶活化,从而阻止营养物剥夺时TFEB去磷酸化和自噬。这也暗示了通过调节胞浆Ca2+的含量也可以间接调控溶酶体的活性。外源性氧化剂或增加的线粒体内活性氧(reactive oxygen species, ROS)水平例如鱼藤酮、过氧化氢或羰基氰化物间氯苯腙(carbonyl cyanide m-chlorophenylhydrazone, CCCP)等可特异性地激活溶酶体TRPML1通道[27],诱导溶酶体Ca2+释放,诱导自噬和溶酶体合成[25]。因此TRPML1是位于溶酶体膜上的ROS传感器,调节ROS水平可以协调自噬依赖性负反馈程序以减轻细胞中的氧化应激损伤和增强溶酶体的功能[25]。
3. TFEB的丝氨酸残基位点改变带来的影响: 最近的研究还表明,TFEB的另一个临界位点Ser122对于通过mTORC1调节的TFEB亚细胞定位非常重要。具体地讲,经抑制mTORC1后的TFEB核定位被TFEB的Ser122突变阻断,这种突变也抑制了Torin1所诱导的溶酶体生物合成。这揭示了mTORC1调节TFEB的新机制,表明mTORC1对溶酶体生物发生至关重要[21]。
上述信号级联放大反应强调了溶酶体作为信号枢纽的核心作用,该信号中枢能够感知营养物的可用性并协调转录程序的激活,从而允许细胞不断调整以适应逐步增长的代谢需求。许多可以调节TFEB活性的因子,如大多数v-ATPase亚基,Ca2+通道MCOLN1都位于溶酶体上,这表明溶酶体适应环境变化是一种受多个反馈回路共同调节的自我维持反应。
4. 细胞外信号调节激酶2对TFEB的调控: 同样的,在细胞营养充足的情况下,丝裂原活化蛋白激酶1(mitogen-activated protein kinase 1, MAPK1)家族的细胞外信号调节激酶2(extracellular signal regulated kinase 2, ERK2)介导TFEB的ser142磷酸化,使TFEB定位在胞质内。而在饥饿状态下时,ERK2与TFEB解离,TFEB去磷酸化后进入胞核中,促进微管相关蛋白1A/1B轻链3B(microtubule-associated proteins 1A/1B light chain 3B, MAPLC3B)、液泡分拣蛋白11(vacuolar protein sorting 11, VPS11)的合成和自噬相关基因9B(autophagy-related gene 9B, ATG9B)的表达[28]。
5. 蛋白激酶对TFEB的调节: 在营养充足的状态下,细胞可通过介导自身内外界信号蛋白激酶C信号通路(PKC signaling pathway)促进MiTF/TFE的表达、溶酶体的合成和自噬底物的降解[29]。巨大戟烷型二萜类化合物中的HEP14和HEP15可以激活蛋白激酶C(protein kinase C, PKC)家族的成员PKCα和PKCδ,导致糖原合成激酶3β(glycogen synthase kinase-3β, GSK3β)失活,使得GSK3β对TFEB上第134和138位的丝氨酸位点的磷酸化作用解除,TFEB去磷酸化激活入核,促进溶酶体的生成。除了通过解除对TFEB的磷酸化来增强自噬外,被HEP激活后的PKCα可以通过激活胞内的c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)和p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase, p38MAPK)使溶酶体相关的抑制因子含KRAB和SCAN3结构域的锌指蛋白(zine finger protein with KRAB and SCAN domains, ZKSCAN3)失去活性并移位至细胞质中,解除ZKSCAN3对溶酶体合成的抑制作用[30-31]。用核因子κB配体受体激活剂(RANKL)刺激骨细胞后,TFEB的C末端区域的三个丝氨酸残基被蛋白激酶Cβ(PKCβ)磷酸化,保证了溶酶体生物合成的稳定性[32]。
蛋白激酶B(Akt)磷酸化TFEB Ser467位点并以独立于mTORC1的机制抑制TFEB核转位。自噬增强剂海藻糖通过减少Akt活性来激活TFEB。Batten病是一种神经元内的溶酶体产生的蜡样脂褐质存积的神经变性疾病,将海藻糖给予患Batten病的小鼠模型可增强蛋白脂质聚集体的清除,可以减少神经病理的发生并延长患病小鼠的存活[33]。Akt的药理作用可促进患有各种溶酶体疾病患者细胞中蛋白脂质体的清除,并提示该方法的广泛适用性。这些发现为TFEB介导的神经退行性储存疾病中细胞蛋白脂质体的清除开辟了新的思路[34]。此外,对于TFEB旁系同源物,MiTF和TFE3也观察到有类似的结果[3]。
6. 姜黄素的衍生物C1对TFEB的调节: 合成姜黄素的衍生物C1被鉴定为TFEB的新型活化剂。化合物C1与TFEB的N末端特异性结合并促进TFEB核转位,证实化合物C1在体内外增强自噬和溶酶体生物合成。并且化合物C1是TFEB的有效口服活化剂,是用于治疗神经变性疾病的潜在治疗剂[35]。随后发现槲皮素也有着类似的作用,槲皮素能够逆转乙醇对TFEB核转位的抑制作用,并表现出与Torin 1相似的作用,可促进TFEB的核转位,改善由乙醇导致的溶酶体自噬功能障碍[36]。
自噬作为细胞稳态的重要功能,广泛参与了各种生理病理过程。MiTF/TFE转录因子通过对溶酶体-自噬途径中相关基因的调节,成为细胞内能量调控和细胞清除的主要调节因子。正常细胞通过对MiTF/TFE的调控维持自身的稳态和营养平衡,但是进一步机制的研究仍需要探清各种内外界刺激和多种抑制信号如何作用于不同类型的细胞而产生不同的应激反应。TFEB介导的溶酶体-自噬的调控与多个系统和功能相关,对细胞内TFEB调节机制的研究,不仅有助于阐述局部炎症反应、免疫调节功能和神经系统性疾病可能的分子机制,也为以后对人体各种疾病的临床治疗和预防提供了一个新的方向和理论依据。
