ATP7A 对结肠癌细胞耐奥沙利铂的机制初探
2019-02-23余文燕王国娟许建华王桦影范忠泽
余文燕 王国娟 许建华 王桦影 范忠泽
1江西中医药大学中医基础理论分化发展研究中心(江西省中医病因生物学重点实验室,No.JA009500)(南昌330004);2江西中医药大学附属医院肿瘤科(南昌330006);3上海中医药大学附属普陀医院肿瘤科(上海200062)
结肠癌是一种高发病率的消化系恶性肿瘤[1],目前化疗是主要治疗方法,奥沙利铂(LOHP)是近年来被推荐的Ⅱ、Ⅲ期结直肠癌的一线化疗药物,但肿瘤细胞对其极易产生耐药,严重影响了其疗效,从而降低患者生存率,因此,探讨结肠癌耐药的机制并寻找有效靶点是当前结肠癌研究中的热点和难点。
ATP7A 是铜转运泵出蛋白,定位于细胞的高尔基体上,属于铜离子转运磷酸化ATP 酶,具有催化ATP 分解、诱导铜离子运输和排泄功能[2-4],正常情况下,铜伴侣蛋白ATOX1 将铜输送至高尔基体,而当细胞内环境中的铜水平偏高时,定位于高尔基体的ATP7A 和ATP7B 则会在ATOX1 的作用下迁徙到细胞膜上,将多余的铜泵出细胞外,而当铜稳态恢复正常时ATP7A 和ATP7B 则又回到高尔基体上[5-6]。近年研究发现[7-8]ATP7A 参与铂离子转运,且在肿瘤铂类耐药中发挥重要的作用,最突出的是可以从癌细胞中向外转运抗癌药物,使机体产生耐药性,可能是临床肿瘤耐药的一个重要靶点。
目前国内外尚未见ATP7A 对耐奥沙利铂的人结肠癌细胞HCT116/L-OHP 增殖及凋亡作用机制的研究报道,本课题组前期研究发现,该蛋白在HCT116/L-OHP 细胞中高表达,可能是防治结肠癌的有效靶点,故以RNA 干扰为首要技术成功构建ATP7A 稳 转 细 胞 株siATP7A-HCT116/L-OHP 和 阴性对照空转细胞株negATP7A-HCT116/L-OHP,为进一步探讨其具体机制是否与HCT116/L-OHP 细胞增殖、凋亡及调控铜转运相关蛋白有关,本实验通过MTT 比色法、Annexin V-PE 染色法和免疫印迹法观察沉默ATP7A 蛋白后是否能增强细胞对LOHP 的敏感性从而抑制其增殖及凋亡,以进一步明确ATP7A 对结肠癌细胞的耐药机制,有望成为结肠癌防治的有效靶点,为肿瘤防治提供实验依据。
1 材料与方法
1.1 细胞株 ATP7A 沉默稳转细胞株siATP7AHCT116/L-OHP 及阴性空转染细胞株negATP7AHCT116/L-OHP 均由课题组前期成功构建,存放于江西省中医病因生物学重点实验室(江西中医药大学中医基础理论分化发展研究中心)。
1.2 实验用药 奥沙利铂(L-OHP,江苏恒瑞医药股份有限公司,规格50 mg/支,批号:H20000686)。
1.3 试剂 RPMI 1640 培养基(GIBCO 公司,批号:507766);噻唑蓝(MTT,Sigma 公司,批号:M2128-1G);Annexin V-FITC/PI 双染法细胞凋亡检测试剂盒(上海美吉生物技术有限公司,批号分别为MbchemTM:M3021);ATP7A 一抗(美国abcam 公司,规格0.001 g·mL-1,批号:ab42486);ATP7B 一抗(EPITOMICS,规格100 μg,批号:Catalog#T1420),BCA 蛋白浓度测定试剂盒(碧云天生物技术研究所,批号:P0012);ATOX1 一抗(NBP1-06611SS,规格0.025 mL,批号:Swiss-Prot #O00244),CTR1一抗(EPITOMICS,规格100 μL,批号:Catalog #5773-1);RIPA 裂解液,考马斯亮蓝蛋白定量试剂盒,彩色预染超高分子蛋白质marker(武汉博士德生物工程有限公司,批号分别为AR0105-30,AR0145,AR1118),β-肌动蛋白鼠单克隆抗体(β-Actin Mouse Monoclonal antibody,美 国Affinity 公司,批号:T0022);二甲基亚砜(DMSO,北京索莱宝科技有限公司,批号:CAS 67-68-5);胰蛋白酶(solarbio 公司,批号:T8150);HRP-羊抗兔IgG酶标二抗(北京康为世纪有限公司,批号:CW0102)。胎牛血清(杭州四季青生物工程公司,批号:090501)。
1.4 仪器 5424R 型小型台式高速冷冻离心机(德国艾本德公司),Milli-Q AdvantageA10 型超纯水仪(默克密理博公司),SPARK 10M型全自动酶标仪(瑞士Tecan 公司),ZDX 型恒温培养摇床(江苏万华公司),Mini-PROTEAN Tetra Electrophoresis System 165-8001 型电泳转印仪(美国Bio-Rad 公司),ChemiDoc XRS + 型化学发光凝胶成像系统(美国Bio-Rad 公司)。3111 型CO2培养箱(美国Thermo Fisher Scientific 公司),MoFlo XDP型流式细胞仪(美国Beckman Coulter 公司)。
1.5 细胞培养 ATP7A 沉默稳转细胞株siATP7AHCT116/L-OHP 及阴性空转染细胞株negATP7AHCT116/L-OHP 均培养于含10%胎牛血清以及0.1 U/L 青霉素和0.05 mg/L 链霉素的RPMI 1640 培养基,置于37 ℃、5%CO2孵箱内,且培养液中含10 mg/L L-OHP 以维持耐药性,2~3 d 换液。
1.6 给药剂量的确定 L-OHP 用药浓度选用48 h 1/3 IC50即28.6 μg/mL。
1.7 实验分组 实验共分为4 个组,分别为阴性空转染细胞株negATP7A-HCT116/L-OHP 和ATP7A沉默后的稳转细胞株siATP7A-HCT116/L-OHP 的空白组及L-OHP 用药组。
1.8 细胞活性检测 消化对数生长期的HCT116细胞,以5 × 104个/mL 的浓度接种于96 孔板中,100 μL 于每孔,细胞贴壁后每孔 加药100 μL,同时设调零组,每种药物浓度均设5 个复孔,培养48 h,后以MTT :孔内液体量= 1∶10 的比例加入5 g/L MTT 10 μL,继续培养4 h 后,吸弃孔内液体,每孔加入150 μL DMSO ,振荡10 min 后于测定各孔的光吸收值(OD 值,490 nm 波长),计算细胞抑制率,实验均重复3 次,细胞增殖抑制率(%)=[1-(实验孔OD 值-调零孔OD 值)/(对照孔OD值-调零孔OD 值)]×100%。
1.9 Annexin V-FITC染色法检测细胞凋亡 取对数生长期的negATP7A-HCT116/L-OHP和siATP7AHCT116/L-OHP 细胞,调整密度至5×104个/mL,细胞接种于6 孔板内,2 mL/孔,根据实验方案,每组3 个复孔,用药48 h 后消化细胞,离心,弃上清,重复洗涤2 次。按试剂盒说明处理后用上机检测。
1.10 细胞内ATP7A 蛋白表达检测 细胞核蛋白与细胞浆蛋白抽提按照碧云天(Beyotime)试剂盒说明书提取,检测蛋白浓度按BCA 试剂说明书进行。制备裂解液,堆积胶,分离胶,蛋白样品,蛋白变性,离心,上样,电泳、半干转膜,封闭,加入目的蛋白ATP7A、ATP7B、ATOX1、CTR1 及内参蛋白βactin 一抗,抗原抗体结合。摇床过夜;第2 天,用TTBS 洗膜,加入HRP 标记的二抗以结合一抗及HRP 标记的抗生物素抗体,在暗室中将荧光底物A 和B 两种试剂等体积充分混合,显影,拍照,以目的蛋白的灰度值/ 相应内参蛋白的灰度值作为比较量进行比较。
1.11 统计学方法 各组数据采用SPSS 19.0 软件进行统计分析,计量资料以均数±标准差表示,数据均以正态分布,若方差不齐,采用单因素方差分析Dunnett's T3进行两两比较,若方差齐,采用单因素方差分析LSD-t检验进行两两比较,以P<0.05 为差异有统计学意义。
2 结果
2.1 对细胞增殖的影响 结果显示:不同浓度L-OHP 对细胞抑制率(%)从小到大依次分别为(-8.51±58.52)、(25.37±6.19)、(32.72±2.92)μg/mL、(53.81 ± 6.96)、(72.23 ± 3.32)、(93.37 ± 2.82),IC50(μg/mL)由(85.81±2.76)降至(41.30±3.31),逆转耐药2.07 倍。实验结果表明ATP7A 能不同程度的降低HCT116/L-OHP 对L-OHP 的敏感性,促进HCT116/L-OHP 增殖,增强HCT116/L-OHP 对铂类药的耐药指数,而沉默该蛋白表达能不同程度逆转HCT116/L-OHP 对L-OHP 的耐药,见表1。
2.2 ATP7A 对HCT116/L-OHP 细胞凋亡的影响 流式细胞仪分析结果显示,ATP7A 沉默前后negATP7A-HCT116/L-OHP 和siATP7A-HCT116/LOHP 细胞空白组48 h 凋亡率分别为(1.4 ± 0.1)%和(4.47 ± 0.15)%,L-OHP 组细胞凋亡率分别为(4.97 ± 0.06)% 和(25.87 ± 0.21)%。与空白组相比,各细胞L-OHP 用药组凋亡率均显著升高(P<0.001);与ATP7A 沉默前negATP7A-HCT116/LOHP 细胞相比,同一组别(空白组或L-OHP 组)ATP7A 沉默后siATP7A-HCT116/L-OHP 细胞凋亡率均显著升高(P<0.001),说明ATP7A 能抑制HCT116/L-OHP 细胞凋亡,且能抑制铂类药起作用。见表2和图1。
表1 48 h L-OHP 作用于negATP7A-HCT116/L-OHP、siATP7A-HCT116/L-OHP 抑制率Tab.1 Effects of 48 h L-OHP on proliferation of negATP7AHCT116/L-OHP and siATP7A-HCT116/L-OHP cells ±s,%
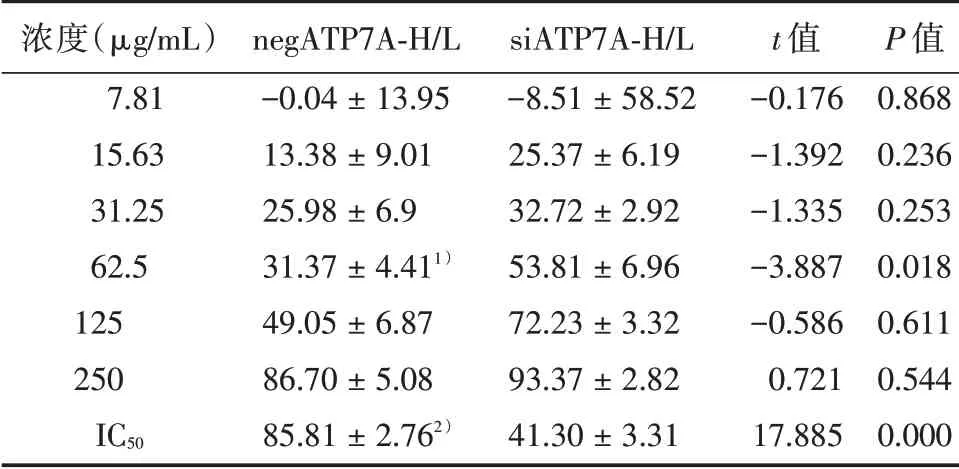
表1 48 h L-OHP 作用于negATP7A-HCT116/L-OHP、siATP7A-HCT116/L-OHP 抑制率Tab.1 Effects of 48 h L-OHP on proliferation of negATP7AHCT116/L-OHP and siATP7A-HCT116/L-OHP cells ±s,%
注:与siATP7A-H/L 细胞相比,1)P<0.05,2)P<0.01
浓度(μg/mL)7.81 15.63 31.25 62.5 125 250 IC50 negATP7A-H/L-0.04±13.95 13.38±9.01 25.98±6.9 31.37±4.411)49.05±6.87 86.70±5.08 85.81±2.762)siATP7A-H/L-8.51±58.52 25.37±6.19 32.72±2.92 53.81±6.96 72.23±3.32 93.37±2.82 41.30±3.31 t 值-0.176-1.392-1.335-3.887-0.586 0.721 17.885 P 值0.868 0.236 0.253 0.018 0.611 0.544 0.000
表2 48 h L-OHP 作用于negATP7A-HCT116/L-OHP、siATP7A-HCT116/L-OHP 凋亡率Tab.2 Effects of 48 h L-OHP on apoptosis of negATP7AHCT116/L-OHP and siATP7A-HCT116/L-OHP cells ±s
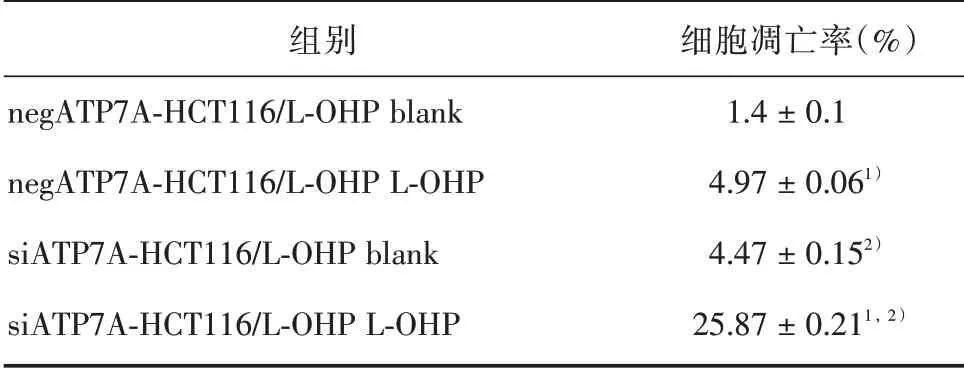
表2 48 h L-OHP 作用于negATP7A-HCT116/L-OHP、siATP7A-HCT116/L-OHP 凋亡率Tab.2 Effects of 48 h L-OHP on apoptosis of negATP7AHCT116/L-OHP and siATP7A-HCT116/L-OHP cells ±s
注:同一细胞内,与空白组相比,1)P<0.001;同一组别,与negATP7A-H/L 细胞相比,2)P<0.001
细胞凋亡率(%)1.4±0.1 4.97±0.061)4.47±0.152)25.87±0.211,2)组别negATP7A-HCT116/L-OHP blank negATP7A-HCT116/L-OHP L-OHP siATP7A-HCT116/L-OHP blank siATP7A-HCT116/L-OHP L-OHP
2.3 ATP7A 对HCT116/L-OHP 细胞蛋白的影响 通过Western blot 检测发现,与negATP7AHCT116/L-OHP 细 胞L-OHP 组 相 比,siATP7AHCT116/L-OHP 细胞L-OHP 组内除CTR1 蛋白上调外,ATP7A、ATP7B、ATOX1 蛋白均呈不同程度的下调(P<0.001);与negATP7A-HCT116/L-OHP 细胞blank 组相比,negATP7A-HCT116/L-OHP 细胞LOHP 组中ATP7A、ATP7B、ATOX1 蛋白均显著下调(P<0.05);与siATP7A-HCT116/L-OHP 细胞blank组 相 比,siATP7A-HCT116/L-OHP 细 胞L-OHP 组中,除CTR1 蛋白显著上调外,ATP7A、ATP7B、ATOX1 蛋白均显著下调(P<0.05),见表3。结果表明,沉默ATP7A 蛋白在HCT116/LOHP 细胞中表达,能显著下调ATP7A、ATP7B、ATOX1 蛋白表达,上调CTR1 蛋白表达。
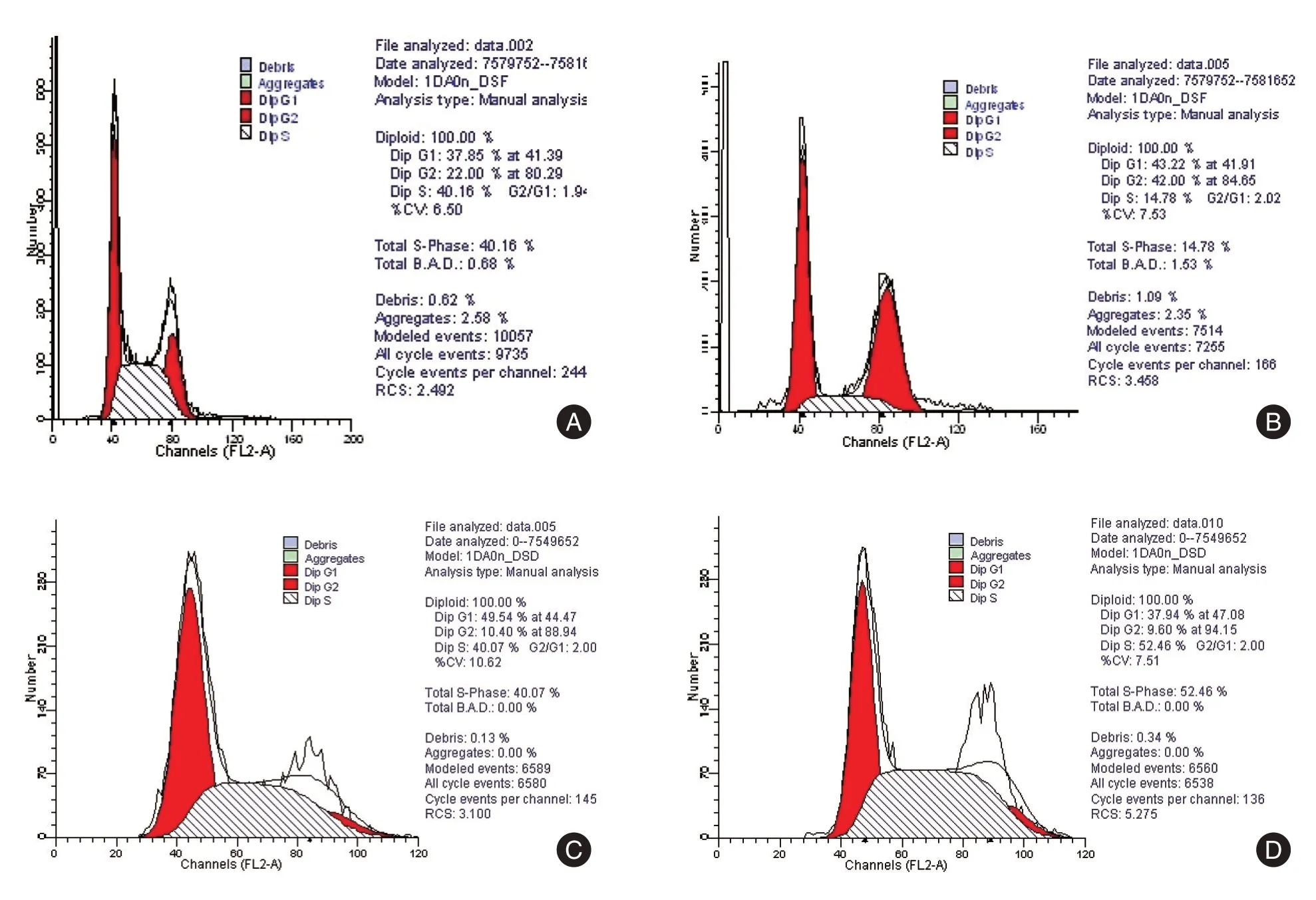
图1 48 h L-OHP 作用于negATP7A-HCT116/L-OHP、siATP7A-HCT116/L-OHP 凋亡率Fig.1 Effects of 48 h L-OHP on apoptosis of negATP7A-HCT116/L-OHP and siATP7A-HCT116/L-OHP cells
表3 ATP7A 沉默前后对铜转运相关蛋白在HCT116/L-OHP 中蛋白表达的影响Tab.3 Effects of ATP7A on the expressions of copper proteins in HCT116/L-OHP cells ±s
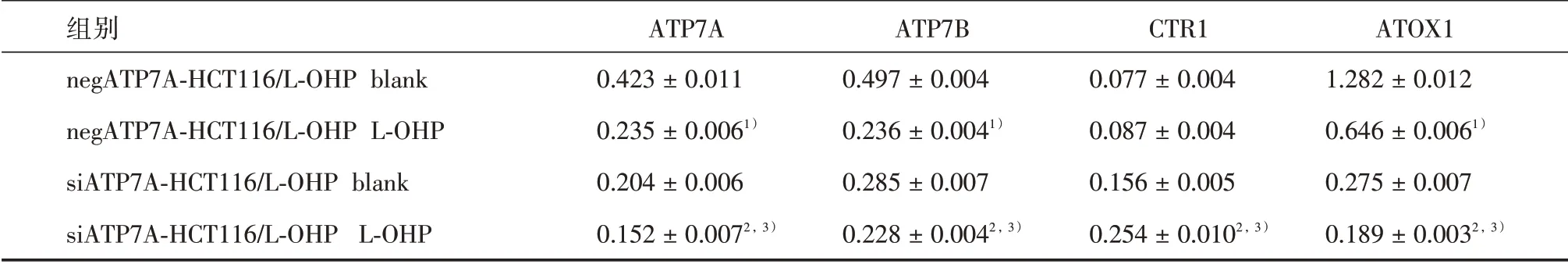
表3 ATP7A 沉默前后对铜转运相关蛋白在HCT116/L-OHP 中蛋白表达的影响Tab.3 Effects of ATP7A on the expressions of copper proteins in HCT116/L-OHP cells ±s
注:与同一细胞空白组相比,1)P<0.05,2)P<0.01;同一蛋白与ATP7A 沉默前细胞相比,3)P<0.001
组别negATP7A-HCT116/L-OHP blank negATP7A-HCT116/L-OHP L-OHP siATP7A-HCT116/L-OHP blank siATP7A-HCT116/L-OHP L-OHP ATP7A 0.423±0.011 0.235±0.0061)0.204±0.006 0.152±0.0072,3)ATP7B 0.497±0.004 0.236±0.0041)0.285±0.007 0.228±0.0042,3)CTR1 0.077±0.004 0.087±0.004 0.156±0.005 0.254±0.0102,3)ATOX1 1.282±0.012 0.646±0.0061)0.275±0.007 0.189±0.0032,3)
3 讨论
奥沙利铂(L-OHP)是中晚期大肠癌化疗的首选药物之一,是继顺铂、卡铂后推出的第三代铂类化疗药,能同时抑制对顺铂、卡铂耐药的大肠癌细胞株。其作用主要是通过与细胞核内基因DNA 结合形成铂-DNA 加合物,干扰正常DNA 的复制与转录,产生细胞毒作用,从而促进肿瘤细胞死亡。但大肠癌细胞对L-OHP 亦会产生耐药[9],从而限制了该药的临床运用,严重影响了含铂化疗方案的收效。目前,肿瘤铂类耐药的机制主要体现在肿瘤细胞内铂蓄积、细胞解毒以及DNA 损伤修复等方面[10]。
目前有研究[11]报道细胞内铜稳态的失衡会影响到胞内铂蓄积,而铜稳态的调节系统主要由铜转运蛋白完成。众所周知,铜是人体必需的微量元素,组织参与细胞内各种生理生化反应,而铜转运蛋白是一类重金属转运P 型ATP 酶,能与铜离子结合协助运送至靶蛋白,并参与维持胞浆内铜浓度,包括泵入蛋白CTR1 和泵出蛋白ATP7A、ATP7B,均广泛存在于各种生物体内[12]。铜转运蛋白导致部分肿瘤铂类耐药的机制可能是通过参与铂离子转运,调节铂类药的摄入与流出,从而将细胞内多余的铂离子泵出细胞外,最终导致肿瘤细胞对铂类药的耐药性。铜转运调节系统在抗肿瘤的铂类化疗药中发挥着重要的作用[13],而ATP7A 对于维持铜稳态起着重要的作用,可能是临床肿瘤耐药的一个重要靶点[14]。
本实验前期研究发现,ATP7A 在HCT116/LOHP 细胞中高表达,可能是防治结肠癌的有效靶点,在成功构建ATP7A 稳转细胞株siATP7AHCT116/L-OHP 和阴性对照空转细胞株negATP7AHCT116/L-OHP 之后,为进一步探讨其具体机制是否与HCT116/L-OHP 细胞增殖、凋亡及调控铜转运相关蛋白有关,本实验通过MTT 比色法、Annexin V-PE 染色法和免疫印迹法探讨了ATP7A 在人结肠癌铂类耐药中的作用,研究发现沉默ATP7A 可以增强结肠癌耐药细胞HCT116/L-OHP 对奥沙利铂的敏感性,促进细胞凋亡,调节铜转运相关蛋白的表达,表明ATP7A 可能是人结肠癌铂类耐药的重要机制之一,有望成为结肠癌耐药的重要治疗靶点。本实验仅阐释了ATP7A 促结肠癌奥沙利铂耐药的部分微观机理,其具体分子生物学作用机制有待今后的深入挖掘,今后将进一步完善结肠癌相关耐药机制研究,为推广结肠癌耐药有效靶点奠定实验基础,造福患者。
