固氮微生物对鳗草植株生长及其根际土壤酶活性的影响❋
2019-02-21张雪梅张秀梅张沛东李文涛
张雪梅, 张秀梅, 2, 张沛东, 王 琦, 李文涛❋❋
(1.海水养殖教育部重点实验室(中国海洋大学),山东 青岛 266003;2.青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室,山东 青岛 266072)
随着海草床生境退化的加剧及人们对其生态功能认识的加强,世界沿海国家相继开展了海草床退化生境的修复工作,其中植株移植法是主要修复方法之一[1],与此相关的研究报道多集中在移植方法[2-3]、移植时间[4]及环境因子对移植效果的影响[5-6]等方面,对于移植鳗草幼苗人工促繁策略的研究较少。而研究表明,合适的人工促繁手段能有效促进移植植株的繁殖、存活及生长[7],这对于减少天然供体使用量、促进移植修复效果等具有极大的应用价值。
生物固氮在氮素的生物地球化学循环中发挥着重要作用。固氮微生物不仅能够通过生物固氮作用将大气中的氮气转化为含氮化合物,从而在一定程度上缓解氮缺乏对植物初级生产力的限制,其代谢产物在促进植物生长[8-9]、生物病害防治[10]等方面也具有显著作用,目前已被广泛应用于主要经济及生态物种。Anjali等[8]研究证实,Aneurinibacillusaneurinilyticus具有除固氮功能外的多种植物促生特性且能显著增加番茄(Solanumlycopersicum)营养吸收速率,促进番茄生长。姚拓等[11]利用稳定同位素稀释法研究发现,固氮菌能显著增加燕麦(Avenasativa)固氮量,促进燕麦生长。也有研究表明,海草叶片表面及根茎周围同样附着大量微生物,是海草床生态系统的重要组成部分[12]。但目前对海草床固氮微生物的研究多集中在群落组成和结构多样性[13-14]、固氮量贡献[15-16]及影响因素[17-18]等方面,而将固氮微生物应用于海草床退化生境修复的研究实例极少。
鳗草(ZosteramarinaL.)属鳗草科(Zosteraceae)鳗草属(Zostera),主要分布在温带海域浅海区[19]。近年来由于自然环境变化和人类活动影响,全球范围内鳗草资源严重衰退。本研究针对鳗草移植修复过程中的人工促繁问题,通过外源固氮菌接种实验,探究其对鳗草植株存活、生长、生理及根际土壤酶活力的影响,为深入研究高效固氮菌株功能与代谢调控及其在鳗草植株人工促繁中的作用提供基础资料。
1 材料和方法
1.1 实验材料
1.1.1 供试菌株 实验用固氮菌菌株分离自山东省威海市天鹅湖鳗草根际土壤,其中Bacilusfirmus3A与Thalassospirasp. 4G为王琦等[12]分离保存于中国海洋大学资源增殖生态学实验室的2株固氮菌株,菌株S3-2Y和菌株S3-4R经形态学、生理生化、nifH及16S rDNA测序确定分别为Bacillushemicentroti、Bacillusjeotgali,其具体指标见表1。

表1 4种固氮菌株的基础指标
注:菌株Bacilusfirmus3A及Thalassospirasp. 4G固氮酶活性、最适生长温度及最适生长盐度数据引用自王琦等[12]。The nitrogen fixation rate, optimum growth temperature and salinity ofBacilusfirmus3A andThalassospirasp. 4G are quoted from Wang Qi et al[12].
1.1.2 培养基 选择性无氮培养基参考Smith等[20]的配方并稍作调整,用于固氮菌株的活化和扩繁:七水硫酸亚铁0.001 g,氯化钾0.56 g,六水氯化镁4.00 g,氯化钠25.00 g,七水硫酸镁4.80 g,磷酸氢二钾0.01 g,三羟甲基氨基甲烷0.48 g,蛋白胨4.00 g,酵母粉2.00 g,甘油2.00 mL,超纯水1 000 mL,pH=8.2。
1.1.3 鳗草植株 实验用鳗草植株于4月25日采自山东省荣成市天鹅湖海域(36.43°N,122.26°E)。采集时,将植株从底部连根挖出,确保鳗草植株完整。植株经海水浸洗,去除底质、贝类及其他附生生物,移入盛有海水的泡沫箱中,24 h内移送回实验室,于室外水槽中暂养3 d,暂养期间采用自然海水,平均盐度为30.79,每日14:00时的平均水温为19.85 ℃。
1.2 接种剂的制备
参考Ridvan等[21]的方法并稍作改进。将低温保藏法保存的菌株快速置于35~40 ℃的温水中,使其迅速融化。接种环蘸取少量菌液,用平板划线的方法接种到固体无氮培养基中,30℃倒置培养18~24 h。挑取单菌落接种到含有50 mL液体无氮培养基的锥形瓶中,30 ℃,180 r/min震荡培养24 h,然后用含有0.025%吐温20的无菌水稀释至109cfu/mL备用。
1.3 实验设计
1.3.1 菌株间的拮抗反应测定 将4株菌株两两相交划线接种于选择性固体无氮培养基上,30 ℃倒置培养2~3 d,每天观察交叉点出细菌生长情况。若交叉点处细菌生长状况良好,表明2株固氮菌株可以混合培养;反之则表明菌株间有抑制作用,不能混合培养。
1.3.2 固氮菌接种实验 实验于2017年5—6月进行,共设6个处理(见表2),每个处理设置8个重复,每个重复随机选取长势良好且具有相似形态学特征(株高15~20 cm,叶片数3~4,根状茎4 cm)的10株鳗草植株,植于灭菌处理的聚乙烯塑料盒中,接种剂只于实验初接种一次。鳗草盆栽实验所需土壤取自于样品采集地(威海市天鹅湖),土壤及海水均经过灭菌处理。实验在室外的玻璃水槽中进行,相同处理的每4个重复置于同一个玻璃水槽中且各组及重复每天随机变换水槽摆放位置以减少光照误差。实验时,所有鳗草植株采用针孔法标记。针孔位置位于叶分生组织上方1 cm处。

表2 各处理组的接种方式
1.4 样品的采集和测定
实验持续30 d,期间每3 d换一次灭菌处理的海水。实验结束后,观察记录鳗草植株的存活情况,计算各组存活率;各处理组随机选取5株测定光合色素含量,鳗草叶片光合色素含量的测定采用萃取法[22],即取每株植株1 cm2健康新鲜的新生叶片用二甲基甲酰胺(DMF)提取光合色素,然后用分光光度计进行测定;另随机选取5株测定可溶性糖含量,即取待测鳗草植株的新生叶片于105 ℃烘箱中杀青后称至恒重,加入乙醇、蒽酮试剂提取显色后,测定625 nm波长下的吸光值[23];余下植株测定新生叶长、叶宽、茎节长及地上和地下组织干重等生长指标,并计算单株新叶面积及地上和地下生产力,测定及计算方法参考Zhao等[24]。根系中土壤脱氢酶活力的测定采用氯化三苯基氮唑(TTC)还原法,用Solarbio土壤脱氢酶试剂盒(BC0395)进行;即每组随机选取8份新鲜土壤,37 ℃,暗培养12 h;随后冰浴5 min终止反应,加入丙酮提取后,4 ℃,12 000 r/min离心5 min,取上清液于485 nm处比色,以吸光值计算脱氢酶活力。根系土壤中脲酶和碱性磷酸酶活力的测定分别采用靛酚蓝比色法和磷酸苯二钠比色法,用Solarbio土壤脲酶试剂盒(BC0125)和土壤碱性磷酸酶试剂盒(BC0285)进行;即每组随机取8份自然风干土样经催化反应后,10 000 r/min常温离心10 min,取上清液分别于630和660 nm处比色,以吸光值计算脲酶、碱性磷酸酶活力。
1.5 数据分析
数据均以平均值±标准误(Mean±S.E.)表示,采用SPSS 17.0进行单因素方差分析(one-way ANOVA),若差异显著则进行Tukey多重比较分析组间差异。若数据不满足正态性或方差齐性,先对数据进行转换,再进行单因素方差分析;若转换后仍不满足,则进行非参数检验。显著性水平α=0.05。分析结果使用origin 8.5软件绘图。使用Canoco 4.5软件对植株各指标数据集进行去趋势对应分析(Detrended correspondence analysis, DCA),4个排序轴的梯度长度均小于3时选用基于线性模型的主成分分析(Principal components analysis, PCA)以识别不同菌株类型中植株生长及生理指标数据间的相似性和差异性。
2 实验结果
2.1 菌株间的拮抗测定
拮抗测定是鉴别菌株间能否共生的传统方法,4株菌株间的拮抗反应结果表明,4株固氮菌两两之间均不产生拮抗作用,可以混合培养。
2.2 固氮微生物对鳗草存活率的影响
鳗草植株存活率变化如图1所示。与对照组相比,接种不同种类固氮微生物均能提高植株的存活率,增长范围在30.00%~57.50%之间。除菌株S3-4R组外,其余处理组的存活率均显著高于对照组(P<0.05),但各处理组间无显著差异(P>0.05)。

(误差线上不同字母表示不同组间存在显著差异(P<0.05) ,横坐标中Control表示不接种菌株的对照组。Different letters on the error bars indicate significant differences between the different groups (P<0.05), The control group had no strain inoculated.)
图1 不同固氮菌株对鳗草植株存活率的影响
Fig.1 Effect of different nitrogen-fixing bacteria on the survival ofZosteramarinaL. plants
2.3 固氮微生物对鳗草生长指标的影响
鳗草单株新叶面积的变化如图2A所示。与对照组相比,接菌处理组能够有效促进鳗草叶片生长,增长范围在11.87%~66.56%之间。最高值出现在菌株4G处理组,单株新叶面积高达(63.26±3.21) cm2·shoot-1,是对照组((37.98±3.76) cm2·shoot-1)的1.67倍。另外菌株3A、4G和Mix处理组的单株新叶面积显著高于对照组和菌株S3-2Y处理组(P<0.05),且菌株4G处理组的单株新叶面积显著高于菌株S3-4R处理组(P<0.05),而与菌株3A和Mix处理组间无显著差异(P>0.05)。
鳗草新茎节长的结果如图2B所示。与对照组相比,接菌处理组能够促进鳗草茎节的生长,但不同种类菌株作用效果不同。菌株3A、4G和Mix处理组的增长效果最明显,新茎节长分别为11.95±0.96、13.79±0.58和(11.22±0.68) mm,显著高于对照组的(8.26±0.76) mm (P<0.05)。鳗草新根长的结果如图2C所示。接种固氮微生物能够在一定程度上促进鳗草根的生长,增长范围在8.84%~15.81%之间,但与对照组间并无显著差异(P>0.05)。
鳗草植株生产力的结果如图2D所示。菌株3A和4G处理组植株地上生产力高达4.72±0.29和(4.77±0.24) mg·shoot-1·d-1,与对照组相比分别增加了29.37%和30.30%,显著高于对照组和其余各组(P<0.05)。地下生产力结果显示,各处理组均显著高于对照组(P<0.05),其中菌株4G处理组在各处理组中的地下生产力最高,达(0.74±0.04) mg·shoot-1·d-1,菌株S3-2Y处理组最低,为(0.55±0.04) mg·shoot-1·d-1,而对照组仅为(0.38±0.06) mg·shoot-1·d-1。
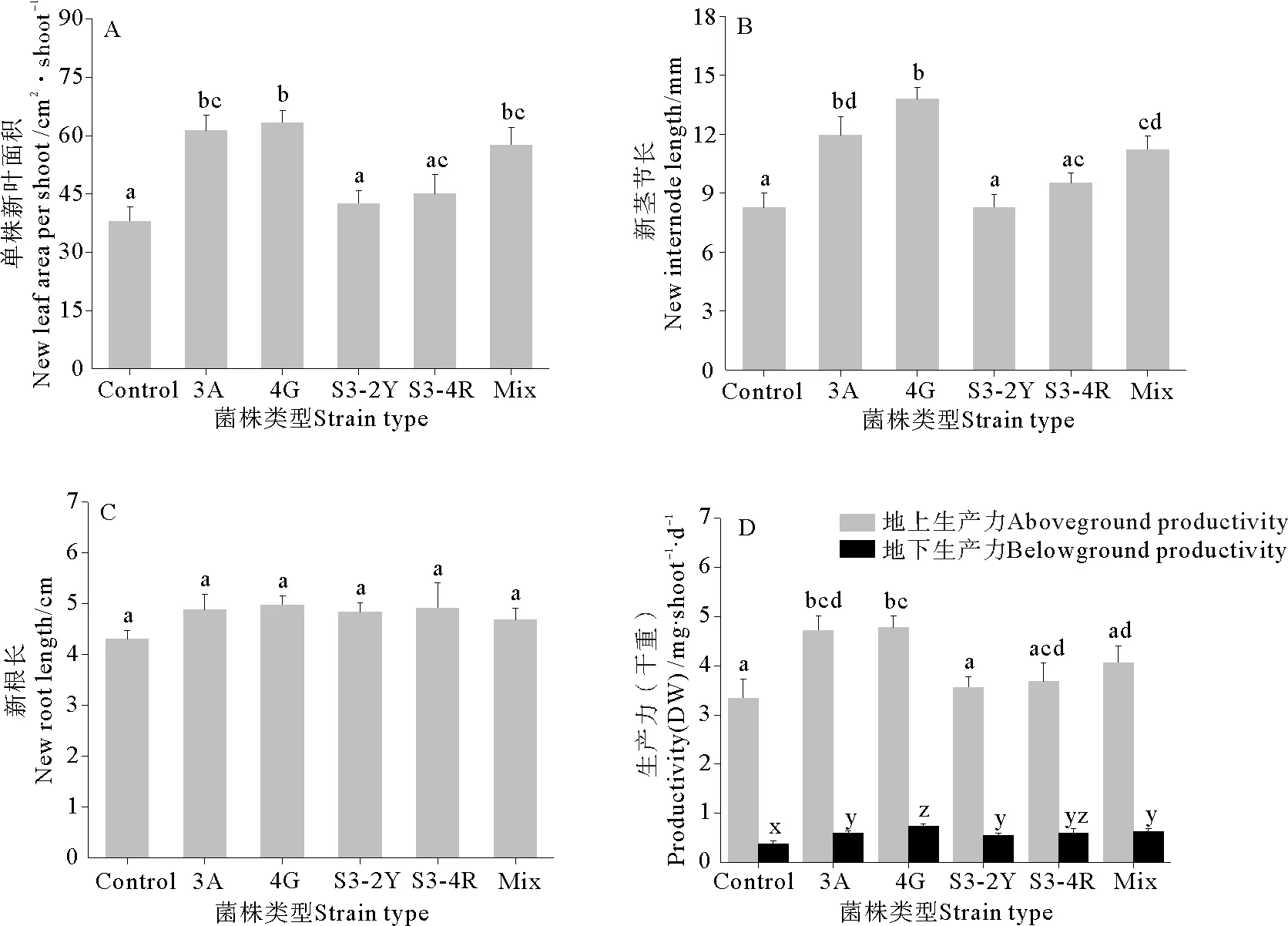
(A: 单株新叶面积New leaf area per shoot; B: 新茎节长New internode length; C: 新根长New root length; D: 生产力Productivity。 误差线上不同字母表示不同组间存在显著差异(P<0.05),横坐标中Control表示不接种菌株的对照组。 Different letters on the error bars indicate significant differences between the different groups (P<0.05), The control group had no strain inoculated.)
图2 不同固氮菌株对鳗草植株生长指标的影响。
Fig.2 Effect of different nitrogen-fixing bacteria on growth status ofZosteramarinaL. plants
2.4 固氮微生物对鳗草生理指标的影响
鳗草叶片光合色素及可溶性糖含量的结果如图3所示。固氮微生物对植株叶片叶绿素a和b含量的影响不显著(P>0.05,见图3A和3B),但均显著增加鳗草植株叶片中总叶绿素含量(P<0.05,见图3C),其中最大值出现在菌株3A处理组,为(67.94±4.99) μg·cm-2。固氮微生物对植株叶片中类胡萝卜素含量的影响最显著,各处理组叶片中类胡萝卜素含量均显著高于对照组(P<0.05,见图3D),其中最高值仍出现在菌株3A处理组((9.90±0.54)μg·cm-2),是对照组((5.34±0.98) μg·cm-2)的1.85倍。所有处理组的可溶性糖含量均显著高于对照组(P<0.05)。其中,菌株3A和4G处理组植株叶片中可溶性糖的含量也显著高于其余处理组,最高值出现在菌株3A处理组((103.72±4.22) mg·g-1),为对照组((54.06±2.61) mg·g-1)的1.92倍。
2.5 固氮微生物对土壤脱氢酶、土壤脲酶和土壤碱性磷酸酶活力的影响
4种固氮菌及其组合接种后鳗草根际土壤中脱氢酶活力如图4A所示。各处理组的脱氢酶活力均显著高于对照组(P<0.05),其中最高值出现在菌株3A处理组((5.58±0.24) U·g-1·h-1),为对照组((1.74±0.09) U·g-1·h-1)的3.21倍。同时菌株3A和4G处理组的脱氢酶活力也显著高于其余3个处理组(P<0.05)。各处理组脲酶活力也有显著提高(P<0.05,见图4B),其中最高值仍出现在菌株3A处理组((155.06±1.21) U·g-1),为对照组的1.62倍,也显著高于菌株上S3-2Y处理组,但菌株S3-2Y处理组与其余3个处理组间无显著差异。4种固氮菌及其组合接种后,碱性磷酸酶活力与对照组差异不显著(P>0.05,见图4C)。

(A: 叶绿素a含量Chlorophyllacontent; B: 叶绿素b含量Chlorophyllbcontent; C: 总叶绿素含量Total chlorophyll content; D: 类胡萝卜素含量Carotenoid content; E: 可溶性糖含量 Soluble sugar content。 误差线上不同字母表示不同组间存在显著差异(P<0.05),横坐标中Control表示不接种菌株的对照组。 Different letters on the error bars indicate significant differences between the different groups (P<0.05), The control group had no strain inoculated.)
图3 不同固氮菌株对鳗草叶片光合色素和可溶性糖含量的影响
Fig.3 Effect of different nitrogen-fixing bacteria on photosynthetic pigments and soluble sugar content ofZosteramarinaL. leaves
2.6 菌株类型与鳗草植株生长生理指标的关系
运用去趋势对应分析(DCA),将菌株类型与鳗草10个生长生理指标相结合进行分析(见表3),第一、第二排序轴对植株各指标的累计解释量为63.30%,4个排序轴中梯度长度最大值为0.07。因此采用主成分分析(PCA)方法进行下一步分析,并对数据进行中心化和标准化处理,结果如图5所示。结果表明,第一、二、三、四排序轴的解释量分别为63.79%、19.82%、10.14%和3.40%,其中第一、第二排序轴的累计解释量为83.61%(见表4)。在PCA分析图中,选取的10个生长生理指标用箭头表示,以菌株间的距离表示菌株作用效果的差异性,以指标间夹角的余弦值表示指标间的相关性强弱,以菌株类型在射线投影点到实心箭头处的相对距离为准,进行排序。分析结果说明,5个处理组的植株促生效果大体呈现4G>3A>Mix>S3-2Y>S3-4R。菌株3A对鳗草光合色素的影响最为显著,而菌株4G对鳗草生长指标的影响最为显著。从各指标间的相关关系中可以看出,地上组织与地下组织各指标间的相关性较强,而光合色素与地下组织间的相关性较弱。此外,存活率与地上、地下组织及光合色素间均呈现较强的相关关系。

(A: 土壤脱氢酶Soil dehydrogenase; B: 土壤脲酶Soil urease; C: 碱性磷酸酶活力Soil alkaline phosphatase; 误差线上不同字母表示不同组间存在显著差异(P<0.05),横坐标中Control表示不接种菌株的对照组。 Different letters on the error bars indicate significant differences between the different groups (P<0.05), The control group had no strain inoculated.)

图4 不同固氮菌株对鳗草根际土壤酶活力的影响

表4 鳗草植株生长及生理指标的PCA结果
3 讨论
3.1 固氮微生物对鳗草的促生长作用
氮素是植物生长发育所需的重要元素,与氨基酸等细胞物质合成及其他重要生理过程密切相关[25]。研究表明,在植物种苗阶段接种固氮菌能显著增加植株存活率,促进植物生长,促生效果与固氮菌的固氮酶活性、生理代谢过程、环境条件等因素有关[8,26-27]。本实验研究了4种固氮菌及其组合对鳗草的促生长作用,结果显示,所有菌株及组合均能在一定程度上提高鳗草植株的存活率、单株新叶面积、茎节长及地上和地下生产力,但不同种类菌株的作用效果不同。菌株3A、4G、S2-2Y和Mix处理组能够显著提高鳗草植株存活率。在单株新叶面积、新茎节长、地上生产力等生长指标方面,菌株3A、4G和Mix表现出明显优势。而接种后增长效果最明显的是植株地下生产力,所有处理组均显著高于对照组。综合所有生长指标,菌株4G的作用效果最为显著,存活率、单株新叶面积、新茎节长、地上及地下生物量与对照组相比分别增加57.5%、66.6%、66.9%、42.2%和97.7%。通常固氮酶活性强弱是表征固氮微生物作用效果的主要依据。但本研究结果表明,菌株固氮酶活性的强弱与其作用效果并不总呈正相关。菌株3A、4G、S3-2Y和S3-4R的固氮酶活性分别为252.21、196.31、156.47和132.21 nmol C2H4·mL-1·h-1。但菌株3A的促生效果却略低于菌株4G,这与Banik等[28]在野生水稻中的研究结果相一致。说明固氮作用受多种因素的影响,不能单一以固氮酶活性强弱衡量。由于实验在室外开展,分析认为除固氮酶活性外,环境因素是影响固氮菌作用效果的重要原因。另外,混合接种处理组并未表现出协同作用效果。王钱崧等[29]研究了3种固氮菌株及其组合对甘蔗的促生长作用,发现接种效果会因组合方式不同而有所差异;而Ravikumar等[30]研究表明,同种组合对不同物种的促生效果也不尽相同。由于微生物间的竞争等原因,混合接种仍需通过进一步实验以确定菌株的最优组合及配比。

图5 菌株类型与鳗草生长生理指标的PCA排序图
3.2 鳗草植株对接种固氮菌的生理响应
光合色素是植物光合作用的物质基础,其中叶绿素a和叶绿素b广泛存在于高等植物中,具有捕获光能、驱动电子转移的功能[31];类胡萝卜素作为光合作用中的辅助色素,能够吸收、传递电子、清除光合作用产生的自由基[32]。已有研究证实可溶性氮含量能够影响植物的光合特性[33]。本研究结果显示,所有处理组均能显著增加叶片中总叶绿素和类胡萝卜素含量,其中菌株3A处理组的总叶绿素和类胡萝卜素含量提升至对照组的1.58和1.84倍。董俊德等[34]亦发现深海海旋菌(ThalassospiraprofundimarisQ25-2)能够提高泰来藻(Thalassiahemperichii)叶片中叶绿素和类胡萝卜素含量。但菌株4G处理组的光合色素含量略低于其余处理组,结合其生长指标数据分析认为,菌株4G的促生速率可能较其余处理组更快,该结果是本实验采样节点超过其最佳生长期所致。因此,在鳗草植株人工促繁过程中除明确不同菌种的促生效果、确定最适应用菌株外,还需确定菌株最佳作用时间。另外,接种固氮微生物能显著增加鳗草叶片中可溶性糖的含量。在高等植物中,可溶性糖不仅是能源物质,其在调节植物生长发育[35]、参与细胞内信号调节和传导[36]等过程中也发挥重要作用。李红梅等[37]研究发现,春季施加氮肥能够增加小麦(TriticumaestivumL.)叶片中可溶性糖含量,从而改善其碳代谢能力,提高产量。袁淑珍等[38]通过低温胁迫实验证实,可溶性糖能够提高螺旋藻(Spirulina)细胞的渗透调节能力,拓宽其温度适应范围。分析认为,接种固氮微生物可能通过调节鳗草叶片中可溶性糖含量促进鳗草植株生长,但具体的作用机制有待进一步探究。
3.3 固氮微生物对鳗草根际土壤酶活力的影响
土壤酶主要由植物根系分泌物、动植物残体分解释放的酶和土壤微生物酶类构成,是分析根际微生物对土壤生态过程影响机制的重要指标[39-40]。本研究结果表明,接种固氮微生物能够增加土壤脱氢酶、脲酶、碱性磷酸酶活力,但不同菌株的作用效果不同。脱氢酶可以反映土壤体系内活性微生物量,是微生物氧化活性能力的精确指标[41]。本研究中发现,菌株3A和4G处理组的脱氢酶活力高达5.58和5.44 U·g-1·h-1显著高于对照组和其余各组(P<0.05)。这与Chen等[42]的研究结果一致,表明实验接种的固氮菌已成功定植于鳗草根际周围,并进行了一系列生物化学反应,与生长及生理指标的提高与改善相对应。脲酶、碱性磷酸酶等水解酶类活力的高低直接影响土壤中氮、磷的分解转化及其生物有效性,是表征土壤氮、磷等养分循环的指标之一[43-44]。但Sinsabaugh等[45]研究表明,不同类型生境对外源氮元素输入的响应不同;而张艺等[46]通过模拟氮沉降实验证实不同施氮类型及水平对土壤酶活性的影响也有差异。本文结果证实,4株固氮菌及其组合能有效提高鳗草与根际土壤间的氮素循环,促进鳗草植株生长,但对磷素分解转化效果不显著。陈胜男等[47]通过盆栽实验同样得出,接种自生固氮菌并不能显著提高玉米根际土壤碱性磷酸酶活性。由此可见,土壤酶活力对外源物质输入的响应不同,需根据不同类型及水平具体分析。
生物固氮作用受环境中微生物的竞争、结合态氮氧、植物基因型和环境条件变化等诸多影响会产生不同接种效果[47]。通过在鳗草根际固氮菌接种实验也表明,4株固氮菌及其组合菌剂对鳗草存活、生长、生理及土壤酶活性的作用效果不同,与固氮酶活性并不直接相关。本研究采用原生沉积物灭菌环境开展实验,以为减少环境中其他微生物影响同时保证土壤中其他元素含量与海区环境相同。但在实际应用过程中,环境复杂多变,为确保固氮菌在自然环境中的竞争适应能力,筛选最佳接种方式,确保接种稳定性等仍是今后需深入研究的课题。
4 结语
通过室外盆栽实验,探究了4株固氮菌及其组合菌剂对鳗草植株生长的影响。结果表明,5个接菌处理组鳗草植株的存活、生长、生理及根际土壤酶活力等指标均有不同程度提高或改善。植株促生效果表现为4G>3A>Mix>S3-2Y>S3-4R,其中菌株3A、4G在海草床生态系统恢复中具有较高的应用价值,具备进一步研制固氮微生物肥料的潜力。
