骨癌痛吗啡耐受疼痛模型大鼠脊髓缝隙连接蛋白43的表达情况及其对环磷酸腺苷/蛋白激酶A通路、炎症的影响▲
2019-02-19冯鹏玖张爱民赵秀霞
冯鹏玖 张爱民 苏 明 蔡 海 赵秀霞 冉 娅
(1 广西柳州市中医医院麻醉科,柳州市 545000,电子邮箱:fpjlzzyy2018@163.com;2 广西医科大学第二附属医院疼痛科,南宁市 530021)
骨癌痛是恶性肿瘤发生骨转移后出现的一种顽固性、复合型疼痛,常发生在乳腺癌、肺癌、前列腺癌的晚期[1]。以吗啡为代表的阿片类药物是控制癌痛的主要药物,但随着病情发展,常需不断加大药物剂量以满足患者镇痛需求[2],10%~20%骨癌痛患者的疗效最终会变差,甚至无效,而这与吗啡耐受密切相关[3],但导致骨癌痛吗啡耐受(bone cancer pain-morphine tolerance,BPT)的机制仍未明确。既往研究表明,持续性癌痛可引起脊髓星形胶质细胞和小胶质细胞进一步活化,白细胞介素(interleukin,IL)1β和肿瘤坏死因子(tumor necrosis factor,TNF)α释放增加,从而发生吗啡耐受[4],因此,脊髓炎症可能是导致BPT的重要原因。而环磷酸腺苷(cyclic adenosine monophosphate,cAMP)/蛋白激酶 A(protein kinase A,PKA)是调节脊髓炎性疼痛的重要信号通路[5]。还有研究结果显示,缝隙连接蛋白43(connexin 43,Cx43)可介导非疼痛模型大鼠慢性吗啡镇痛耐受[6],这提示调控Cx43可能是逆转BPT的重要方法。为此,本研究拟在前期研究[7]的基础上,探讨Cx43对BPT模型大鼠脊髓cAMP/PKA通路及炎症的影响。
1 材料与方法
1.1 实验动物 无特定病原体级SD雄性大鼠40只由广西医科大学动物实验中心提供(合格证号:SCXK桂~2014~0002),鼠龄4~6周,体重120~150 g 。
1.2 主要材料、试剂及仪器 人鼻咽癌HONE1细胞由广西医科大学科学实验中心提供。Von Frey纤维丝(美国Stoelting公司)。Cx43-小干扰核糖核酸(small interfering RNA,siRNA)序列及阴性对照-siRNA序列均参考文献[8]设计,并由上海吉玛基因公司合成,序列见表1。吗啡注射液(东北制药沈阳第一制药,国药准字:H21022436),一抗兔抗鼠Cx43(英国Abcam公司,批号:ab63851)、兔抗鼠cAMP(英国Abcam公司,批号:ab76238)、兔抗鼠PKA(α+β)(英国Abcam公司,批号:ab5815),酶标羊抗兔二抗(Abnova公司,批号:PAB9387),IL-1β和TNF-α 酶联免疫吸附试剂盒(中国碧云天公司,批号:PI303、PT516)。MK3型酶标仪(美国赛默飞仪器有限公司),Image Lab系统下成像仪(美国Bio-Rad公司),500 mA联合X射线机(日立公司)。

表1 Cx43-siRNA及阴性对照siRNA的序列
1.3 动物分组与处理 本研究的动物实验与分子生物学实验部分均在广西医科大学进行,并经广西医科大学动物学医学科研伦理委员会审核备案(gxykd-伦-2018-095)。采用随机数字表法将40只SD大鼠分为5组,每组8只,包括假手术组、骨癌痛组、BPT组、BPT+阴性对照-siRNA组(BPT-CS组)及BPT+Cx43-siRNA组(BPT-CXS组)。在实验开始前,各组大鼠均在动物实验中心饲养室内适应喂养3 d,每日自由作息与饮食,光照昼夜各半,进行环境适应训练。适应完成后,在无菌操作间内,取骨癌痛组、BPT组、BPT-CXS组、BPT-CS组大鼠,于左后肢胫骨上端穿刺后,骨髓腔内注射接种已培养并鉴定的鼻咽癌HONE1 细胞2.4×106个(共30 μL),假手术组则在左后肢胫骨上端穿刺后骨髓腔内注射等体积生理盐水。 在机械刺激回缩阈值(mechanical withdraw threshold,MWT)显著改变至稳定时(降低至不再有统计学意义的阈值变化,约建模后7 d),联合X射线拍片再次确定肿瘤生长,随后BPT组、BPT-CXS组、BPT-CS组经颈后皮下注射10 mg/(kg·次)的吗啡注射液,而骨癌痛组皮下注射等体积的生理盐水,2次/d,持续1周。在MWT出现显著改变并稳定(降低至不再有统计学意义的阈值变化,约建模后10 d)后,参照文献[8]对BPT-CXS组、BPT组、 BPT-CS组大鼠进行硬膜外置管并建立皮下隧道后固定于颈后方,然后BPT-CXS组鞘内注射Cx43-siRNA(2 μg/10 μL),而BPT-CS组则鞘内注射阴性对照-siRNA(2 μg/10 μL),BPT组则鞘内注射等体积的生理盐水,2次/d,连续3 d。siRNA干预后9 d(MWT出现显著改变并稳定),使用10%水合氯醛(剂量为:0.3 mL/100 g)腹腔注射麻醉处死各组大鼠后,迅速取出脊髓L4~L6节段,液氮速冻后转移至-80℃冰箱保存,用于相关指标的检测。
1.4 MWT的检测方法 参考文献[9],使用Von Frey纤维丝up-and-down法检测各组大鼠的机械痛阈值。测量前大鼠均处于安静状态,测量的最小值为0.07 g,最大值为15 g,首先选择2.0 g纤维丝垂直刺激安静状态下的大鼠右侧后爪内侧皮肤,逐渐增加力度使纤维丝弯曲成角,持续1.5 s,连续检测3次,间隔5 min后重复检测,以嘶吼、添足、甩尾及弹腿等任一行为发生阳性表现,然后选择低于此力度的纤维丝继续刺激,直至刺激出阴性表现为止;若为阴性表现则使用大于此力度的纤维丝直至出现阳性表现。以出现阳性体征的最低力度为MWT,MWT越低,疼痛程度越高。
1.5 Cx43及cAMP、PKA蛋白的检测 取出各组标本,加入蛋白酶抑制剂的组织裂解液RIP,在冰浴中超声匀浆,12 000 r/min离心30 min后取上清液,采用二喹啉甲酸标准蛋白测定法检测总蛋白浓度,取40 μg总蛋白进行20%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白,恒电压100 V、2 h条件下将蛋白转至聚偏氟乙烯膜,脱脂奶粉封闭2 h,TBST漂洗干净后加入Cx43、cAMP、PKA(α+β)一抗(稀释度分别为1 ∶1 000、1 ∶2 500、1 ∶200),4℃摇床孵育过夜,TBST洗膜3次,加入酶标二抗,37℃孵育2 h。TBST漂洗干净后,在Image Lab系统下进行条带扫描成像,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,分别以Cx43/GAPDH、cAMP/GAPDH、PKA/GAPDH条带灰度值比值为目的蛋白相对表达量。
1.6 IL-1β和TNF-α水平的检测 从冰箱取出脊髓L4~L6节段标本,冰浴环境下行超声匀浆,离心10 min(4℃、2 000 g)后分别提取上清液,按照酶联免疫吸附试剂盒说明书检测IL-1、TNF-α水平。
1.7 统计学分析 采用SPSS 23.0软件进行统计学分析。计量资料以(x±s)表示,比较采用单因素分析,两两比较采用LSD-t检验;重复测量资料比较采用重复测量方差分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 不同时间点5组大鼠MWT比较 骨癌痛建模后7 d大鼠MWT出现显著变化,建立BPT模型;建立BPT模型后10 d大鼠MWT出现显著变化,给予siRNA干预。不同组的MWT差异有统计学意义(F组间=152.744,P组间<0.001),不同时间点间的MWT差异有统计学意义(F时间=834.561,P时间<0.001),分组与时间无交互效应(F交互=3.475,P交互=0.067)。其中,在建立BPT模型当天(骨癌痛建模后7 d),与假手术组比较,其余4组的MWT均下降(均P<0.05);在建立BPT模型后1~8 d,与骨癌痛组比较,BPT-CXS组、BPT组、 BPT-CS组的MWT均增加(均P<0.05),但BPT-CXS组、BPT组、 BPT-CS组组间差异无统计学意义(P>0.05);在建立BPT模型后9 d至siRNA干预后9 d,与骨癌痛组比较,BPT-CXS组、BPT组、 BPT-CS组MWT均降低(均P<0.05),BPT组和BPT-CS组组间差异无统计学意义(P>0.05);在siRNA干预后6~9 d,BPT-CXS组的MWT低于骨癌痛组,而高于BPT组和BPT-CS组(均P<0.05)。见表2。
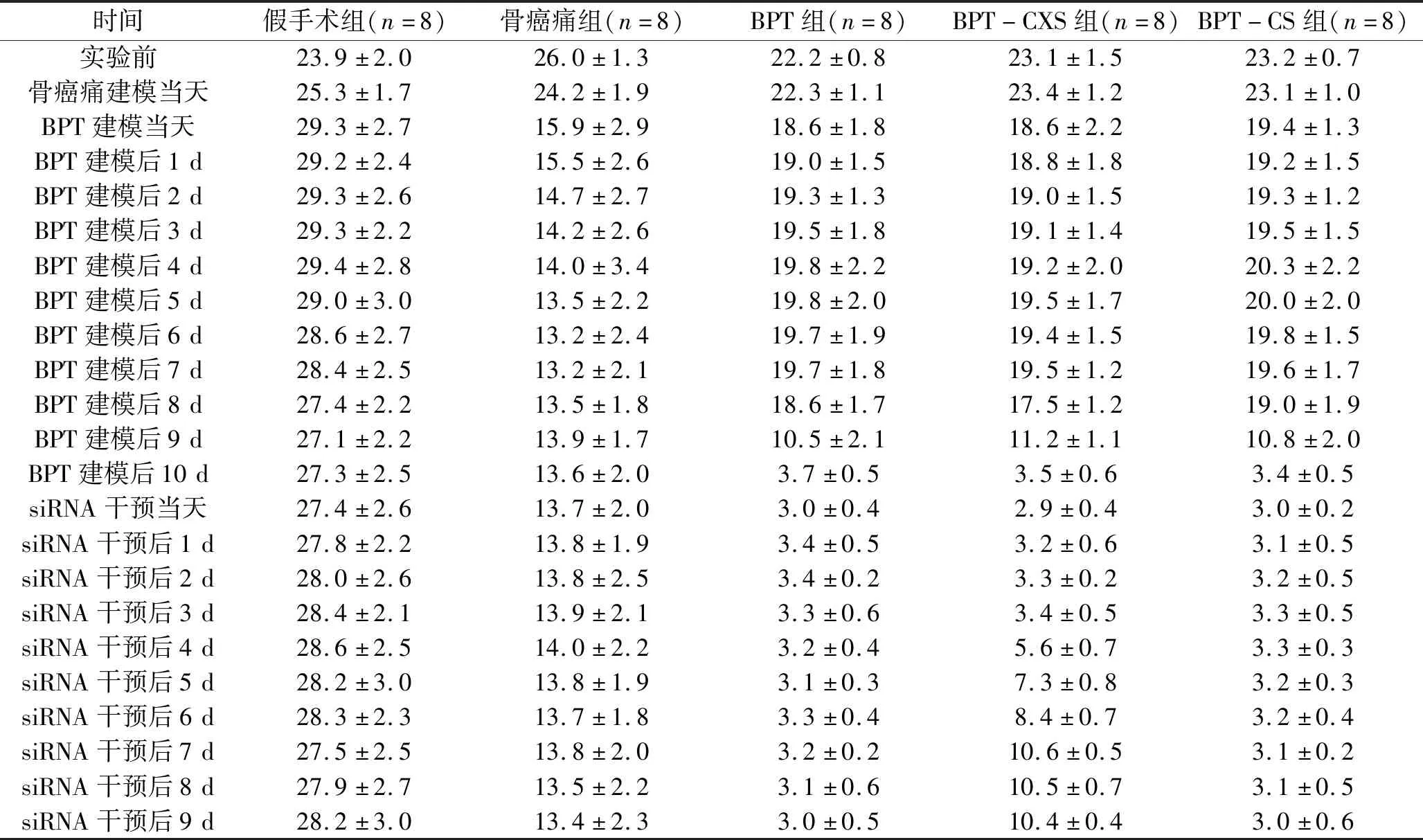
表2 5组各时间点MWT比较(x±s,g)
2.2 5组大鼠脊髓组织Cx43及cAMP、PKA蛋白相对表达量比较 与假手术组比较,其余4组的Cx43、cAMP、PKA蛋白相对表达水平均升高(均P<0.05);与骨癌痛组比较,BPT组、BPT-CS组和BPT-CXS组的Cx43及cAMP、PKA蛋白相对表达水平均升高(均P<0.05);与BPT组比较,BPT-CXS组的Cx43及cAMP、PKA蛋白相对表达水平均降低(均P<0.05);而BPT-CS组与BPT组之间差异无统计学意义(P>0.05)。见表3及图1。

表3 5组大鼠脊髓组织Cx43、cAMP、PKA蛋白的相对表达水平(x±s)
注:与假手术组比较,*P<0.05;与骨癌痛组比较,△P<0.05;与BPT组比较,▲P<0.05。

图1 5组大鼠脊髓组织Cx43、cAMP、PKA 蛋白表达情况
注:A、B、C、D、E分别代表假手术组、骨癌痛组、BPT-CXS组、BPT组、BPT-CS组。
2.3 5组大鼠脊髓组织TNF-α和IL-1β水平比较 与假手术组比较,其余4组的TNF-α、IL-1β水平增加(均P<0.05);与骨癌痛组比较,BPT组、BPT-CS组和BPT-CXS组的TNF-α、IL-1β水平均增加(均P<0.05);与BPT组比较,BPT-CXS组的TNF-α、IL-1β水平均降低(均P<0.05),而BPT-CS组与BPT组组间差异无统计学意义(P>0.05)。见表4。

表4 5组大鼠脊髓组织TNF-α和IL-1β水平比较(x±s,pg/mg)
注:与假手术组比较,*P<0.05;与骨癌痛组比较,△P<0.05;与BPT组比较,▲P<0.05。
3 讨 论
骨癌痛是复杂性疼痛,包括炎性疼痛、伤害性疼痛与神经病理性疼痛等多种性质疼痛。本研究结果显示,骨癌痛大鼠建模后7 d,其他4组大鼠的MWT均低于假手术组(均P<0.05),提示通过骨髓腔内注射接种鼻咽癌HONE1细胞成功建立了骨癌痛模型;随即给予BPT组、BPT-CXS组、BPT-CS组大鼠皮下注射吗啡,在建立BPT模型后9 d起,BPT-CXS组、BPT组、BPT-CS组大鼠的MWT均低于骨癌痛组(均P<0.05),出现吗啡耐受;在siRNA干预后6~9 d,BPT-CXS组的MWT低于骨癌痛组,但高于BPT组和BPT-CS组(均P<0.05),而BPT组和BPT-CS组间差异无统计学意义(P>0.05),这提示鞘内使用Cx43-siRNA,可以缓解吗啡耐受现象。
既往研究表明,脊髓背角趋化因子受体CXCR4通过活化c-fos参与了骨癌痛大鼠吗啡耐受的形成[10],而上调CXCR4的表达后可以进一步激活卫星胶质细胞参与炎性疼痛[11]。因此,通过调控脊髓炎症可能是改善骨癌痛吗啡耐受的途径。Cx43作为神经细胞连接蛋白之一,参与细胞间的信号转导。研究表明,脊髓Cx43蛋白参与慢性神经病理性疼痛的维持[12],尤其在星状胶质细胞中,Cx43蛋白的高表达促进脊髓的炎性因子释放[13]。沈宁等[6]研究发现,脊髓Cx43通过c-Jun氨基末端激酶通路参与了吗啡的耐受。尽管该作者未使用骨癌痛模型进行研究,但所得结果亦提示Cx43在吗啡耐受的发生发展中发挥了重要作用。本研究结果显示,骨癌痛组的Cx43蛋白相对表达水平高于假手术组,且BPT组的Cx43蛋白相对表达水平高于骨癌痛组(均P<0.05)。这提示脊髓Cx43蛋白不仅参与神经病理性疼痛,脊髓组织Cx43蛋白高表达可能也是骨癌痛及BPT发生的重要机制。
cAMP/PKA是细胞经典的途径,细胞外信号后使cAMP浓度增加,进一步上调PKA,可直接或间接调节细胞代谢。Cx43蛋白是细胞膜上重要的受体蛋白,Cx43可通过cAMP/PKA通路产生缩血管反应[14],破坏细胞膜的完整性[15],这提示Cx43传递的信号可被cAMP/PKA通路接收。本研究中,骨癌痛组的cAMP、PKA蛋白相对表达水平高于假手术组,且BPT组的cAMP、PKA蛋白相对表达水平高于骨癌痛组(均P<0.05),即骨癌痛发生后脊髓组织中Cx43蛋白的高表达伴随 cAMP/PKA通路的激活,而发生吗啡耐受后,cAMP/PKA通路随着Cx43蛋白表达的升高而进一步被激活;与BPT组比较,BPT-CXS组的Cx43及cAMP、PKA蛋白相对表达水平均降低(均P<0.05),即抑制Cx43表达后吗啡耐受得以缓解的同时,cAMP/PKA蛋白表达亦降低,这提示Cx43-cAMP/PKA通路可能在BPT发生中发挥重要作用。
脊髓星形胶质细胞和小胶质细胞激活后大量释放入组织[16],作用于神经元细胞膜,产生细胞毒性作用。值得注意的是,在神经系统中,cAMP激活后可促进小胶质细胞释放IL-1β和TNF-α等炎性因子[17],且吗啡耐受时,也可导致炎性因子的增加[18]。在本研究中,骨癌痛组脊髓IL-1β和TNF-α水平高于假手术组,且BPT组的脊髓IL-1β和TNF-α水平高于骨癌痛组(均P<0.05),而BPT-CXS组脊髓IL-1β和TNF-α水平低于BPT组(均P<0.05),即脊髓cAMP/PKA的激活与抑制,均伴随IL-1β和TNF-α浓度的增加与降低,推测在骨癌痛及BPT的大鼠模型中,脊髓IL-1β和TNFα等炎性因子可能是调控cAMP/PKA通路的重要代谢蛋白之一。
综上所述,脊髓Cx43通过调节cAMP/PKA通路进而释放促炎性因子IL-1β和TNF-α,可能是BPT发生的关键机制之一,而抑制脊髓Cx43表达可能是逆转BPT现象的重要途径。
