硫酸铅在柠檬酸-氢氧化钠体系浸出动力学研究
2019-02-19高雨霏张丽迎左其亭喻文昊杨家宽
张 伟,高雨霏,张丽迎,唐 港,左其亭,喻文昊,杨家宽
(1.郑州大学水利与环境学院,河南 郑州 450000;2.华中科技大学环境科学与工程学院)
许多学者对固液体系动力学做了研究和分析,其探究可加深对反应体系的理解[1-5]。 J.J.Ke 等[6]研究了PbO2在存在多羟醇的碱性溶液中的浸出动力学。结果表明,随着多羟醇(木蜜糖、木糖醇、甘油、乙二醇)的增加浸出速度也相应加快,浸出性能:木密糖>木糖醇>甘油>乙二醇。D.Begum 等[7]采用压片的方法研究了废旧铅蓄电池铅膏的主要成分硫酸铅(PbSO4)在三乙醇胺中不同条件下的浸出特性。结果表明,温度高于45 ℃时主要是化学控制,而低于45 ℃时主要为扩散控制。Zhang Huanjun 等[8]采用硫酸铵作为浸取剂,考察了浸取体系温度、硫酸铵初始浓度以及颗粒粒度对浸取反应动力学的影响。 结果表明: 在一定的浸取剂初始浓度和固体反应颗粒粒度范围内, 该浸取反应过程符合Crank-Kinstelin-Browhetein 模型;表观反应活化能为57.41 kJ/mol,属表面化学反应控制类型。 当硫酸铵与氧化镁初始物质的量比大于2 时,反应过程逐渐由Crank-Kinstelin-Browhetein 模型向减缩核模型过渡。 欧腾蛟等[9]系统地研究了菱镁矿的煅烧条件以及煅烧粉在氯化铵乙二醇溶液中的浸取动力学。 菱镁矿在750 ℃下煅烧2 h 左右能使MgCO3分解完全而CaCO3不分解,过烧会使晶粒长大,从而降低浸取速率。 在消除外扩散影响的前提下,浸取过程在反应物(NH4Cl 与MgO)以化学计量比反应、氯化铵的初始浓度为0~1.23 mol/L 时符合未反应收缩核模型,且浓度为1.23 mol/L 时浸取速率达到最大;浸取速率受表面化学反应控制,活化能为44.74 kJ/mol。
铅膏是废铅酸蓄电池中较难处理的部分,目前常用的处理工艺为火法冶炼,其过程中产生的二氧化硫和PM2.5 铅尘的污染极为严重。 为避免火法工艺中存在的问题,基于柠檬酸/柠檬酸钠的湿法浸出回收工艺可有效实现废铅膏的清洁回收[10]。
对于废铅膏,硫酸铅为其中较难转化的部分,因此铅膏反应动力学的研究主要为硫酸铅反应的动力学, 浸出过程即为硫酸铅转化为柠檬酸铅的过程。本实验主要研究了铅膏中主要组分硫酸铅在柠檬酸-NaOH 体系的浸出动力学规律,并对其浸出机理做了初步研究。
1 实验材料和方法
1.1 原料与试剂
PbSO4、柠檬酸、氢氧化钠,均为分析纯,质量分数均为99.5%,购自国药集团化学试剂有限公司。
1.2 实验分析与测试方法
硫酸铅在浸出过程的一个重要指标是脱硫率,动力学实验过程脱硫率采用离子色谱法(IC)测量。先用100 mL 移液管准确移取300 mL 配制好的柠檬酸溶液(柠檬酸与铅的物质的量比为6)至500 mL烧杯中,将烧杯放入水浴锅水浴搅拌,再称量20.0 g NaOH 固体投加至烧杯中调节pH 为5.6, 待pH 稳定后使用分析天平称量10 g PbSO4,将PbSO4固体投入烧杯的同时开始计时, 分别在0、2、5、8、10、12、15、20、40、60、80 min 时移取1 mL 浸出液(使用1 000 μL 移液枪)至漏斗中自然过滤并定容到250 mL,待反应结束后将定容后的滤液移取至离心管中,使用离子色谱仪测量离心管中溶液的硫酸根含量,脱硫率计算采用溶液中硫酸根含量除以原硫酸铅中含量。 计算的方程式:
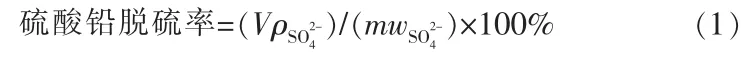
式中,m为铅膏的质量,g;V为浸出液的总体积,L;为浸出液中硫酸根的质量浓度,g/L;为铅膏中的质量分数,%。
2 实验结果与讨论
2.1 浸出温度的影响
在NaOH 为20 g、n(柠檬酸)∶n(铅)=6、pH=5.6、柠檬酸体积为300 mL、 搅拌速度为400 r/min 的条件下, 计取样时间分别为0、2、5、8、10、12、15、20、40、60、80 min, 考察了不同浸出温度条件下PbSO4脱硫率随时间的变化和动力学曲线,结果见图1。
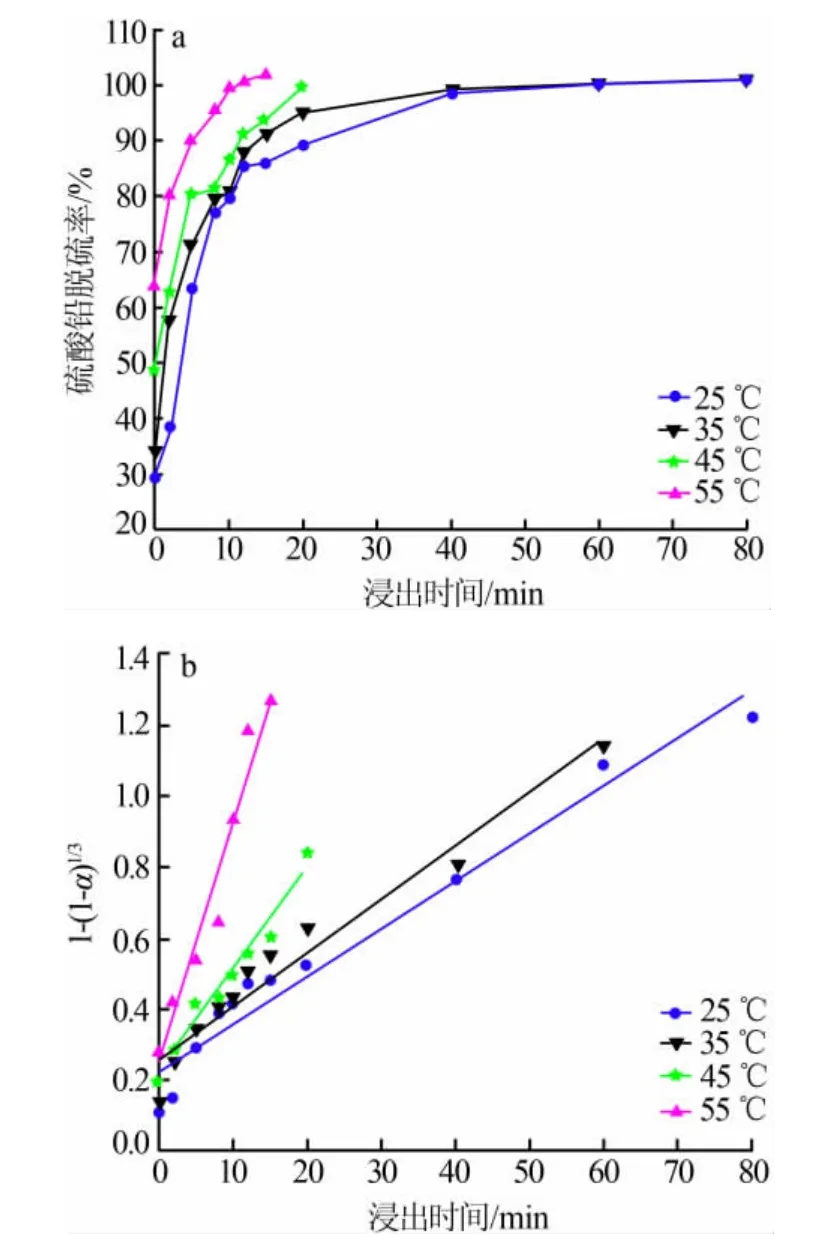
图1 不同浸出温度条件下PbSO4 脱硫率随时间的变化(a)及动力学曲线(b)
由图1b可得动力学方程式:

式中,α 为硫酸铅脱硫率,%;t为浸出时间,min。
式(2)~(5) 中所对应的相关系数分别为0.96、0.95、0.97、0.96,均在系数0.96 左右,初步表明实测数据与拟合方程吻合性较高。 在各浸出温度条件下,计算化学反应速率常数对数值lnK,结果如表1所示。
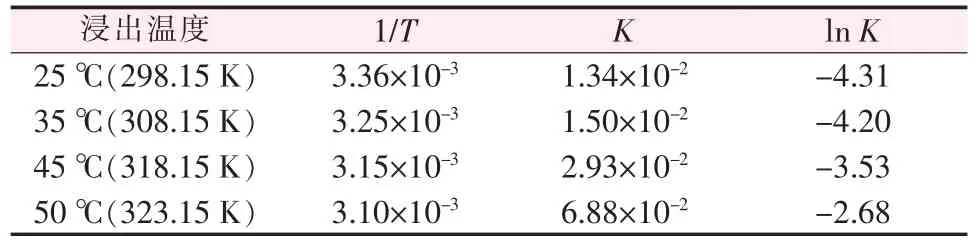
表1 各浸出温度下K 和ln K
依据表1,以lnK对1/T作图,见图2。 由图2 可知,其直线斜率为-6 253.2,则根据Arrhenius 公式:

斜率为-E/R=-5 406.9,计算可知表观活化能E为45 kJ/mol。 其数值大于42 kJ/mol,可认为浸出反应受化学反应控制。
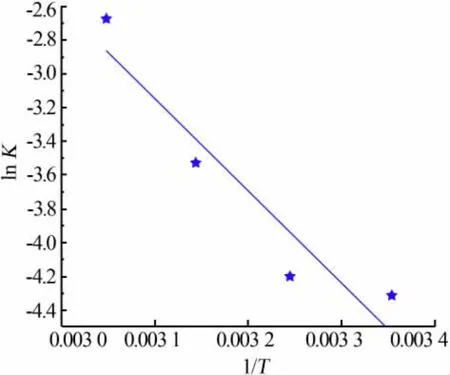
图2 浸出反应的Arrhenius 图
2.2 搅拌速度的影响
在NaOH 为45 g、n(柠檬酸)∶n(铅)=6.0、pH=5.6、柠檬酸体积为300 mL、反应温度为25 ℃的条件下,考察了搅拌速度对PbSO4脱硫率的影响, 结果见图3。由图3 可知,随着搅拌速度加快,PbSO4脱硫率会随之提高。 但在搅拌速度增至800 r/min 时,PbSO4脱硫率已经达到最大值。 在搅拌速度为400~800 r/min时,有利于浸出剂和固体物料的充分接触反应。当搅拌速度升至1 000 r/min 后,PbSO4脱硫率呈现下降趋势。这可能是由于在高速搅拌过程中,固体物料和浆液同步转动,导致无法充分接触反应。
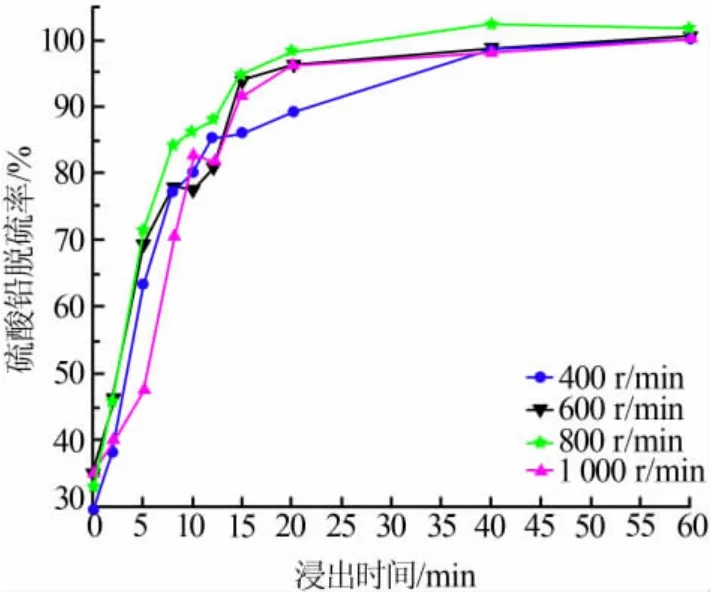
图3 搅拌速度与硫酸铅脱硫率的关系
NaOH 对浸出过程的影响分析: 投加NaOH 可提高浸出系统中所生成的柠檬酸铅的溶解度, 投加过程会增大浸出体系的pH, 柠檬酸铅的溶解率随pH 变化情况如图4 所示。由图4 可见,反应过程中,随pH 的增大, 在硫酸铅表面所生成的柠檬酸铅会溶解,从而将未反应的硫酸铅进一步暴露,可与自由的柠檬酸根反应, 提高脱硫率。 反应过程中柠檬酸铅-硫酸铅结构在NaOH 投加的情况下可得到改变,表面的柠檬酸铅会在较高的pH 下溶解,从而促进脱硫反应进行。
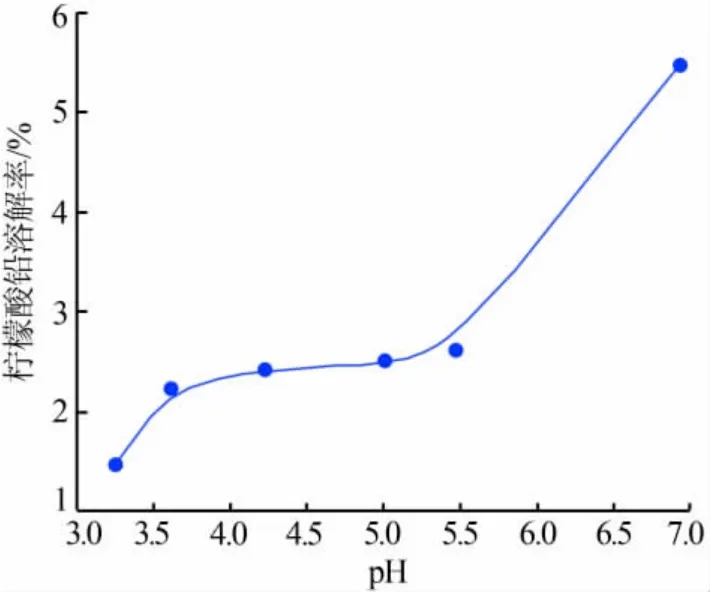
图4 柠檬酸铅在不同pH 下的溶解率
3 结论
1)动力学实验表明,在柠檬酸-NaOH 体系中,PbSO4浸出反应速率随浸出温度升高而升高, 表观活化能E为45 kJ/mol,可认为浸出反应受化学反应控制。 在一定搅拌速度范围内,随着搅拌速度的增加,PbSO4脱硫率会随之提高。 2)柠檬酸铅-硫酸铅结构在NaOH 投加的情况下可得到改变, 表面的柠檬酸铅会在较大pH 下溶解, 逐渐暴露的硫酸铅会进一步与游离的柠檬酸根反应。
