北京地区荷斯坦母牛群体HH1遗传缺陷基因抽样调研
2019-02-15吕小青劳兰兰赵凤李艳华麻柱刘林
吕小青,劳兰兰,赵凤,李艳华,麻柱,刘林
(1.北京奶牛中心,北京 100192;2.中国农业大学动物科技学院,北京 100193)
近年来,为了提高奶牛的生产性能,我国大量从国外引进遗传物质,促进了国内奶牛群体的遗传改良。然而,在引进遗传物质的过程中也导致了一些遗传缺陷在我国奶牛群体间传播。2016年10月28日,农业部畜牧业司发布了《中华人民共和国农业部公告第2460号》,公告中规定从境外引进种牛及冷冻精液和胚胎的,应在系谱上标识或在销售合同条款中写明种牛及冷冻精液和胚胎未携带脊椎弯曲综合征(CVM)、白细胞黏附缺陷综合征(BLAD)、短脊椎综合征(BS)等主要遗传缺陷基因。国家建立的种牛缺陷基因监督措施,对保障种牛及遗传物质的质量安全,提高奶农的经济效益具有重要意义。
遗传缺陷所引起的经济损失包括动物胚胎损失、新生畜死亡以及病畜的生产性能和利用价值降低等,例如牛短脊椎综合征(BS)[1]、牛脊椎弯曲综合征(CVM)[2]等遗传缺陷,致病基因纯合时可导致胚胎死亡,直接造成生产和经济上的损失。同时,母牛在怀孕早期流产可能影响母牛的身体健康,甚至引起疾病,从而导致母牛的生产性能和利用价值降低。
目前,国内已经建立了很多奶牛遗传缺陷基因的分子检测方法,如BLAD[3]、DUMPS、CN[4]、BS[5]等隐性遗传缺陷基因的检测,并对国内种公牛遗传缺陷基因的携带情况进行了系谱分析,对保证种公牛的遗传优势和降低遗传缺陷基因的传播风险都起到重要作用。
随着奶牛全基因组内高密度SNPs检测技术的发展和应用,并随着检测个体的不断增加,获得了大量的单倍型信息,通过不同世代个体比对,发现11种群体频率很高的单倍型从来没有以纯合的形式出现,然后进行系谱分析,观察其遗传方式,并通过和具体繁殖性状(SCR、妊娠率、死胎率)的关联分析,推测出5种单倍型,当其纯合时会导致早期流产或死胎。
2011年,VanRaden等首先通过基因组SNP数据分析,在荷斯坦牛中发现了3种导致胚胎死亡的隐性遗传缺陷单倍型(HH1、HH2和HH3)[6]。2012年,Adams等通过全基因组重测序和高密度单体型分型技术,发现在APAF1基因上63150400bp位置存在一个C/T突变,使编码谷氨酰胺的密码子突变为终止密码子,导致APAF1基因编码的蛋白质缺失约1/3。同时发现APAF1基因在胚胎的生长发育中发挥着不可替代的作用,所以发生突变后导致胚胎死亡[7]。该遗传缺陷基因携带者不表现任何临床症状,只有隐性纯合子个体致死,因此给养牛业的发展造成的潜在损失巨大。
2013年,Fritz等报道了HH1遗传缺陷在法国荷斯坦牛群体中的频率为2.6%[8]。目前HH1在我国荷斯坦牛群中的携带情况尚不清楚,因此有必要对HH1遗传缺陷基因进行检测和筛查。本研究旨在了解北京地区荷斯坦母牛HH1遗传缺陷基因的携带情况,同时探索HH1遗传缺陷基因的分子检测方法,为科学选种选配提供参考资料。
1 材料与方法
1.1 试验样品
本研究共随机采集了158头北京地区荷斯坦母牛的血液样品。
1.2 基因组DNA提取
采用天根血液DNA提取试剂盒(DP318),根据试剂盒说明书提取基因组DNA。提取的DNA用1%琼脂糖凝胶检测,同时用分光光度计检测其浓度与纯度。
1.3 KASP检测方法的建立
1.3.1 引物设计
检索Ensembl数据库的牛基因组序列(UMD 3.1),获得A P A F 1 基因的部分序列(B T A 5:63150200-63150600),以此为模板进行PCR引物设计。利用Primer3.0设计引物(如表1所示),针对SNP位点,上游引物APAF1-F1和APAF1-F2的3′端为等位基因突变碱基,将APAF1-F1和APAF1-F2在5’端加上相应的通用接头序列(荧光标签序列)。

表1 KASP引物序列信息
1.3.2 PCR程序
PCR体系为5μL,包括2.5μL DNA、2.5μL KASP Master Mix(LGC Genomics,Hoddeston,UK)、0.07μL混合引物。为避免对试验结果的误判,设置空白对照,其DNA模板用ddH2O代替。PCR扩增条件:94℃热激活15min、94℃变性20s、61~55℃退火和延伸60s,进行10个循环;94℃变性20s、55℃退火和延伸60s,进行26个循环;94℃变性20s、57℃退火和延伸60s,进行3个循环。
1.3.3 数据扫描
PCR结束后,取出孔板进行数据扫描,具体参照《ABI7900 HT Fast RealTime PCR system实验操作规程》。
1.4 群体基因组频率计算
杂合基因型频率(%)=杂合个体数/测定个体数×100%
有害基因频率=杂合基因型频率/2
2 结果
2.1 基因型检测结果
本研究设计的KASP引物能够准确区分SMC2基因的纯合型和杂合型,从而确定遗传缺陷基因的携带者。本研究中对于待检测的SNP位点其检出率为100%,样品SNP检测结果见图1。图中两个坐标分别代表不同颜色的荧光强度,用于区分同一位点不同的SNP基因型,左上端蓝色是单道荧光值比较高的,可以认为是纯合子(即CC型),中间的绿色是两种基因型都存在的杂合子(即CT型),因本研究中TT纯合型是致死的,所以没有检测到TT型(右下端红色区域无显示)。
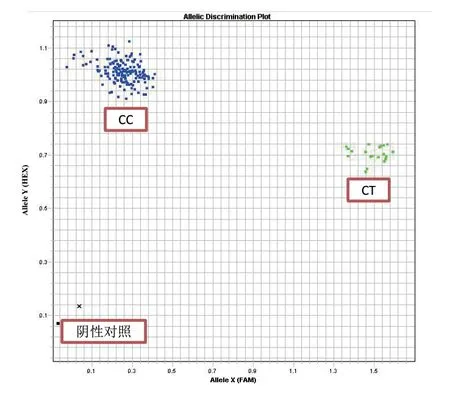
图1 APAF1基因位点的KASP检测结果
2.2 有害基因频率计算
本研究共随机检测了158头荷斯坦母牛,检测到20头携带HH1的个体,HH1携带率为12.66%,其有害基因频率为6.33%,提示HH1在我国荷斯坦母牛群体中存在一定的比例。
3 讨论
目前检测奶牛遗传缺陷基因的方法主要有PCRPIRA[9,10]、PCR-SSCP[11~13]、PCR-RFLP[14]以及焦磷酸测序[15],本研究首次建立了影响荷斯坦牛繁殖力遗传缺陷基因HH1的KASP分型检测方法,该方法快速、高效、经济,可以对样本进行高通量的检测。KASP是竞争性等位基因特异性PCR的缩写,可在广泛的基因组DNA样品中,对SNPs和特定位点上的插入和缺失进行精准的双等位基因判断,是基于引物末端碱基的特异匹配来对SNP进行分型。
本研究对HH1在北京地区高产荷斯坦母牛群中的携带情况进行了初步了解,其携带率为12.66%,提示HH1在我国荷斯坦母牛群体中存在一定的比例。因此,奶牛场需要严格系谱登记制度,同时在购买公牛冻精时,需要查看公牛系谱,避免使用携带HH1的公牛冻精配种,从而避免产生遗传缺陷基因HH1纯合个体,减少不必要的损失。此外,牛场应定期对牛群进行随机抽样筛查,国家还应严格监控进口奶牛遗传缺陷基因的携带情况。本研究为我国奶牛育种工作中有计划地降低遗传缺陷基因提供了技术支撑,为奶牛场进行科学的选种选配提供了依据,对降低奶农的经济损失具有重要意义。
