基于核磁共振技术研究高强度间歇训练对大鼠血清代谢组学的影响
2019-02-12高浩恩艾竞一李方晖孙磊
高浩恩 艾竞一 李方晖 孙磊
南京师范大学体育科学学院(江苏南京 210046)
高强度间歇训练(high-intensity intervals training,HIIT)是以无氧阈或最大乳酸稳态的负荷强度进行多次持续时间为几秒到几分钟的练习,且每两次练习之间安排使练习者不足以完全恢复到静息的训练方法[1]。业已证实,HIIT对于提高运动员的运动成绩、提升健康人群有氧适能、改善心血管病和2型糖尿病患者的心肺耐力优于传统中等强度持续性训练(moderate-intensity continuous training,MICT)[2,3]。文献表明,与相同运动强度的MICT相比,HIIT能更有效的提高骨骼肌氧化代谢活性[4]、增强心肌收缩功能和耗氧应答速率[5]、促进骨骼肌和心肌线粒体生物合成、改善机体抗疲劳能力[6]和自我效能感[7]。研究发现[4],HIIT对有氧耐力的提高与骨骼肌丙酮酸脱氢酶、细胞色素C氧化酶、葡萄糖转运蛋白4、脂肪酸转运酶、单羧酸转运体蛋白、柠檬酸合酶等蛋白表达增加有关;HIIT也能增强骨骼肌无氧代谢能力、峰值功率[8]和反复冲刺能力[6],这可能与血清中磷酸肌酸含量增加、骨骼肌糖酵解的限速酶磷酸果糖激酶活性增强有关[9,10]。
基于核磁共振波谱(nuclear magnetic resonance spectroscopy,NMR)的非靶向代谢组学技术被广泛应用于体能训练监控、疾病运动疗法机制和体适能水平表征等运动科学的热点问题研究,有学者将其定义为“运动代谢组学”[11]。值得注意的是,已有文献报道了急性高强度间歇训练对血清代谢表型的影响[12],但未见长期HIIT诱导血清代谢表型适应性改变的文献报道。基于此,本研究采用NMR技术对10周MICT和HIIT训练后大鼠血清进行代谢指纹图谱数据采集,通过分析比较这两种训练模式下差异代谢产物的改变来揭示内源性代谢途径的变化,旨在为HIIT更好的应用于竞技体育和运动健身领域中提供数据支撑和理论参考。
1 材料与方法
1.1 实验动物及分组
选用清洁级雄性8周龄SD(Sprague Dawley)大鼠34只,体重369.00±24.10 g,由广东省医学动物实验中心提供。动物许可证号:SCXK(粤)2013-0002。饲养室温度为23.00℃±1.50℃,相对湿度45% ±15%。动物房保持自然照明。所有大鼠在适应性喂养1周后被随机分为安静对照组(SC组,n=10),MICT组(n=12)和HIIT组(n=12),共3组。
1.2 运动训练方案
根据漆正堂等[10]的方法制定跑台方案。MICT和HIIT组大鼠在适应性喂养1周开始进行为期2周的跑台(广州飞迪生物科技有限公司动物实验跑台,型号FD000043)适应性训练。第1周跑速10~15 m/min,每天运动30 min,第2周20 m/min,每天30~40 min,每周5天,周六、周日休息。适应性训练后进行正式训练。MICT方案:以18 m/min速度(40%~50%VO2max)[13]热身3 min,之后以28 m/min速度(70%VO2max)[9]持续运动34 min,随后再以18 m/min速度放松3 min。HIIT方案:以18 m/min运动5 min,再以42 m/min(95%~99%VO2max)[13]运动4 min,之后依次交替进行,重复4次,最后以速度为14 m/min放松2 min。运动均1次/天,5天/周,周六、周日休息,共10周。SC组大鼠不进行跑台训练。
1.3 耐力测试
各组大鼠的力竭时间(time to exhaustion)和跑步距离(running distance)在末次训练后第2天进行测试。方案[13]:进行10 min跑台热身运动(速度5 m/min)后,起始负荷设定为10 m/min,每3 min递增5 m/min,直到力竭。力竭判定标准:动物跟不上预定速度,大鼠臀部压在笼具后壁,后肢随转动皮带后拖达30 s,毛刷刺激驱赶无效;行为特征表现为呼吸深急,精神疲倦,俯卧位垂头,刺激后无反应。记录力竭时间,并计算跑步距离。
1.4 血清取样及组织分离处理
在耐力测试后48 h称重,按照4 ml/kg剂量的10%水合氯醛麻醉大鼠后,腹主动脉采血。每只大鼠采血1.5 ml放入5 ml EP管中,常温静置30 min,然后4℃静置1小时,离心15 min,转速为3500 rpm,取上清液分装于冻存管中密封,转移至-80℃低温冰箱冻存,待代谢组学测试分析。迅速分离比目鱼肌、腓肠肌、股四头肌、趾长伸肌、肾周脂肪、睾丸并称重,计算各组织相对重量(%)=各组织重量(g)/体重(g)×100%。
1.5 核磁共振波谱分析
1.5.1 样品采集与制备及测定条件
从各组血清样本中随机选取7个样本用于NMR谱采集和血清代谢组学分析。常温解冻样本,涡旋样本30 s;离心样本5 min(4℃,13000 rpm);超滤膜离心过滤45 min后离心样本5 min(4℃,13000 rpm);取澄清透明的滤液于新编号离心管,加入重水稀释至500 μl,涡旋10s;离心分离2 min(4℃,13000 rpm);取480 μl上层清液于NMR管中,600 MHz NMR(25℃)谱仪采集核磁波谱图。
1.5.2 NNMMRR谱图数据处理与分析
将NMR自由感应衰减(free induction decay,FID)信号导入 Chenomx NMR suit(version 8.1,Chenomx,Edmonton,Canada)软件,自动进行傅立叶转换,调整相位,校正基线,以DSS(δ0.00)处双峰中心作为全部谱图化学位移的标准。对0.01~10.00 ppm范围内谱峰进行分析,以0.04 ppm单位的化学位移为分段积分单元。为了防止水的残留峰干扰,除去4.65~5.05 ppm(水峰)处的分段积分值。然后将所有积分值的面积进行归一化处理,导出到Excel表格中,得到每个分段和对应的积分面积值矩阵。将上述处理的积分数据导入SIMCA-P 13.0(Umetrics,Sweden)软件进行主成分分析(principal component analysis,PCA),再用偏最小二乘法判别分析(partial least squares-discriminant analysis,PLS-DA)找出样品间差异代谢产物。PCA和PLSDA分析方法具体参见文献[12]。
1.6 数据分析
采用SPSS 21.0软件分析数据,Graph Pad Prism(Version 6.07)软件作图。对各组大鼠体重和组织重量采用单因素方差分析和多重比较检验;差异代谢产物采用独立样本t检验。采用Pearson相关计算跑步力竭时间与胆碱和酪氨酸相关系数,相关系数用r表示。数据均采用均数±标准差(±s)表示,显著差异选择P<0.05和P<0.01水平。
2 结果
2.1 各组大鼠最终体重、相关组织重量及其相对重量
表1显示,与SC组相比,HIIT和MICT组大鼠最终体重、肾周脂肪重量和肾周脂肪相对重量显著降低(P<0.01),睾丸相对重量显著性增加(P<0.01);与SC组相比,MICT组股四头肌相对重量和腓肠肌相对重量分别增加12.10%(P<0.05)和21.80%(P<0.01);与SC组相比,HIIT组股四头肌相对重量和腓肠肌相对重量分别增加10.60%(P<0.05)和14.60%(P<0.01),但股四头肌和腓肠肌重量分别减少15.60%(P<0.05)和19.20%(P<0.05)。
2.2 各组大鼠跑步距离和力竭时间
如图1所示,与SC组相比,MICT组大鼠跑步距离(图1A)和力竭时间(图1B)分别增加1.32倍(P<0.01)和1.28倍(P<0.01),HIIT组也分别增加1.45倍(图1A,P<0.01)和2.33倍(图1B,P<0.01);与MICT组比较,HIIT组跑步距离(图1A)和力竭时间(图1B)分别增加21.50%(P<0.05)和1.05倍(P<0.05)。

表1 各组大鼠最终体重、相关组织重量及其相对重量
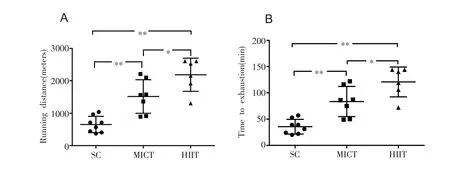
图1 各组大鼠跑步距离(A)和力竭时间(B)
2.3 各组大鼠血清基于NMR代谢组学技术的图谱
图2显示NMR代谢指纹图谱,横坐标为化学位移(单位:ppm)。鉴于谱峰的积分面积与代谢产物的浓度呈正相关,可通过对谱峰进行积分做相应代谢产物的定量分析。由于每一个代谢产物在相同缓冲液中出峰位置固定,即化学位移(δ)是固定的,结合每个代谢物化学位移、裂峰及偶合常数,参照文献和数据库对图谱进行指认。图2标注了三组大鼠血清代谢指纹图谱中有重要贡献的差异代谢物归属。
2.4 各组大鼠血清样本PCA分析
图3表示采用PCA对SC与MICT组、SC与HIIT组、MICT与HIIT组的血清样本进行NMR代谢轮廓分析。结果显示,SC与MICT两组血清样本得分图有簇类分布,提取的主成分1(PC1)和主成分2(PC2)各占66.5和14.4%(图3A);SC与HIIT两组也具有簇类分布,PC1和PC2各占62.9和14.2%(图3B);MICT和HIIT两组的簇类分布不明显,无法得到分离(图3C)。
2.5 各组大鼠血清样本代谢物PLS-DA分析
PCA作为无监督分析方法,仅能反映数据原始状态,但在实验过程中环境、饮食及实验系统误差均会影响分析结果。为了明确两种训练方式对大鼠血清代谢表型改变的特异性,本研究采用监督判别分析PLS-DA对SC与MICT组、SC与HIIT组之间的血清样本代谢物进行判别分析,所得的散点图见图4A和图4C。结果发现,与PCA结果相似,SC与MICT组、SC与HIIT组的样本得分图均有簇类分布。同时,采用R2X(cum)、R2Y(cum)和Q2(cum)3个参数来检验PLS-DA模型稳健性,Q2表征模型的可信程度,一般认为Q2值大于0.4可信程度较高;R2X和R2Y表征本模型能解释变量的百分数。结果显示,SC与MICT组Q2为0.46,R2X与R2Y分别为0.20和0.60;SC与HIIT组Q2为0.40,R2X与R2Y分别为0.21和0.61。说明SC与MICT组、SC与HIIT组PLS-DA模型的可信程度基本满足进一步分析差异代谢物的要求。
为了找出SC与MICT组、SC与HIIT组血清样本中的代谢差异物,本研究通过PLS-DA得出的变量投影重要性指标(variable importance in projection,VIP)值大小对分类重要的变量进行衡量。VIP值越大,对分组贡献越大,一般默认VIP值大于等于1的变量具有显著性差异。结果显示,在区分SC与MICT组血清代谢谱中,贡献大小依次为葡萄糖、乳酸、赖氨酸、谷氨酸、胆碱、谷氨酰胺、3-羟基丁酸(图4B,仅显示15个化学位移点);而在区分SC与HIIT组血清代谢谱中,贡献大小依次为葡萄糖、赖氨酸、乳酸、异亮氨酸、3-羟基丁酸、谷氨酰胺、甘油、亮氨酸、胆碱、缬氨酸(图4D)。

图2 各组大鼠血清样本核磁共振波谱特征峰的指认图

图3 各组大鼠血清NMR谱PCA得分图
2.6 差异代谢物的相对浓度改变及胆碱和酪氨酸与力竭时间的相关性
图5显示,与SC组相比,MICT和HIIT组大鼠血清葡萄糖显著降低(P<0.05,图5A和图5B);MICT组大鼠血清中胆碱、谷氨酰胺、赖氨酸和3-羟基丁酸均高于SC组(P<0.05,图5A),HIIT组大鼠血清中胆碱、3-羟基丁酸、谷氨酸、谷氨酰胺、异亮氨酸、亮氨酸、赖氨酸、酪氨酸和缬氨酸均高于SC组(P<0.05,图5B);相关分析显示,HIIT和SC组大鼠血清胆碱(r=0.65,P<0.05,图5C)和酪氨酸(r=0.81,P<0.01,图5D)与力竭时间分别呈显著性和极显著正相关;MICT和SC组大鼠血清胆碱与力竭时间呈显著性正相关(r=0.57,P<0.05,图5E),而MICT和SC组大鼠血清酪氨酸与力竭时间的相关性不显著(r=0.22,P>0.05,图5F)。

图4 各组大鼠血清1H NMR指纹图谱的PLS-DA散点图和VIP图
3 讨论
3.1 HIIT和MICT后大鼠血清代谢组学的适应性改变
动物实验表明,MICT和HIIT均能降低大鼠体脂百分比,增加骨骼肌相对重量,进而提高大鼠运动耐力水平[9]。本研究也证实这一结论。本文表1显示,与SC组大鼠相比,MICT组和HIIT组大鼠的最终体重、肾周脂肪重量及其相对重量降低,股四头肌、腓肠肌及睾丸的相对重量均显著增加,提示MICT和HIIT导致大鼠的体成分发生相似的适应性改变。
本研究进一步研究MICT和HIIT对大鼠血清代谢组学的影响。结果显示,SC与HIIT(图3B)、SC与MICT组(图3A)大鼠血清代谢谱PCA得分图均具有簇类分布,但MICT与HIIT组并无簇类分布(图3C)。提示,MICT和HIIT导致大鼠血清代谢组发生明显改变。然而,仅从PCA中无法区分MICT和HIIT所引起的代谢表型变化差异,这与Pechlivanis等[14]研究结果一致。Pechlivanis等[14]研究发现,8周大强度冲刺间歇训练前后血清代谢组学发生明显改变;但间歇期60 s和间歇期10 s在训练后的血清代谢谱PCA得分图无簇类分布。
本研究参考Zafeiridis等[15]分析方法,采用PLS-DA分别对SC与MICT组、SC与HIIT组的血清指纹图谱分别进行建模,所得的代谢产物变量对分类重要程度由VIP值衡量。VIP图显示(图4B),SC与MICT组差异代谢产物包括葡萄糖、3-羟基丁酸、乳酸、赖氨酸、谷氨酸、谷氨酰胺、胆碱;SC与HIIT组差异代谢产物包括葡萄糖、3-羟基丁酸、乳酸、赖氨酸、缬氨酸、亮氨酸、异亮氨酸、谷氨酰胺、胆碱和酪氨酸(图4D)。本文进一步对上述差异代谢物峰面积进行独立样本T检验后发现,MICT组3-羟基丁酸、胆碱、谷氨酰胺和赖氨酸均高于SC组(图5A);HIIT组支链氨基酸(branched-chain amino acids,BCAAs)、3-羟基丁酸、胆碱、谷氨酰胺、酪氨酸均显著高于SC组(图5B);HIIT和MICT组血清中葡萄糖水平均低于SC组。上述差异代谢产物涉及氨基酸、葡萄糖和脂肪酸等代谢产物改变,这与8周冲刺间歇训练引起的人体血清差异代谢产物的适应性变化相类似[14]。值得指出的是,与MICT组相比,本研究中HIIT组既有相同的代谢倾向,又有其特异性的代谢产物变化。

图5 差异代谢物的相对浓度改变及胆碱和酪氨酸与力竭时间的相关性
3.2 HIIT和MICT诱导的相同血清代谢产物变化
本文图5显示,两种训练方式均能导致大鼠血清中谷氨酰胺和胆碱水平显著增加。与本研究一致的是,Pechlivanis等[14]研究发现,8周大强度冲刺跑训练可导致受试者血清代谢表型中的谷氨酰胺和胆碱浓度呈现显著增加。作为胆碱能神经递质乙酰胆碱生物合成的前体,血清胆碱浓度降低将直接导致中枢系统中乙酰胆碱水平合成、释放和利用减少,引起中枢神经系统调控能力和支配肌肉收缩的神经传导速度下降,进而诱发运动性疲劳[16]。运动前补充胆碱可通过增加血清中胆碱水平来提高运动员有氧耐力和抗疲劳能力[16,17]。与胆碱类似,补充谷氨酰胺也可提高机体运动成绩,这与谷氨酰胺降低肌细胞内血氨和缓冲乳酸浓度有关[18]。动物研究证实,长期运动训练可通过增加小鼠血清代谢表型中谷氨酰胺[19]和胆碱[20]水平提高小鼠运动成绩;而谷氨酰胺在跑步耐力强的小鼠血清中高于跑步耐力差的小鼠[19];Gonzales等[21]的磁共振质子波谱扫描实验也证实,中等强度运动后中老年男性大脑枕叶灰质区的胆碱含量明显高于安静对照组,且与受试者VO2max呈正相关。本研究也证实,HIIT和SC组大鼠血清胆碱(r=0.65,P<0.05,图5C)与力竭时间分别呈显著性正相关,MICT和SC组大鼠血清胆碱(r=0.57,P<0.05,图5E)与力竭时间也呈显著正相关,提示血清胆碱可作为上述两种训练方式提高大鼠耐力成绩的共同代谢标示物。
本研究还发现,HIIT和MICT组大鼠血清中的3-羟基丁酸(长链脂肪酸不完全氧化的代谢产物)增加的同时,葡萄糖含量显著减少(图5A和B)。业已证实[22],3-羟基丁酸可作为高效的能量底物为骨骼肌和大脑供能,也能通过加速肌糖原生物合成来提高有氧耐力。Pechlivanis等[14]对运动员尿液代谢组学研究发现,3-羟基丁酸在急性大强度运动后增加并于1 h达到峰值,但运动后2 h回到基线水平。Huang等[23]在大鼠一次性力竭运动和重复性训练后,采用传统生化技术测定也发现3-羟基丁酸在血清中增加,而重复性训练比单次长时间运动更容易促进机体脂肪分解代谢。提示,长期HIIT和MICT均可加速机体脂肪酸代谢,进而减少运动过程对葡萄糖的过度依赖。
此外,血清中的赖氨酸在运动组中也显著增加(图5A和B)。赖氨酸作为肉毒碱生物合成的前体物质参与线粒体脂肪酸β氧化过程[24]。研究证实[24],赖氨酸补充可抑制力竭运动大鼠心脏和肝细胞凋亡,延长力竭时间。Falegan等[19]也证实,跑步能力强的小鼠血清赖氨酸储备量高于跑步能力弱的小鼠。同样,Xiang等[25]对健康安静组、健康耐力运动组、2型糖尿病安静组和2型糖尿病耐力运动4个组大鼠的血清进行代谢组学分析后也发现,与健康安静组相比,2型糖尿病大鼠血清中赖氨酸水平降低,但耐力运动能提高健康大鼠血清中赖氨酸水平,进而改善骨骼肌脂肪酸β氧化速率。Taylor等[26]研究进一步表明,赖氨酸补充能促进小鼠骨骼肌脂肪分解基因表达和骨骼肌糖原的合成,抑制肌细胞内脂肪合成过程。综上可知,HIIT和MICT训练模式可能通过赖氨酸促进脂肪酸分解,同时也通过增加骨骼肌胰岛素敏感性和糖原合成酶蛋白表达来提高大鼠肌糖原含量,使机体能量代谢趋于脂肪酸分解代谢转变,从而维持运动过程中血糖稳态[19]。
3.3 HIIT诱导特异的血清代谢产物变化
值得指出的是,本文图5B显示,BCAAs和酪氨酸两个代谢产物在HIIT组特异性增加。BCAAs包括亮氨酸、异亮氨酸和缬氨酸三种具有支链碳骨架的氨基酸。大强度运动过程中,BCAAs既可经支链α酮酸脱氢酶分解并为骨骼肌收缩供能,也能参与肝脏糖异生和肌肉蛋白质合成等过程;血清BCAAs含量降低将引发苹果酸/天冬氨酸穿梭、丙氨酸和谷氨酰胺合成降低,导致骨骼肌细胞内的血乳酸/丙酮酸比值和氨水平增加,引起骨骼肌收缩机能下降[27]。
作为芳香族氨基酸,酪氨酸是合成儿茶酚胺类神经递质多巴胺、肾上腺素和去甲肾上腺素的前体,同时也可以通过分解转变成为延胡索酸和乙酰乙酸进入三羧酸循环[27]。研究认为[28],脑内多巴胺含量与肌肉协调能力以及耐力运动成绩呈正相关。动物实验也表明[20],长期自主转轮运动和耐力运动也能增加血清代谢表型中酪氨酸含量;跑步耐力强的小鼠血清酪氨酸水平显著高于跑步耐力弱的小鼠[29]。与本研究结果一致的是,Duft等[27]对22名中年肥胖男子进行24周的力量联合耐力训练后发现,运动组血清中的酪氨酸和BCAAs浓度均高于对照组,且酪氨酸与受试者VO2max呈正相关。基于前人研究[20,22,29]和本文图5的结果提示:酪氨酸和BCAAs可作为HIIT诱导机体代谢适应性变化的特异性标示物,其中酪氨酸代谢变化可能与HIIT组大鼠耐力水平的改善有关(r=0.81,P<0.01)。
4 总结
4.1 与安静对照组相比,高强度间歇训练组和中等强度持续训练组相同的差异代谢产物包括葡萄糖、3-羟基丁酸、乳酸、赖氨酸、谷氨酸、谷氨酰胺、胆碱;支链氨基酸和酪氨酸在高强度间歇训练组大鼠血清中特异性增加,表明长期高强度间歇训练后机体呈现出与中等强度持续训练不同的代谢适应性变化。
4.2 共同差异代谢物中的胆碱与力竭时间呈正相关,表明10周高强度间歇训练和中等强度持续训练对大鼠运动耐力的提升均可能与胆碱代谢改变有关。
4.3 高强度间歇训练组特异代谢物酪氨酸与力竭时间呈正相关,表明酪氨酸代谢的改变与高强度间歇训练组大鼠耐力水平增强有关。
