8周间歇有氧运动对老龄食源性肥胖大鼠下丘脑LKB1-AMPK信号通路和能量摄入的影响
2019-02-12任华史娇娇常波
任华 史娇娇 常波
1贵州财经大学体育工作部(贵阳 550025)
2辽宁医学院体育教研部 3沈阳体育学院运动人体科学学院
下丘脑是调节机体能量代谢平衡的高级神经中枢,能够调节机体的摄食行为以及脂肪的分解[1],在肥胖症的形成及发展中起着重要作用。下丘脑5'-单磷酸腺苷激活的蛋白激酶(AMP-activated protein kinase,AMPK)被认为是中枢神经系统中的营养和葡萄糖传感器,也是食欲调节器[2]。AMPK是一个由α催化亚基,β、γ调节亚基组成的异源三聚体,广泛存在于机体骨骼肌、肝脏、脂肪及下丘脑等组织中。AMPK只有磷酸化后才具有活性,去磷酸化后则活性丧失。丝/苏氨酸蛋白激酶11(serine/threonine-protein kinase11,STK11/LKB1)是一种十分重要的AMPK激酶,能够促使AMPK磷酸化而激活,在缺乏LKB1表达的细胞中或在LKB1基因被敲除的啮齿动物中AMPK不能被激活[3]。AMPK调节脂质代谢的一个机制是磷酸化乙酰辅酶A羧化酶(acetyl CoA Carboxylase,ACC)从而使其失去活性。ACC是脂肪酸合成过程中的限速酶,也是长链脂肪酰基辅酶A转运至线粒体进行β-氧化的抑制剂。Savage研究显示[4],ACC1和ACC2基因敲除后脂肪酸持续氧化分解,增加能量消耗并减少脂肪的摄入。因此,下丘脑LKB1-AMPK信号通路在肥胖症的形成中起着非常关键的作用。
中小强度的有氧运动是目前治疗肥胖的有效方法,有氧运动能够改善机体能量代谢,促进脂肪的氧化分解。Sriwijitkamol等研究显示[5],运动能够修复肥胖所引起的肌肉组织AMPK活性的受损。衣雪洁等研究[6-8]同样发现,肥胖导致SD雄性大鼠肝脏、脂肪、肌肉等外周组织AMPK活性受损,而经过一段时间的有氧运动训练,伴随着大鼠体重的显著降低,AMPK活性显著提高,ACC活性显著下降。然而,当前研究大多集中于肌肉、脂肪、肝脏等外周组织,迄今为止未见肥胖和间歇有氧运动对下丘脑这一机体能量调节的高级中枢组织中LKB1-AMPK信号传导通路及其能量摄入变化的系统研究。鉴于此,本研究建立饮食诱导的老龄雄性肥胖大鼠模型,观察8周间歇有氧运动对下丘脑LKB1-AMPK信号通路各因子基因表达的影响,同时观察肥胖和间歇有氧运动状态下大鼠能量摄入的变化。
1 对象与方法
1.1 实验动物与分组
选用60周龄雄性SD大鼠60只,体质量580±20 g,由中国人民解放军军事医学科学院动物中心提供。将动物分笼饲养在环境温度22±5℃的鼠笼中,每笼2只,并保持12 h/12 h的明暗周期(每日07:00至19:00给予光照),自由饮食、饮水。
为了让大鼠适应新的饲养环境,所有大鼠在实验的第1周自由采食普通饲料和水。然后将大鼠随机分为2组:给予普通饲料的普通膳食组(CF组,n=30)和给予高脂饲料的高脂膳食组(HF组,n=30)组。本次实验所采用的大鼠饲料成分如表1所示。经过8周的饮食干预,HF组大鼠体重超过CF组大鼠平均体重的20%即为肥胖建模成功[9]。本实验中,共有22只大鼠达到肥胖大鼠的标准,肥胖造模成功率为73.3%。8周后从CF组大鼠中随机选取16只体重正常大鼠,分为普通饲料安静组(NC组,n=8)和普通饲料运动组(NE组,n=8),继续自由进食普通饲料和饮水;从HF组肥胖造模成功的大鼠中随机选取 16只,分为肥胖安静组(OC组,n=8)和肥胖运动组(OE组,n=8),继续自由进食高脂饲料和饮水。每天详细记录各组大鼠食物摄入量(g/day),计算出各组大鼠平均每天的能量摄入量(kcal/day),每周定时(8:00~10:00)称大鼠体重(g)并观察大鼠健康状况。

表1 实验饲料的组成
1.2 间歇有氧运动方案
NE组和OE组大鼠进行间歇性游泳运动训练,为了减轻水诱导的应激反应,首先让大鼠进行为期2天、每天10~20 min的适应性游泳训练。大鼠训练场所为直径45 cm、水深60 cm的圆形塑料游泳池,水温34~35℃,每2~3只为一组。间歇有氧运动实验设计依据Luciano等报道的方案[10](根据本研究预实验结果稍作调整),具体训练方案如表2所示。

表2 每周游泳时间与间歇时间(min)
1.3 组织提取
所有组别大鼠在NE组和OE组大鼠最后一次游泳训练后24 h,在硫喷妥钠(200 mg/kg,NIH推荐)麻醉下,处死大鼠,迅速取下丘脑组织,投入液氮内,移入-80°C冰箱进行保存,以备RNA提取和实时定量荧光PCR检测。
1.4 RNA的提取和实时PCR
用RNAiso Plus(Takara,China)提取冷冻下丘脑的总RNA,并在260/280 nm紫外吸收测定浓度。采用PrimeScript RT reagent kit(Takara,China)试剂盒进行RNA样品逆转录。用7900HT型荧光定量PCR仪(Applied Biosystems,USA)分析实时定量PCR和后继的数据处理。β-actin表达不受任何干预影响,测定βactin水平作为内参,β-actin的浓度作为所有mRNA数据的相对单位。引物序列见表3。
1.5 统计分析
实验所得所有数据均用均数 ±标准差(±s)表示。统计分析用SPSS 20.0进行单因素方差分析,确定NC组与NE组、OC组以及OC组与OE组的组间是否有显著差异,P<0.05表示差异具有统计学意义。

表3 实时PCR引物序列
2 结果
2.1 各组大鼠体重变化
如表4所示,8周饲养后,HF组大鼠体重显著高于CF组(P<0.01)。8周间歇有氧训练后,NE组大鼠体重显著低于NC组(P<0.01),OC组大鼠体重显著高于NC组(P<0.01),OE组大鼠体重显著低于OC组(P<0.01)。
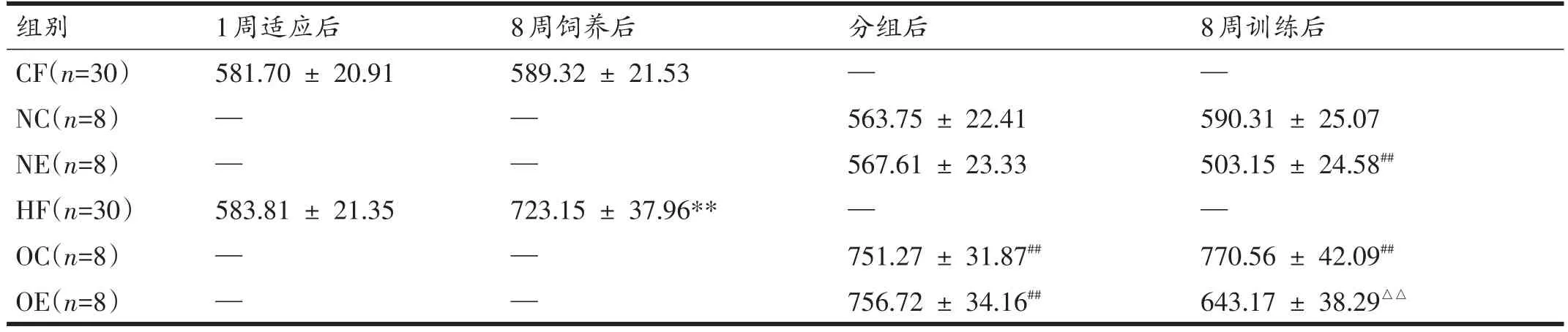
表4 各组大鼠体重比较(g)
2.2 各组大鼠能量摄入变化
如表5所示,在间歇有氧运动训练的8周里,OC组大鼠平均每天的食物摄入量和能量摄入均显著高于NC组大鼠(P<0.01);而NC与NE组相比、OC组与OE组相比,均无显著性变化(P>0.05)。
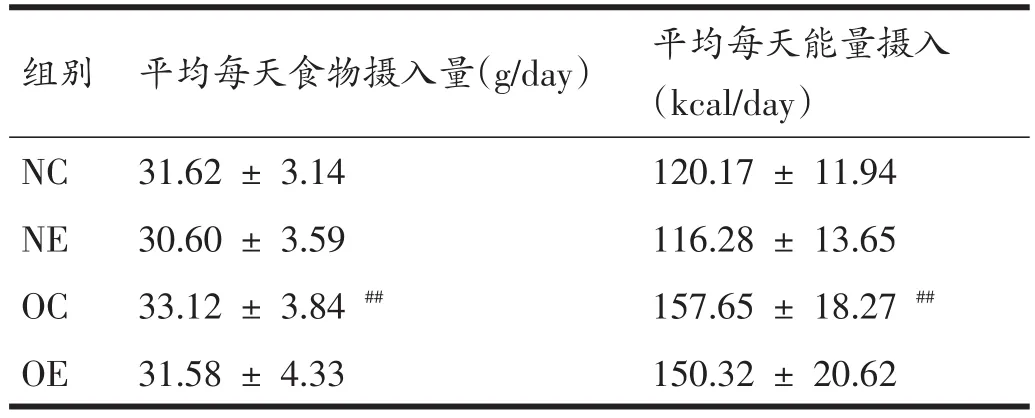
表5 每组大鼠平均每天食物摄入量和能量摄入比较(n=8)
2.3 各组大鼠下丘脑LKB 1、AMPK、ACC基因转录情况
如图1所示,与NC组大鼠相比,肥胖引起OC组大鼠下丘脑LKB1、AMPKα1、AMPKα2的基因表达均显著降低(P<0.01或P<0.05),ACC基因表达显著增高(P<0.01)。而经过8周的间歇有氧运动训练,与NC组大鼠相比,NE组大鼠LKB1、AMPKα1、AMPKα2基因表达显著增高(P<0.01或P<0.05),ACC基因表达显著下降(P<0.05);与OC组大鼠相比,OE组大鼠下丘脑LKB1、AMPKα2的基因表达均显著增高(P<0.01),ACC基因表达显著降低(P<0.01),AMPKα1基因表达未出现显著变化(P>0.05)。
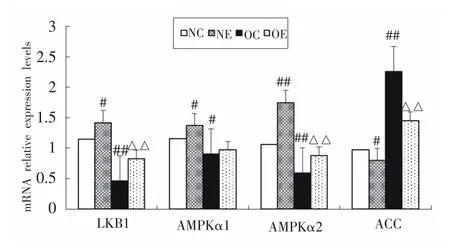
图1 各组大鼠下丘脑LKB1、AMPK、ACC mRNA表达水平(n=8)
3 讨论
AMPK在下丘脑调节机体能量平衡中起着关键作用。AMPK的α1、α2、β1和γ1亚基在下丘脑的弓状核(ARC)、室旁核(PVN)、腹内侧核(VMH)和外侧区(LHA)中高度表达[11,12],AMPK的功能主要由α1和α2亚基决定,AMPKα2亚基对AMP的敏感性要更高并且代表了整个AMPK约80%的活性。下丘脑可以通过AMPK活性的变化调节机体对食物的摄取,研究显示[12-14]:生理条件下,使用激活剂激活下丘脑AMPK,促进了摄食和体重增加,而使用抑制剂抑制下丘脑AMPK的表达则可以减少食物摄入量和体重。LKB1参与脂肪合成与分解的调节[15],当LKB1与STRAD、MO25组成异源三聚体时,可以直接作用于AMPKα亚基中的苏氨酸172(Thr-172),使其变构和磷酸化而被激活,同时可以抑制该位点其它相应磷酸酶的去磷酸化作用。乙酰辅酶A羧化酶(ACC)和肉碱棕榈酰转移酶-1(CPT-1)分别是脂肪酸合成和氧化分解过程中非常重要的限速酶。ACC可以作用于乙酰辅酶A使其羧化生成丙二酰辅酶A(MCoA),MCoA再在脂肪酸合成酶(FAS)的作用下进一步合成脂肪酸。生理条件下,细胞内MCoA浓度的增高能够抑制CPT-1的活性,从而抑制脂肪酸的氧化分解。活化的AMPK可以直接作用于ACC,使ACC磷酸化后失去活性,降低细胞内MCoA水平,解除对CPT-1的抑制,脂肪酸氧化分解增强。
3.1 肥胖对大鼠下丘脑LKB 1-AMPK信号传导通路及能量摄入的影响
肥胖会降低小鼠下丘脑和骨骼肌AMPK的活性[16]。在对肥胖大鼠的研究中发现[17,18],肥胖引起大鼠下丘脑和脂肪组织中LKB1、AMPK活性降低。本研究中,RT-PCR结果显示,与NC组大鼠相比,OC组大鼠下丘脑的LKB1、AMPKα1、AMPKα2的基因表达均显著降低(P<0.01或P<0.05),ACC基因表达显著增高(P<0.01)。这与衣雪洁等[6-8]对肝脏、脂肪、肌肉等外周组织研究结果基本一致,提示,下丘脑中高脂膳食引起的肥胖同样抑制了LKB1-AMPK信号通路的传导,ACC表达升高,促进了脂肪酸合成,抑制了脂肪酸的氧化分解。
本研究还显示(如图1、表5所示),与NC组大鼠相比,OC组大鼠下丘脑LKB1、AMPK活性均显著降低,但大鼠食欲未受抑制且食物和能量摄入均显著增加,这与很多研究显示的生理条件下,下丘脑AMPK活性的升高能够刺激食欲,而AMPK活性的降低会抑制食欲[12-14]并不一致。Marc Claret研究显示[19],在小鼠弓状核POMC神经元中特异性敲除AMPKα2亚基会引起小鼠食欲过多而导致肥胖,但在AgRP神经元中敲除AMPKα2亚基则会引起年龄依赖性体重降低。在对肥胖小鼠的研究中发现[16],肥胖小鼠进食量增加的同时,下丘脑室旁核(PVN)AMPK活性却显著降低,弓状核(ARC)和内侧核(MH)的AMPK活性也有降低的趋势,这与我们对肥胖大鼠的研究结果基本一致。提示,下丘脑内能量平衡调节机制更加精细,同时,肥胖会改变下丘脑内AMPK对食物摄入的调节。已有研究发现,下丘脑弓状核(ARC)内和摄食有关的神经元主要有两种类型:NPY神经元和POMC神经元,其可以分泌两种功能相反的神经肽,其中NPY/AGRP主要起着促进食欲并减少能量支出的作用,而POMC/CART神经肽主要起着抑制食欲并增加能量支出的作用。研究显示[20],下丘脑内AMPK活性的变化主要作用于NPY神经元引起食欲的变化,而下丘脑内抑制食欲的POMC神经元并不受AMPK活性的影响[17,20]。Wang等研究发现[17],大鼠下丘脑注射AICAR激活剂激活AMPK后,肥胖组大鼠NPY表达显著高于普通对照组,提示肥胖大鼠下丘脑NPY神经元对AMPK更敏感。我们推测,在本研究中,一方面,肥胖引起下丘脑POMC神经元抑制,对食欲的抑制作用减弱,大鼠能量摄入增加,而且这种变化不受AMPK活性的影响;另一方面,长时间高脂膳食导致肥胖大鼠对高能量摄入产生的一种负反馈调节,使得肥胖大鼠在下丘脑AMPK活性较低的情况下NPY高表达,两者共同作用致使肥胖大鼠食物和能量摄入的增加。这一推测尚需进一步研究。
3.2 间歇有氧运动对大鼠下丘脑LKB 1-AMPK信号传导通路及能量摄入的影响
衣雪洁等研究显示[6-8],运动能够激活肝脏、脂肪、肌肉等外周组织AMPK活性,并降低了ACC活性。而在下丘脑,Andersson等发现[21]长时间剧烈运动期间及运动后大鼠下丘脑AMPK活性。ACC磷酸化均未出现显著变化。Ropelle等研究显示[22],2次3 h的游泳运动后大鼠下丘脑AMPK的活性显著增高。因此,由于运动强度。运动持续时间以及研究组织的差异,运动对LKB1-AMPK信号通路的影响并不一致,仍需进一步研究。本研究中,RT-PCR结果显示(如图1所示),与NC组大鼠相比,NE组大鼠LKB1、AMPKα1、AMPKα2基因表达显著增高(P<0.01或P<0.05),ACC基因表达显著下降(P<0.05);与OC组大鼠相比,OE组大鼠下丘脑LKB1基因表达均显著增高(P<0.01),ACC的基因表达显著降低(P<0.01),AMPKα1基因表达虽然未出现显著变化(P>0.05),但代表AMPK80%活性的AMPKα2基因表达仍显著增高(P<0.01)。这提示,8周间歇有氧运动激活了下丘脑LKB1-AMPK信号通路的传导,ACC表达降低,促进了脂肪酸氧化分解,抑制了脂肪酸的合成,进而促使大鼠体重的降低。
本研究还显示(如图1、表5所示),分别与NC组、OC组大鼠相比,NE组、OE大鼠下丘脑LKB1、AMPKα2活性显著提高的同时,大鼠食物和能量摄入均无显著变化。Ropelle研究发现[22],运动促使大鼠下丘脑AMPK活性提高的同时,促进了食欲的抑制作用。韩洁研究发现[23],分低(L)、中(M)、高(H)三个剂量组对成年SD大鼠下丘脑注射过表达LKB1腺相关病毒(AAV)后,3个过表达组(H、M、L)LKB1和p-AMPKα蛋白表达均显著高于对照组;同时与对照组相比,3个过表达组大鼠脂肪重量均显著下降,但大鼠进食量无显著差异,这与本研究结果相似。我们推测,一方面,间歇有氧运动能够进一步激活下丘脑弓状核(ARC)内POMC神经元的抑制作用,食欲抑制作用增强;另一方面,间歇有氧运动后大鼠下丘脑内AMPK活性增强,刺激NPY神经元,食欲增加,两者的共同作用使得NE组、OE组大鼠食物和能量摄入并未出现显著变化。这一推测尚需进一步研究。
4 结论
本研究在高脂膳食所引起的老龄肥胖大鼠下丘脑中检测到LKB1-AMPK信号传导的失调以及ACC基因表达的显著增加,同时肥胖大鼠能量摄入也显著增加。而8周的间歇有氧运动通过上调下丘脑LKB1-AMPK信号传导通路各因子的基因表达水平,抑制ACC基因表达,促进脂肪的氧化分解,同时,大鼠的能量摄入并未增加,两者的共同作用抑制了高脂膳食所引起的大鼠体重的增加。本研究表明,下丘脑LKB1-AMPK信号传导通路在间歇有氧运动治疗老年肥胖中起重要作用。
