乌桕对南方根结线虫与地上不同食性昆虫互作的光合生理响应
2019-02-10刘亚珍项瑶郭文锋高旭李晓琼
刘亚珍 项瑶 郭文锋 高旭 李晓琼

摘要 :本文通過比较乌桕对两种地上不同食性昆虫(专食性癞皮夜蛾、广食性斜纹夜蛾)与南方根结线虫互作的光合生理响应,分析不同空间植食性生物间的互作关系及植物的响应机制。结果表明:无南方根结线虫胁迫下,2种地上不同食性昆虫对乌桕的净光合速率(Pn)、气孔导度(Gs)及胞间CO2浓度(Ci)的影响与对照组无显著差异;而南方根结线虫胁迫下,2种地上昆虫显著降低了乌桕Gs及Ci。其中,与对照组及癞皮夜蛾处理组相比,南方根结线虫与斜纹夜蛾的共同胁迫显著降低了乌桕Pn、Gs及Ci。此外,斜纹夜蛾为害增加了乌桕叶绿素含量,南方根结线虫胁迫降低了叶绿素含量。因此,南方根结线虫与斜纹夜蛾间形成一种加性效应,并对乌桕光合生理产生了拮抗效应,而这种效应在南方根结线虫与癞皮夜蛾间并不显著。由此可见,乌桕对地上地下植食性生物胁迫形成不足补偿机制,且具体的响应机制与植食性生物的食性相关。
关键词 :植食性生物互作; 专食性; 广食性; 光合生理; 叶绿素
中图分类号:
S 433
文献标识码: A
DOI: 10.16688/j.zwbh.2018473
Photosynthetic physiology responses of Sapium sebiferum to the interactions between
Meloidogyne incognita and aboveground herbivores with different diet breadths
LIU Yazhen1, XIANG Yao1, GUO Wenfeng2, GAO Xu1, LI Xiaoqiong1,3
(1. Guangxi Key Laboratory of Forest Ecology and Conservation, Forestry College, Guangxi University, Nanning 530005, China;
2. Guangxi Crop Genetic Improvement and Biotechnology Laboratory, Nanning 530007, China;
3. Guangxi Youyiguan Forest Ecosystem Research Station, Pingxiang 532600, China)
Abstract
To compare the interactive patterns of herbivores from different spaces and plant response mechanisms, the photosynthetic physiology responses of Sapium sebiferum to the interactions between two aboveground herbivores with different diet breadths (the specialist Gadirtha inexacta and the generalist Spodoptera litura) and Meloidogyne incognita were compared. The results showed that, without M.incognita herbivory, there was no significant differences in the net photosynthetic rate (Pn), stomatal conductance (Gs) and intercellular CO2 concentration (Ci) of S.sebiferum among the two aboveground herbivores and the control. With the presence of M.incognita, the two aboveground herbivores significantly reduced the Gs and Ci of S.sebiferum. Compared with the control and the G.inexacta herbivory, the synergistic herbivory by M.incognita and S.litura significantly reduced Pn, Gs and Ci. Furthermore, S.litura herbivory increased the chlorophyll content, while M.incognita significantly decreased the chlorophyll content of S.sebiferum. Therefore, M.incognita and S.litura exerted an additive effect on each other, resulting in an antagonistic effect on the photosynthetic physiology of S.sebiferum. However, this pattern was not found between M.incognita and G.inexacta. Therefore, S.sebiferum formed an insufficient compensation mechanism to respond above and below ground herbivore interactions, and the specific responses are closely related to the diet breadths of herbivores.
Key words
herbivore interactions; specialist; generalist; photosynthetic physiology; chlorophyll
在一定的植食性生物密度和为害范围内,植物光合生理具有一定的自然补偿能力。被植食性生物取食后,植物主要表现出三种补偿机制:植食性生物为害对植物生长有害即不足补偿[1];被植食性生物取食植物不受影响即完全补偿[2];植食性生物取食利于植物生长即超越补偿[3]。被某些病虫害侵染后植物光合作用增强,如Essigella californica取食辐射松Pinus radiata[4];相反地,被某些病虫害侵染使植物光合作用降低[5],如日本金龟子Popillia japonica取食大豆Glycine max[5]、二斑叶螨Tetranychus urticae为害棉花Gossypium spp.[6]。植物介导的地上地下植食性生物互作在塑造植食性生物群落动态和群落结构中具有重要作用[78]。此外,植食性生物的食性也是影响植物 植食性生物互作的重要因素[89]。然而,已有的研究多集中于单一空间/食性下植食性生物对植物光合生理的影响[10],鲜少涉及地上地下植食性生物互作及来自不同空间植食性生物对植物光合生理的影响[1112]。
乌桕Sapium sebiferum隶属大戟科Euphorbiaceae乌桕属Sapium,落叶乔木,观赏价值高,是重要的药用材料和化工原料[1314]。为害乌桕的植食性生物种类繁多[15],常见的有专食性癞皮夜蛾Gadirtha inexacta、乌桕卷象Apoderus bicallosicollis,广食性油桐尺蠖Buzura suppressaria、斜纹夜蛾Spodoptera litura等地上植食性生物及南方根结线虫Meloidogyne incognita等地下植食性生物[1516]。这些地上、地下植食性生物时常同时发生,共同对乌桕的生长造成危害。Huang等[17]发现红胸律点跳甲Bikasha collaris地上成虫促进地下同种幼虫的存活,而幼虫的存在抑制了成虫的存活。而Li 等[18]研究发现有地下昆虫存在时,乌桕卷象的取食和红胸律点跳甲的存活率都显著降低。研究地上、地下植食性生物互作对乌桕光合生理的影响,能深入了解乌桕生理生态响应机制,为今后更好地开发利用乌桕及其虫害防治提供理论依据。然而,以往这方面的研究较少。因此,本研究通过比较地上2种不同食性植食性生物(专食性癞皮夜蛾、廣食性斜纹夜蛾)与南方根结线虫互作下乌桕的光合生理响应,以揭示地上地下植食性生物互作机制,进一步阐明植物对地上地下植食性生物互作的生理响应机理。
1 材料与方法
1.1 供试材料的准备
所有供试苗木均为乌桕幼苗。乌桕种子于广西桂林植物研究所内采集,参照刘亚珍等[19]的方法对乌桕种子进行层积处理。2017年6月初,将种子放于装有体积为50%壤土和50%草炭土的苗盘,在广西大学林学院实验基地温室内育苗。7月底,选择生长状况良好、长势一致的乌桕幼苗移栽到装有50%壤土和50%草炭土的灭菌土壤的花盆中,每盆1株。植物随机摆放,为隔绝其他昆虫取食,用80目尼龙网罩(高100 cm,直径27 cm)罩住整个植株。试验采用全因子设计,即地上3种处理(癞皮夜蛾、斜纹夜蛾、对照)×地下2种处理(南方根结线虫、无线虫),共6个处理,每处理5次重复,共30盆植物。
试验所需癞皮夜蛾和斜纹夜蛾均在野外大发生时采集,并在实验室内进行人工饲养,以获得虫龄一致的2龄幼虫进行试验。南方根结线虫在番茄苗根部进行扩繁,备用。
1.2 地上、地下植食性生物取食处理
南方根结线虫悬浮液的配制参考刘维志[20]的方法,2龄幼虫的浓度为2 000头/mL。线虫接种参照刘亚珍等[19]的方法,向南方根结线虫处理组加入2 mL上述南方根结线虫悬浮液,同时在无线虫组加入2 mL无菌水。
1个月后,选取根部有10个左右明显根结、长势一致的乌桕幼苗开展试验。在对应的地上不同食性昆虫处理组放置1头癞皮夜蛾或斜纹夜蛾2龄幼虫,连续取食7 d后移走。每隔20 d,重复进行1次地上昆虫取食处理,共取食3次。地上昆虫取食处理结束7 d后,进行乌桕光合生理测定。
1.3 测定指标及方法
光合指标:用Li 6400便携式光合测定仪,选取被测植株顶端完全展开且正常生长的第3~5片叶进行光合指标测定。设定光照强度(PAR)为1 500 μmol/(m2·s),测定时间为08∶00-18∶00,测定指标包括净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci),并计算水分利用效率(WUE=Pn/Tr)。
光合 光响应测定:利用Li 6400便携式光合作用测定系统测定光合 光响应曲线。光合有效辐射设定为0、50、100、200、400、600、800、1 000、1 200、1 500 μmol/(m2·s)。采用非直角双曲线模型[21],结合一般线性模型对光响应曲线进行拟合,得到最大净光合速率(Pmax)、暗呼吸速率(Rd)、表观光合量子效率(φ),并计算光饱和点(LSP)及光补偿点(LCP)。
叶绿素含量:使用便携式叶绿素测定仪(SPAD 502 plus),测定乌桕叶片叶绿素含量,每株乌桕重复测定4次,取平均值。
1.4 分析统计
采用双因素方差分析比较地上不同食性昆虫及南方根结线虫胁迫对乌桕叶片光合能力的影响,将地下植食性生物处理(南方根结线虫、无线虫)、地上不同食性昆虫处理(癞皮夜蛾、斜纹夜蛾、对照)作为固定因素,并考虑二者的交互效应。对差异显著的因变量,再采用Student Newman Keuls法进行多重比较。所有数据均采用SPSS 20.0 进行统计,并用Sigmaplot 12.5 绘图。
2 结果与分析
2.1 地上不同食性昆虫及地下南方根结线虫对乌桕光合指标的影响
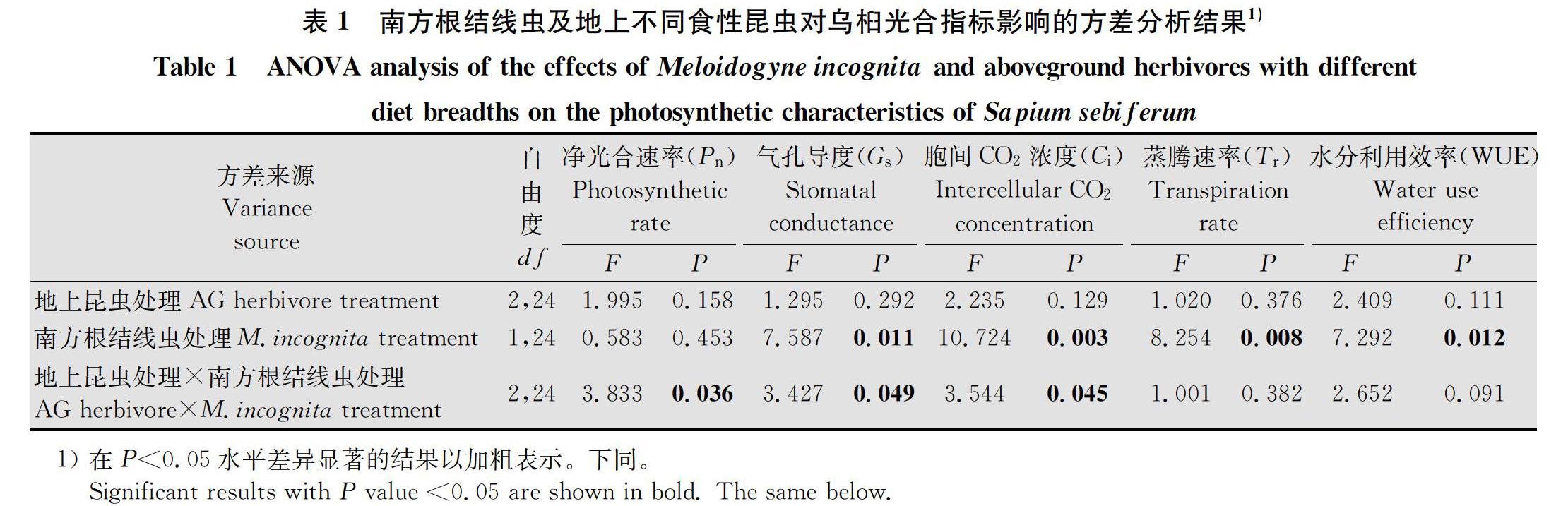
地上昆虫与南方根结线虫互作显著影响乌桕Pn(F2,24=3.833,P=0.036)(表1)。无南方根结线虫胁迫时,地上2种不同食性昆虫对乌桕Pn的影响与对照组间无显著差异;有南方根结线虫胁迫时,癞皮夜蛾处理组乌桕Pn显著高于斜纹夜蛾處理组,与对照组间无显著差异,斜纹夜蛾处理组乌桕Pn与对照组间也无显著差异(图1a)。
南方根结线虫处理(F1,24=7.587,P=0.011)及地上昆虫与南方根结线虫互作(F2,24=3.427,P=0.049)对乌桕Gs有显著影响(表1)。南方根结线虫与斜纹夜蛾协同胁迫下的乌桕Gs显著低于斜纹夜蛾单独胁迫,而其他5种地上地下取食处理(癞皮夜蛾×无线虫、斜纹夜蛾×无线虫、对照×无线虫、南方根结线虫×癞皮夜蛾,南方根结线虫×对照)间的乌桕Gs不存在显著差异(图1b)。
南方根结线虫处理(F1,24=10.724,P=0.003)及地上昆虫与南方根结线虫互作(F2,24=3.544,P=0.045)对乌桕Ci有显著影响(表1)。有南方根结线虫胁迫时,斜纹夜蛾处理组植株Ci显著低于癞皮夜蛾处理组和对照组植株,而癞皮夜蛾处理组与对照组间不存在显著差异;无南方根结线虫胁迫时,地上2种不同食性昆虫未对乌桕Ci造成显著影响(图1c)。
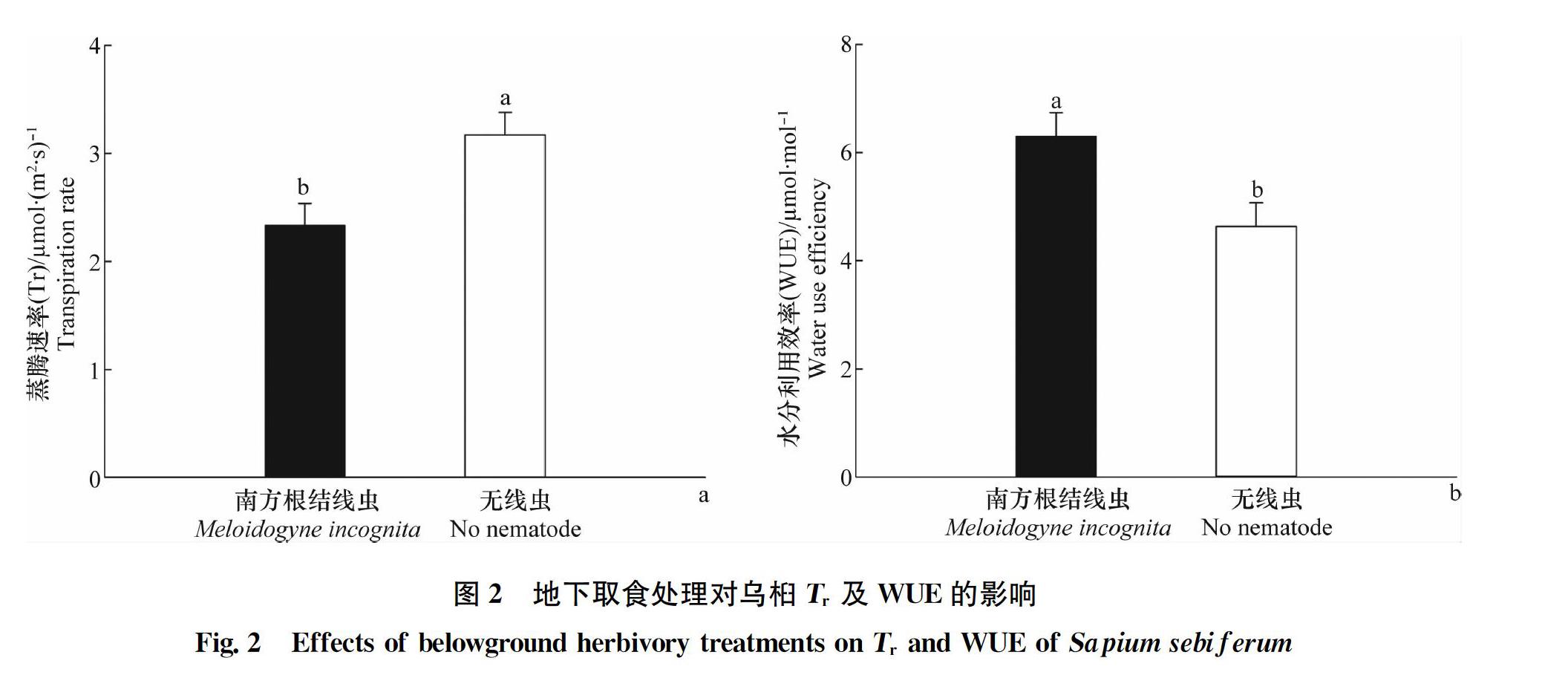
南方根结线虫胁迫对乌桕Tr(F1,24=8.254,P=0.008)及WUE(F1,24=7.292,P=0.012)有显著影响(表1)。在南方根结线虫胁迫下,乌桕Tr显著降低(图2a),而乌桕WUE显著增加(图2b)。地上昆虫胁迫及地上昆虫与南方根结线虫互作对乌桕Tr及WUE未造成显著影响(表1)。
2.2 地上不同食性昆虫及地下南方根结线虫对乌桕光合生理指标的影响
南方根结线虫胁迫对乌桕Pmax(F1,24=9.622,P=0.007)和LSP(F1,24=8.133,P=0.012)有显著影响(表2)。南方根结线虫胁迫显著增大了乌桕Pmax(图3a)和LSP(图3b)。地上不同食性昆虫及地上昆虫与南方根结线虫互作对乌桕Pmax和LSP无显著影响(表2)。
1) 在P<0.05水平差异显著的结果以加粗表示。下同。
Significant results with P value <0.05 are shown in bold. The same below.
2.3 地上不同食性昆虫及南方根结线虫对乌桕叶片叶绿素含量的影响
地上不同食性昆虫(F2,24=4.513,P=0.023)及南方根结线虫处理(F1,24=4.536,P=0.045)对乌桕叶片叶绿素含量有显著影响(表3)。与对照组相比,斜纹夜蛾的取食显著增加了乌桕叶片叶绿素含量,而癞皮夜蛾的取食未对乌桕叶片叶绿素含量产生显著影响,且地上2个处理组间并无显著差异(图4a)。此外,南方根结线虫胁迫显著减少了乌桕叶片叶绿素含量(图4b)。而地上昆虫与南方根结线虫互作(F2,24=0.540,P=0.591)并未对乌桕叶片叶绿素含量造成显著影响(表3)。
3 讨论
本研究发现,无南方根结线虫胁迫情况下,地上不同食性昆虫对乌桕Pn、Gs及Ci无显著影响;而南方根结线虫胁迫情况下,2种地上不同食性昆虫均显著降低了乌桕Gs及Ci。其中,与对照组及癞皮夜蛾处理组相比,南方根结线虫与斜纹夜蛾的共同胁迫显著降低了乌桕Pn、Gs及Ci。此外,斜纹夜蛾为害增加了乌桕叶绿素含量,南方根结线虫胁迫降低了叶绿素含量。因此,南方根结线虫与斜纹夜蛾间形成一种加性效应,从而对乌桕的光合生理产生了拮抗效应,而这种效应在南方根结线虫与癞皮夜蛾间并不显著,说明地上地下植食性生物互作类型受植食性生物食性的影响[19, 22]。类似地,Maron等研究发现为害地上花朵、种子的昆虫与为害根部的蛀虫对羽扇豆Lupinus micranthus种子形成拮抗效应[23];而刘亚珍等[19]发现地上地下害虫互作对乌桕的生长及其生物量分配产生了加性效应。
地上地下植食性生物互作类型及植物的响应受植物种类及基因型[18, 24]的影响。本文中,南方根结线虫与斜纹夜蛾的共同胁迫对乌桕光合生理产生拮抗作用,诱导乌桕形成不足补偿机制。Wurst等[25]发现,一种地下金针虫Agriotes sp.对北美车前草Plantago virginica不同基因型环烯醚萜苷类物质产生不同的诱导响应,从而影响地上昆虫的危害。虫害胁迫后,植物通过自身生长以减弱植食性生物对自身生长发育的危害[26]。Kaplan等[27]发现取食烟草根部的线虫因能阻止烟草防御性物质生物碱的合成,而增加了叶面植食性毛虫的危害,而毛虫的取食诱导增加了烟草向根部的氮转运,又增加了根部线虫的危害水平。
植物对植食性生物胁迫的响应也受植食性生物食性[22]的影响。例如,Huang 等[28]和王毅[29]研究发现美国乌桕种群对专食性昆虫的抗性降低,对广食性昆虫的抗性不变。植食性生物食性对植物生理生态光合特性也能产生很大影响[10, 30]。在本研究中,与对照组和癞皮夜蛾处理组相比,斜纹夜蛾为害显著增加了乌桕叶片叶绿素含量。此外,植食性生物口器类型[9]也会对植物 植食性生物互作产生影响。越来越多的试验表明,咀嚼式口器昆虫主要诱导植物产生茉莉酸介导的防御,而刺吸式口器昆虫则诱导水杨酸介导的植物响应[12, 31]。
叶绿素在植物光合作用吸收和传递光能过程中起重要作用。大部分研究发现病虫害侵染后,植物叶绿素含量呈现降低趋势[3234]。糖槭Acer saccharum被梨带蓟马Taeniothrips inconsequens Uzel取食后叶绿素含量明显降低[34];小蠹虫侵染云南松Pinus yunnanensis Franch.后降低了其叶绿素含量[33]。相反地,蓝桉Eucalyptus globulus遭受虫害后,叶片叶绿素含量反而增加[35];郭素民发现喜旱莲子草Alternanthera philoxeroides在受到害虫胁迫后,其叶绿素含量明显升高[36]。而本研究中,广食性斜纹夜蛾取食显著增加了乌桕叶片叶绿素含量,而南方根结线虫胁迫显著减少了乌桕叶片叶绿素含量,说明植物对不同食性植食性生物胁迫已进化出了不同的响应机制。此外,植物的适应性[37]、病虫害的为害程度及为害持续时间[38]均对植物光合作用机制产生影响。
本文研究发现,乌桕对地上地下植食性生物的胁迫产生不足补偿机制,且与植食性生物的食性及种类相关。因此,研究不同空间植食性生物互作下植物的光合生理特性,能深入了解其生理生态响应策略,阐明植物植食性生物互作及协同进化机制,并为植物病虫害防御提供理论依据[10,23,27]。
参考文献
[1] GARCA I, MENDOZA R. Impact of defoliation intensities on plant biomass, nutrient uptake and arbuscular mycorrhizal symbiosis in Lotus tenuis growing in a saline sodic soil [J]. Plant Biology, 2015, 14(6):964971.
[2] JULIEN M H, BOURNE A S. Compensatory branching and changes in nitrogen content in the aquatic weed Salvinia molesta in response to disbudding [J]. Oecologia, 1986, 70(2):250257.
[3] 盛承發. 生长的冗余—作物对于虫害超越补偿作用的一种解释[J]. 应用生态学报, 1990, 1(1):2630.
[4] EYLES A, SMITH D, PINKARD E A, et al. Photosynthetic responses of field grown Pinus radiata trees to artificial and aphid induced defoliation [J]. Tree Physiology, 2011, 31(6):592603.
[5] ALDEA M, HAMILTON J G, RESTI J P, et al. Indirect effects of insect herbivory on leaf gas exchange in soybean [J]. Plant Cell & Environment, 2010, 28(3):402411.
[6] REDDALL A, SADRAS V O, WILSON L J, et al. Physiological responses of cotton to two spotted spider mite damage [J]. Crop Science, 2004, 44(3):835846.
[7] FORISTER M L, WILSON J S. The population ecology of novel plant herbivore interactions [J]. Oikos, 2013, 122(5):657666.
[8] HUANG Wei, SIEMANN E, LI Xiao, et al. Species specific defence responses facilitate conspecifics and inhibit heterospecifics in above belowground herbivore interactions [J]. Journal of Comparative Physiology, 2014, 197(11):1031 1042.
[9] JOHNSON S N, CLARK K E, HARTLEY S E, et al. Aboveground belowground herbivore interactions: a meta analysis [J]. Ecology, 2012, 93(10):22082215.
[10]ZOU J, ROGERS W E, SIEMANN E. Differences in morphological and physiological traits between native and invasive populations of Sapium sebiferum [J]. Functional Ecology, 2010, 21(4):721730.
[11]ALI J G, AGRAWAL A A. Specialist versus generalist insect herbivores and plant defense [J]. Trends in Plant Science, 2012, 17(5):293302.
[12]SOLER R, ERB M, KAPLAN I. Long distance root shoot signalling in plant insect community interactions [J]. Trends in Plant Science, 2013, 18(3):149156.
[13]张均.浅析乌桕的开发利用[J].林业科技通讯,2007,35(3):2603.
[14]陈景震,张良波,李培旺.乌桕开发利用研究进展[J].湛江师范学院学报,2012,33(3):111113.
[15]张家亮,王毅,丁建清.乌桕害虫名录[J].中国森林病虫,2015,34(5):2535.
[16]洪承昊,陈京元,查玉平.乌桕主要害虫及防治策略[J].湖北林业科技,2010(6):6567.
[17]HUANG Wei, SIEMANN E, YANG Xuefang, et al. Facilitation and inhibition: changes in plant nitrogen and secondary metabolites mediate interactions between aboveground and belowground herbivores [J].Proceedings Biological Sciences,2013,280(1767): 20131318.
[18]LI Xiaoqiong, GUO Wenfeng, SIEMANN E, et al. Plant genotypes affect aboveground and belowground herbivore interactions by changing chemical defense [J]. Oecologia, 2016, 182(4):11071115.
[19]刘亚珍, 覃志伟, 项瑶, 等. 天敌互作对乌桕生长及生物量的影响[J]. 西南林业大学学报(自然科学), 2018, 38(1):196201.
[20]劉维志. 植物病原线虫学[M]. 北京:中国农业出版社, 2000.
[21]叶子飘, 于强. 光合作用光响应模型的比较[J]. 植物生态学报, 2008, 32(6):13561361.
[22]KAPLAN I, SARDANELLI S, DENNO R F. Field evidence for indirect interactions between foliar feeding insect and root feeding nematode communities on Nicotiana tabacum [J]. Ecological Entomology, 2010, 34(2):262270.
[23]MARON J L, SIMMS E L. Rodent limited establishment of bush lupine: field experiments on the cumulative effect of granivory [J]. Journal of Ecology, 2010, 89(4):578588.
[24]HUANG Wei, DING Jianqing. Effects of generalist herbivory on resistance and resource allocation by the invasive plant, Phytolacca americana [J]. Insect Science, 2016, 23(2):191199.
[25]WURST S, VAN DAM N M, MONROY F, et al. Intraspecific variation in plant defense alters effects of root herbivores on leaf chemistry and aboveground herbivore damage [J]. Journal of Chemical Ecology, 2008, 34(10):13601367.
[26]STRAUSS S Y, AGRAWAL A A. The ecology and evolution of plant tolerance to herbivory [J]. Trends in Ecology & Evolution, 1999, 14(5):179 185.
[27]KAPLAN I, HALITSCHKE R, KESSLER A, et al. Physiological integration of roots and shoots in plant defense strategies links above and belowground herbivory [J]. Ecology Letters, 2008, 11(8):841851.
[28]HUANG Wei, SIEMANN E, GREGROYS S, et al. Resource allocation to defence and growth are driven by different responses to generalist and specialist herbivory in an invasive plant[J]. Journal of Ecology, 2010, 98(5):11571167.
[29]王毅. 外来入侵植物防御昆虫能力的进化——以乌桕为例[D].北京: 中国科学院研究生院, 2012.
[30]PATTISON R R, GOLDSTEIN G, ARES A. Growth, biomass allocation and photosynthesis of invasive and native Hawaiian rainforest species [J].Oecologia,1998,117(4):449459.
[31]TOG T, KJF V, JANSEN J J, et al. Correction: plants know where it hurts: root and shoot Jasmonic acid induction elicit differential responses in Brassica oleracea [J/OL]. PLoS ONE, 2013, 8(6):e65502.
