大蒜与黄瓜轮作控制黄瓜疫病及其化感作用初探
2019-02-10吴家庆马琳娜张贺李加云孙俊薇梅馨月朱书生何霞红朱有勇刘屹湘
吴家庆 马琳娜 张贺 李加云 孙俊薇 梅馨月 朱书生 何霞红 朱有勇 刘屹湘

摘要 :傳统农业种植中常将目标作物与化感作物轮作控制土传病害,但对化感作物控病机制研究较少。本文研究了温室大蒜与黄瓜轮作对黄瓜疫病的控制效果,并进一步研究了大蒜组织挥发物和浸提液对甜瓜疫霉Phytophthora melonis及黄瓜种子萌发的影响,以期为利用大蒜与黄瓜轮作控制黄瓜疫病提供理论指导。结果表明,大蒜与黄瓜轮作可以有效降低黄瓜疫病的发生;大蒜不同组织挥发物和浸提液对P.melonis的各生长阶段都表现出显著的抑菌活性,其中蒜瓣的抑菌活性最强,挥发物(紫皮蒜/白皮蒜)在含量0.5 g/皿时对菌丝生长的抑制率均为100%;蒜瓣浸提液(紫皮蒜/白皮蒜)在浓度1.67 mg/mL时对菌丝生长的抑制率分别为32%和45%;在浓度0.25 mg/mL时对游动孢子萌发的抑制率分别为98%和53%。另外,大蒜挥发物和浸提液在低浓度或含量对黄瓜种子的萌发并无显著抑制效果,但在中高浓度或含量会表现出延缓生长的现象。综上所述,大蒜不同组织产生和释放的化合物对P.melonis具有抑制活性,在生产上可以利用大蒜或大蒜秸秆与黄瓜轮作控制黄瓜疫病的发生。
关键词 :大蒜; 黄瓜疫病; 轮作; 挥发物; 浸提液
中图分类号:
S 474
文献标识码: A
DOI: 10.16688/j.zwbh.2018486
A preliminary study on the allelopathy and control of cucumber
blight by garlic cucumber rotation
WU Jiaqing, MA Linna, ZHANG He, LI Jiayun, SUN Junwei, MEI Xinyue,
ZHU Shusheng, HE Xiahong, ZHU Youyong, LIU Yixiang
(Yunnan Agricultural University, Key Laboratory of Agrobiodiversity and Pest Management, Ministry of Education,
State Key Laboratory for Conservation and Utilization Bio Resources in Yunnan, Kunming 650201, China)
Abstract
Allelopathic crop rotation is often used to control soil borne diseases in traditional agricultural planting, but the mechanism of disease control is rarely studied. The effect of garlic cucumber rotation on controlling cucumber blight was verified by greenhouse rotation experiments. The effects of garlic volatiles and extracts on Phytophthora melonis and germination of cucumber seeds were further studied in order to provide a theoretical guidance for controlling cucumber blight by garlic cucumber rotation. The results showed that the rotation of garlic and cucumber could effectively reduce the occurrence of cucumber blight. Moreover, the volatiles and extracts of garlic tissues showed significant bacteriostatic activity to P.melonis at all growth stages, in which garlic cloves had the strongest bacteriostatic activity, and the inhibition rates of volatiles (purple skinned garlic/white skinned garlic) against mycelial growth were 100% and 100%, respectively at 0.5 g/dish; the inhibition rates of the clove extracts (purple garlic skinned/white skinned garlic) against mycelial growth were 32% and 45%, respectively at the concentration of 1.67 mg/mL, and the inhibition rates of extract (purple skinned garlic/white skinned garlic) against spore germination were 98% and 53% at 0.25 mg/mL, respectively. In addition, garlic volatiles and extracts at low concentrations did not significantly inhibit the germination of cucumber seeds, but at medium and high concentrations, the growth of cucumber seeds was delayed. In conclusion, compounds produced and released from different tissues of garlic showed inhibitory activity against P.melonis, and garlic or garlic straws rotated with cucumber can be used to control the occurrence of cucumber blight in production.
Key words
garlic; cucumber blight; rotation; volatiles; extract
农业生物多样性是以自然生物多样性为基础,以人类的生存和发展为动力而形成的人与自然相互作用的多样性系统,是生物多样性的重要组成部分。相对于传统单一种植模式,作物多样性种植具备增加作物产量、提高土地利用效率、促进养分吸收、持续控制作物病害等一系列优势,是增产增效、减少化肥农药使用的重要途径[1]。已有的研究表明,作物多样性种植可以通过以下机理控制地上部气传病害:稀释病原菌、阻隔病虫害协同作用、诱导抗性、改善田间小气候。同时,作物间作和轮作等多样性种植模式也被广泛应用于作物土传病害的防控[2]。
黄瓜疫病(cucumber blight)是由甜瓜疫霉Phytophthora melonis[3]引起的黄瓜Cucumis sativus上的重要病害,病原菌能侵染黄瓜茎、叶片及果实,初期病部缢缩, 后期整株枯死。该病菌主要在土壤和受侵染的病残体中存活,且寄主范围广,国内外报道的许多葫芦科Cucurbitaceae瓜果疫病都由该病原菌引起。黄瓜疫病具有潜育期短,雨季蔓延快的特点,因此在防治时应采用栽培防病为主(合理轮作、适时早播),结合选择抗病品种和及时喷药的综合措施[4]。
轮作是一种传统的种植模式,该种植方式不仅能有效利用耕地,还能减轻作物病害的发生,减少农药用量[2,5]。作物轮作过程中,前茬作物根系分泌物和残留腐解物对病原菌产生的化感效应是轮作可控制病害的主要原因[6]。大蒜Allium sativum是一种具备强化感效应的作物,常被用于间作或轮作控制土传病害的发生[7]。大蒜与烤烟轮作可以有效地控制烟草黑胫病[8]。马铃薯与大蒜间作,可使马铃薯晚疫病的发生受到抑制[9]。大蒜不同组织产生的化学物质对不同受体作物的化感作用及有效浓度不同,大蒜鳞茎提取物[1011]、大蒜根系分泌物[1213]、大蒜秸秆浸提物以及腐解物[1417]、大蒜地上部挥发物等不同部位产生的化学物质均有一定的化感作用[18]。已有研究表明,大蒜与黄瓜轮作能够有效控制黄瓜枯萎病、黄瓜根结线虫等的发生[1920]。 但是关于大蒜与黄瓜轮作控制土传疫病及其相关机制的研究较少。
本文以生物多样性种植控制病害为基础,探讨大蒜黄瓜轮作对黄瓜疫病的控制效果、大蒜不同组织挥发物和浸提液对黄瓜种子的化感作用及其对P.melonis的抑菌活性,以期为利用大蒜与黄瓜轮作减轻黄瓜疫病提供科学依据。
1 材料与方法
1.1 试验材料
黄瓜Cucumis sativus选用昆明本地黄瓜。大蒜Allium sativum选用昆明呈贡紫皮蒜和白皮蒜。供试菌为甜瓜疫霉Phytophthora melonis,由中国农业大学种子病理及杀菌剂药理学研究室提供。
1.2 试验方法
1.2.1 温室试验
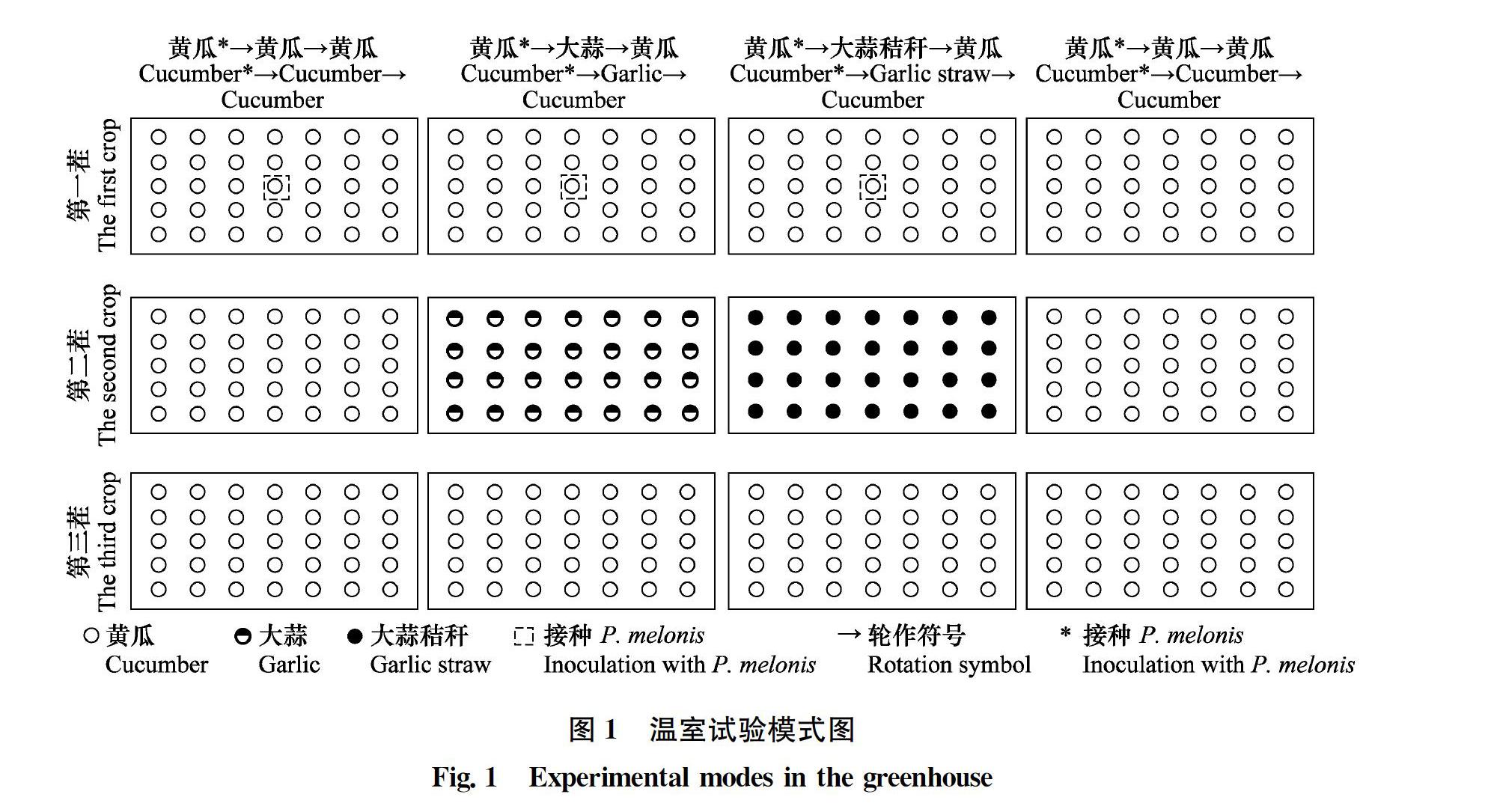
为了探究前茬种植大蒜对后茬黄瓜疫病发生的影响,设计4个处理:1)黄瓜*→黄瓜→黄瓜:黄瓜连作三茬并在第一茬接种P.melonis;2)黄瓜*→大蒜→黄瓜:第一茬种植黄瓜并接种P.melonis,第二茬种植大蒜,第三茬种植黄瓜;3)黄瓜*→大蒜秸秆→黄瓜:第一茬种植黄瓜并接种P.melonis,第二茬将种植时间为30 d的大蒜秸秆(大蒜秸秆来源于2017年10月9日种植的大蒜,种植规格等同于处理2中第二茬大蒜)翻埋于土壤中,第三茬种植黄瓜;4)黄瓜→黄瓜→黄瓜:连作三茬种植黄瓜但不接种P.melonis作为对照。黄瓜出苗后于2017年11月19日、 11月22日、11月26日、12月1日、12月3日、12月8日、12月10日、12月13日、12月16日、12月20日、12月28日、12月30日、1月4日、1月11日、1月17日进行发病率调查,共计15次。试验中将黄瓜种子保湿培养催芽5 d,选择萌发情况一致的黄瓜种子播种在长方形塑料盒(内部尺寸:长80 cm×宽45 cm×深20 cm)中,大蒜株距为8 cm, 黄瓜株距为5 cm,两种作物行距均为11 cm,每个盒子中黄瓜80株,大蒜42株(图1)。轮作中第一茬黄瓜种植时间为2017年8月2日至2017年9月4日,第二茬为2017年10月9日至2017年11月8日,第三茬为2017年11月9日至2018年1月11日。
1.2.2 P.melonis的培养
将P.melonis接种在9 cm马铃薯琼脂培养基(PDA)上,于25℃恒温黑暗条件下培养4 d后备用。
1.2.3 大蒜不同部位挥发物对黄瓜种子萌发和生长的影响
用75%乙醇对蒜瓣和蒜苗(幼苗期:出苗后1个月)根、茎、叶进行表面消毒,并对不同组织进行破碎。具体方法为:将蒜瓣、叶、茎和根浸入75%乙醇中2 min 后用无菌水沖洗3 次,用吸水纸将表面水分吸干,然后用消毒刀片将蒜瓣切碎成边长0.5 cm的小块,大蒜叶用剪刀剪成1 cm2的叶片,大蒜茎和根剪成1 cm小段。分别称取0.5、1、3、5 g,放置于灭菌的6 cm小培养皿中;铺3张灭菌滤纸于直径为15 cm的大培养皿底,将装有大蒜不同组织的小培养皿放置在大培养皿的中心位置,向滤纸上加入10 mL无菌水,再将表面消毒后的黄瓜种子平铺于滤纸上,每皿12粒;以6 cm培养皿底中不加入大蒜组织作为空白对照,每个处理重复3次。在28℃,L∥D=12 h∥12 h的培养箱中分别培养,培养期间各处理通过添加等量无菌水使滤纸保持湿润,每隔24 h记录黄瓜种子发芽率,7 d后分别测量种子的芽长和鲜重,计算种子的发芽指数和活力指数。计算公式为:
发芽率=(发芽终期正常发芽种子数/种子总数)×100%,
发芽势=(第3天正常发芽种子数/种子总数)×100%,
发芽指数(GI)=∑GtDt,活力指数=GI×S;
式中,Gt为浸种后t日的发芽数,Dt为相应发芽日数,发芽势计算日期为3 d,发芽率计算日期为7 d;GI为发芽指数;S为胚芽长度(cm)或种子鲜重(g)。
1.2.4 大蒜不同部位浸提液母液制备及其对黄瓜种子萌发和生长的影响
将新鲜蒜瓣、叶、茎和根浸入75%乙醇中2 min 后用无菌水冲洗3 次,用吸水纸将表面水分吸干,分别称取20 g材料,用研钵研碎成匀浆,按组织∶水=1∶2的比例加入40 mL无菌水并充分振荡,静置4 h后过滤,12 000 r/min高速离心15 min,收集上清液,并过0.22 μm滤膜,得到0.5 g/mL浸提液母液,4℃低温保存。用无菌水将各部位浸提液母液稀释2、12、60、120倍,制成终浓度为250、41.7、8.33、4.17 mg/mL的系列浓度浸提液。
铺3张灭菌滤纸于直径为15 cm的大培养皿底,加入大蒜不同部位系列浓度浸提液10 mL,对照加入无菌水10 mL,再将浸种消毒后的黄瓜种子放置于滤纸上,每皿12粒,每个处理3次重复。在28℃,L∥D=12 h∥12 h的培养箱中分别培养,培养期间各处理通过添加等量无菌水使滤纸保持湿润,每隔24 h记录黄瓜种子发芽率,7 d后,分别测量种子的芽长和鲜重,计算种子的发芽指数和活力指数。计算公式同1.2.3。
1.2.5 大蒜不同部位挥发物对P.melonis的抑菌活性
用75%乙醇对新鲜蒜苗(出苗约1个月)根、茎、叶和蒜瓣进行表面消毒,并对不同组织进行破碎。具体方法为:将蒜瓣、叶、茎和根浸入75%乙醇中2 min 后用无菌水冲洗3 次,用吸水纸将表面水分吸干,然后用刀片将蒜瓣切碎成0.5 cm3的小方块,大蒜叶则用剪刀剪成1 cm2面积叶片,大蒜茎和根剪成1 cm长度。各称取0.5、1、2、3、5 g,置于倒置的9 cm平板培养皿盖上,沿生长4 d的菌落边缘打取直径为7 mm的P.melonis菌饼,将菌饼接于PDA上,然后倒扣于添加不同质量大蒜组织的皿盖上,制成大蒜不同组织挥发物系列含量平板;以不加大蒜组织的PDA平板作为对照,每个处理重复3次,于25℃恒温黑暗培养,4 d以后用十字交叉法测量菌落直径。利用十字交叉法测量出每种含量下菌株的菌落生长直径,求出各平均值带入公式计算。计算公式为:
抑制率=[(对照菌落平均直径-处理菌落平均直径)/对照菌落平均直径]×100%。
1.2.6 大蒜不同部位浸提液对P.melonis的抑菌活性
分别取大蒜浸提液母液0.02、0.05、0.1、0.2、0.5、1、2 mL加入PDA平板培养基中,每个平板培养基的体积为15 mL,使终浓度分别为0.67、1.67、3.3、6.7、16.7、33.67、67 mg/mL。在平板培养基中央接入7 mm直径的P.melonis菌饼,以不加任何物质的PDA平板作为对照,每个处理重复3次,25℃恒温黑暗培养 4 d后用十字交叉法测量菌落直径。计算公式同1.2.5。
制备休止孢悬浮液:将2 mL游动孢子悬浮液加至2 mL冻存管中,用涡旋仪(型号Vortex Genie 2,转速2 000 r/min)振荡6 min,此时游动孢子鞭毛脱落,游动孢子转变为休止孢,所得液体即为休止孢悬浮液。悬浮液含有的游动孢子或休止孢的数量是2×105 个/mL。用无菌水将浸提液母液梯度稀释20、100、200、1 000、2 000、10 000倍,使浓度分别为25、5、2.5、0.5、0.25、0.05 mg/mL, 然后和孢子悬浮液按照1∶1比例进行混合,混合液中大蒜不同部位浸提液最终质量浓度为12.5、2.5、1.25、0.25、0.125、0.025 mg/mL,取P.melonis游动孢子悬浮液和休止孢悬浮液各20 μL分别与不同浓度的浸提液各20 μL在凹玻片上混匀,20℃黑暗保湿培养。5 min后观察休止孢的数量,计算游动孢子休止率。3 h后观察休止孢萌发的数量,计算显微镜视野中休止孢的萌发率。每个处理3次重复。
计算公式:
休止率=休止孢数量/总孢子数量×100%,
萌发率=萌发孢子数量/总孢子数量×100%。
1.2.7 统计分析
试验数据采用IBM SPSS statistics 19以及Microsoft Excel 2013软件进行统计分析,采用Duncan氏新复极差法进行差异显著性分析,利用Microsoft Excel 2013软件进行图表制作。
2 结果与分析
2.1 大蒜黄瓜不同种植模式防控黄瓜疫病的效果
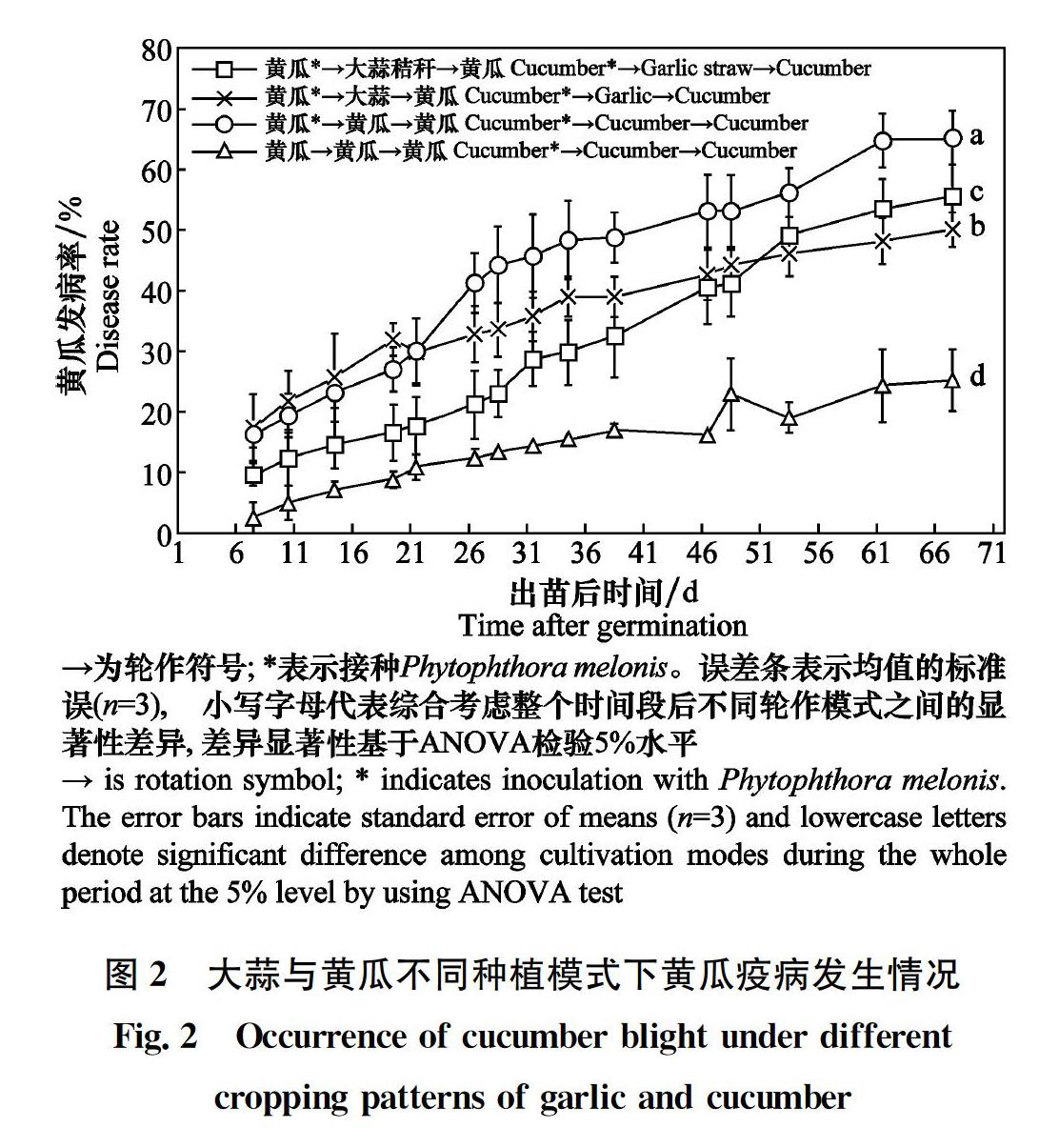
定期监测大蒜与黄瓜轮作对黄瓜疫病发生的影响。结果表明(图2),大蒜与黄瓜轮作能够显著抑制黄瓜疫病的发生和擴散,不同种植模式全生育期黄瓜疫病的平均发病率为:黄瓜*→黄瓜→黄瓜(42.48%)>黄瓜*→大蒜→黄瓜(35.89%)>黄瓜*→大蒜秸秆→黄瓜(29.80%)>黄瓜→黄瓜→黄瓜(14.35%)。其中,黄瓜*→大蒜秸秆→黄瓜对第三茬黄瓜出苗时(1~21 d)的疫病发生有较好的抑制效果,其发病率为9.73%~17.76%。但黄瓜*→大蒜→黄瓜模式在黄瓜快速生长期(21~67 d)有较强的抑菌效果(黄瓜发病率为29.95%~50.06%),而在前期(1~21 d)并无抑菌效果。
2.2 大蒜不同部位挥发物和浸提液对黄瓜种子萌发和生长的影响
2.2.1 大蒜挥发物对黄瓜种子萌发和生长的影响
大蒜不同品种不同部位的挥发物对黄瓜种子萌发的影响表现为低含量无影响或促进,高含量抑制(表1)。
董林林等的研究结果表明,20 mg/mL浓度范围内的大蒜鳞茎浸提液对黄瓜生长有益,但当浓度为40 mg/mL 时, 浸提液对黄瓜发芽率、苗高、根长的抑制作用显著[29]。刘素慧等研究表明大蒜秸秆水浸液对番茄、辣椒和黄瓜具有有利的化感作用,但同时对同属作物具有有害的化感作用[30]。本研究也证明,大蒜挥发物和浸提液在低浓度时对黄瓜种子的萌发无显著抑制效果,但在中高浓度(挥发物≥3 g/皿或浸提液=250 mg/mL)时会表现出延缓生长的现象,因此,在生产中应当制定合理的轮作体系,尽可能地避免化感植物的有害影响并充分利用其有益价值。
综上所述,大蒜能够成为有益的前茬作物,主要源于两个方面,一是大蒜的化感物质对病原菌P.melonis的各个阶段有较强的抑制作用,二是大蒜的化感物质在低浓度下对黄瓜等蔬菜有促生作用。因此,大蒜可以作为前茬有益化感作物控制黄瓜疫病。
参考文献
[1] ZHU Youyong, CHEN Hairu, FAN Jinghua, et al. Genetic diversity and disease control in rice [J]. Nature, 2000, 406(6797): 718.
[2] 朱有勇. 农业生物多样性控制作物病虫害的效应原理与方法[M].北京:中国农业大学出版社, 2012: 305.
[3] WANG Ying, REN Zhong, ZHENG Xiaobo, et al. Detection of Phytophthora melonis in samples of soil, water, and plant tissue with polymerase chain reaction [J]. Canadian Journal of Plant Pathology, 2007, 29(2): 172181.
[4] 张存英. 黄瓜疫病及防治[J]. 北方园艺, 2006(5): 131.
[5] SCHOOFS A, ENTZ M H, VAN A R C, et al. Agronomic performance of pesticide free production under two crop rotations [J].Renewable Agriculture & Food Systems,2005,20(2):91100.
[6] 梁春启,甄文超,张承胤,等. 玉米秸秆腐解液中酚酸的检测及对小麦土传病原菌的化感作用[J]. 中国农学通报,2009, 25(2): 210213.
[7] ICIEK M, KWIECIEN' I, WODEK L. Biological properties of garlic and garlic derived organosulfur compounds [J]. Environmental & Molecular Mutagenesis, 2010, 50(3): 247265.
[8] 釧有聪,张立猛,焦永鸽,等.大蒜与烤烟轮作对烟草黑胫病的防治效果及作用机理初探[J].中国烟草学报,2016,22(5):5562.
[9] 张敬德,周丽娟.蔬菜病虫害防治技术[J].吉林农业,2009(19):3233.
[10]张百俊, 王广印, 陈英照. 大蒜浸提液对西葫芦种子活力及幼苗生长的影响[J]. 河南农业大学学报, 2005, 39(1): 6365.
[11]DONG L L, HAO Z P, ZUO Y M, et al. Effects of garlic bulb aqueous extract on cucumber seedlings, soil microbial counts, and enzyme activities[J]. Communications in Soil Science & Plant Analysis, 2012, 43(22): 28882896.
[12]周艳丽, 程智慧, 孟焕文. 大蒜根系分泌物对不同受体蔬菜的化感作用[J]. 应用生态学报, 2007, 18(1): 8186.
[13]周艳丽, 程智慧, 孟焕文, 等. 大蒜根系水浸液及根系分泌物的化感作用评价[J]. 西北农林科技大学学报(自然科学版), 2007, 35(10): 8792.
[14]程智慧, 佟飞, 金瑞. 大蒜秸秆水浸液的抑菌作用和抑菌成分初步分析[J]. 西北植物学报, 2008, 28(2): 324330.
[15]王春会, 程智慧, 牛青, 等. 大蒜植株超声波浸提液对不同受体蔬菜的化感作用[J]. 西北农林科技大学学报(自然科学版), 2009, 37(7): 103109.
[16]HAN Xu, CHENG Zhihui, MENG Huanwen. Soil properties, nutrient dynamics, and soil enzyme activities associated with garlic stalk decomposition under various conditions[J/OL]. PLoS ONE, 2012, 7(11): e50868.
[17]HAN Xu, CHENG Zhihui, MENG Huanwen. Growth of wheat and lettuce and enzyme activities of soils under garlic stalk decomposition for different durations [J]. Journal of the Science of Food & Agriculture, 2017, 97(9): 27272735.
[18]赖荣泉,曾文龙,江桂花,等.大蒜乙醇提取物对烟草青枯病及普通花叶病的控制作用初报[J].云南农业大学学报(自然科学),2011,26(2):284287.
[19]金扬秀,谢关林,孙祥良,等.大蒜轮作与瓜类枯萎病发病的关系[J].上海交通大学学报(农业科学版),2003,21(1):912.
[20]陈志杰,张锋,张淑莲,等.温室黄瓜根结线虫病非化学防治技术研究初报[J].中国农学通报,2008,24(1):367370.
[21]KRUPINSKY J M, BAILEY K L, MCMULLEN M P, et al. Managing plant disease risk in diversified cropping systems [J]. Agronomy Journal, 2002, 94(2): 198.
[22]ERIC BLOCK. 神奇的葱蒜——传说与科学[M]. 唐岑,译. 北京: 化学工业出版社, 2017: 343.
[23]HANSEN Z R, KEINATH A P. Increased pepper yields following incorporation of biofumigation cover crops and the effects on soilborne pathogen populations and pepper diseases[J]. Applied Soil Ecology, 2013, 63(1): 6777.
[24]宋兴舜,宋凤杰,于广建.大蒜素对番茄三种真菌病害的影响[J].东北农业大学学报,2004,35(4):395398.
[25]林辰壹,郑成锐,程智慧.大蒜鳞茎提取液对黄瓜2种种传病害的抑制及化感作用研究[J].西北农林科技大學学报(自然科学版),2009,37(10):140144.
[26]佟飞,程智慧,金瑞,等.大蒜植株水浸液醇溶成分的化感作用[J].西北农林科技大学学报(自然科学版),2007,35(6):119124.
[27]周清,李保同,汤丽梅.大蒜素对辣椒炭疽病和辣椒疫病病菌的室内抑制活性测定及田间防效研究[J].草业学报,2014,23(3):262268.
[28]廖静静,刘屹湘,杨敏,等.大蒜挥发物和浸提液对辣椒疫霉菌的抑菌活性分析[J].云南农业大学学报,2014,29(3):337346.
[29]董林林,李振东,王倩.大蒜鳞茎浸提液对黄瓜幼苗的化感作用[J].华北农学报,2008,23(S2):4750.
[30]刘素慧,徐金强,刘庆涛,等.大蒜秸秆水浸液化感作用的研究[J].北方园艺,2015(9):1013.
(责任编辑:田 喆)
