选择性肝门静脉结扎术加肝脏离断术后二步肝切除术治疗巨大原发性肝癌中的CT应用价值▲
2019-02-10马日海黄昌辉吴贤建卓臣义
马日海 陆 涛 黄昌辉 吴贤建 路 远 卓臣义 浦 涧
(右江民族医学院附属医院肝胆外科,广西百色市 533000)
目前临床上治疗原发性肝癌的方法有手术切除、肝移植、射频消融、微波治疗、瘤内无水酒精注射、介入治疗及放射治疗,而其中最理想的治疗手段是外科手术切除[1-2]。由于该病早期症状隐匿,大多数患者确诊时已是中晚期,而肝功能代偿能力差,其手术切除率仅为20%左右,且术后复发率较高。临床上多数患者在就诊时已失去一期切除的机会[3]。先行选择性门静脉结扎术加肝脏离断术,使对侧肝增生后再行肝切除,能够提高手术的安全性[4]。鉴于此,为了明确选择性肝门静脉结扎术加肝脏离断术后原发性肝癌逐二期超极限容量肝叶切除术(肝脏右三叶切除术)的二期手术时机,我们应用CT进行检测,效果较满意。现将结果报告如下。
1 资料与方法
1.1 一般资料 选取2014年至2017年本院收治的30例巨大原发性肝癌患者作为研究对象,其中男18例,女12例;年龄58~69(63.48±4.36)岁;肝功能分级:Child-Pugh A级25例,Child-Pugh B级5例。纳入标准:(1)确诊为巨大原发性肝癌;(2)能够正常沟通;(3)无其他严重性疾病;(4)入选人员均知情本次研究,且签署知情同意书。本研究获得我院医学伦理委员会的批准。
1.2 治疗方法
1.2.1 选择性肝门静脉结扎术加肝脏离断术 (1)采取全身麻醉,取腹正中切口行开放式手术。进腹后探查肿瘤有无种植、转移或局部浸润,尽量避免挤压肿瘤。(2)切除胆囊,切开肝门板后解剖瘤侧肝门部,显露门静脉瘤侧分支,用丝线完整结扎带瘤侧门静脉。(3)分离肝脏链状韧带、左或右冠状韧带及三角韧带等,经前入路沿左右肝分界线或叶间裂切开肝脏被膜,离断肝组织及其间的血管、胆道和淋巴管分支,尽可能保护肝中静脉主干,肿瘤累及尾状叶者同时结扎门静脉尾状叶支,肝右叶肿瘤未累及者保留该段肝组织。
1.2.2 开腹肝脏右三叶切除术 选择性肝门静脉结扎术加肝脏离断术后7~14 d,对经评估获得手术机会的患者采取全身麻醉,取原正中切口开放式手术,进腹后再次探查,了解肿瘤浸润、转移情况,分离粘连组织,显露预切肝叶,分别结扎、离断预切肝叶对应的肝动脉、胆管及肝静脉,摘除预切肝叶。
1.3 CT的应用 选择性肝门静脉结扎术加肝脏离断术后7 d、14 d,利用飞利浦公司生产的多层螺旋CT对患者进行扫描。扫描前禁食4 h,扫描时叮嘱患者吸气并屏住呼吸,从膈顶扫描至肝下缘。然后利用MX view工作站及3D max,采用窗位为40 Hu、窗宽为200 Hu,选择肝密度范围,去除肝周围组织及胆囊、下腔静脉、肝门血管等周围组织,确定肝脏范围。接着重塑肝脏三维模型,计算肝脏体积;重塑肝脏肿瘤,计算肿瘤体积;计算功能性肝体积=肝脏体积-肿瘤体积。再在多层螺旋CT工作站模拟切除肝脏体积,最后计算残余肝体积=肝脏体积-拟切除肝体积;残肝分数=残余肝体积/功能性肝体积。
1.4 观察指标
1.4.1 血常规和肝功能指标 (1)分别抽取患者行选择性肝门静脉结扎术加肝脏离断术后1 d、3 d、7 d、14 d的静脉血,利用普朗医疗器械公司生产的XFA6100全自动血液细胞分析仪检测白细胞、血小板、血红蛋白、血清白蛋白水平。用美国贝克曼库尔特生产的AU680全自动生化分析仪检测选择性肝门静脉结扎术加肝脏离断术后患者的直接胆红素(direct bilirubin,DBIL)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)和总胆红素(total bilirubin,TBIL)水平。(2)记录两组患者选择性肝门静脉结扎术加肝脏离断术后行开腹肝脏右三叶切除术的例数,并检测患者行开腹肝脏右三叶切除术后1 d、3 d、7 d的血常规和肝功能指标。
1.4.2 残余肝脏体积和残肝分数的计算 应用CT计算:功能性肝体积=肝脏体积-肿瘤体积;残余肝体积=肝脏体积-拟切除肝体积;残肝分数=残余肝体积/功能性肝体积。残余肝脏体积和残肝分数较高则提示肝脏储备功能良好。
2 结 果
2.1 选择性肝门静脉结扎术加肝脏离断术后血常规和肝功能指标 选择性肝门静脉结扎术加肝脏离断术后7~14 d患者的白细胞、血小板、血红蛋白、血清白蛋白、AST、ALT、DBIL和TBIL均恢复至正常值。见表1。

表1 选择性肝门静脉结扎术后患者血常规和肝功能指标分析 (x±s,n=30)
2.2 选择性肝门静脉结扎术加肝脏离断术后复查肝脏CT获得的残余肝脏体积和残肝分数 选择性肝门静脉结扎术加肝脏离断术后7 d、14 d复查肝脏CT获得的残余肝脏体积分别为(873.62±213.24)cm3、(915.27±205.36)cm3,残肝分数分别为(0.78±0.09)、(0.85±0.08)。
2.3 开腹肝脏右三叶切除术后血常规和肝功能指标 30例患者在行选择性肝门静脉结扎术加肝脏离断术后,均行开腹肝脏右三叶切除术,术后7 d患者白细胞、血小板、血红蛋白、血清白蛋白、AST、ALT、DBIL和TBIL均恢复至正常值。见表2。
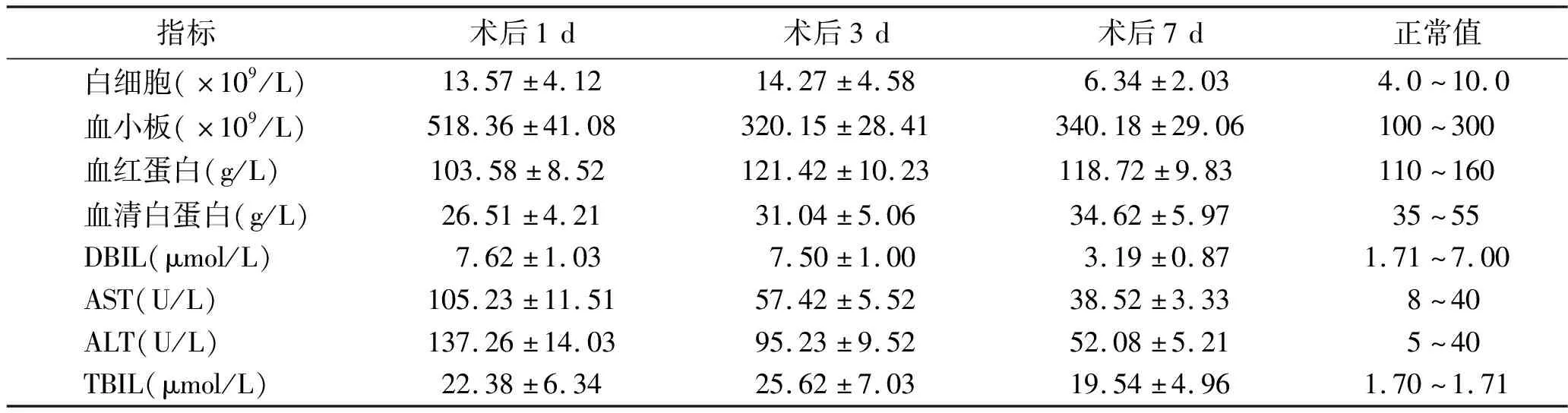
表2 开腹肝脏右三叶切除术后患者的血常规和肝功能指标分析 (x±s,n=30)
3 讨 论
据报道[5],全球每年约有62.6万人确诊为肝癌,因肝癌死亡者高达59.8万人,我国每年新发肝癌病例约占全球病例数的55%,呈上升趋势,且死亡率较高,这已引起人们的重视。虽然目前的肝脏外科为肝癌患者的治疗提供了多种选择,但临床针对不同的个体,如何根据病情为患者选择合适的治疗方法仍无统一的标准,多数情况是根据医生的经验而定,因而对患者病情的判断和治疗的选择常因人而异,存在较多问题[6-7]。而如何在多种治疗方法中进行选择,以期达到最佳的增效作用和降低副作用,还需深入研究。原则上只要肝功能许可(Child-pugh A级或B级),应为患者施行肝段或肝叶切除术,以求达到根治目的[8]。
目前临床上对于治疗巨大肝癌的方法是先进行适当术前处理,待肿瘤缩小后再进行手术[9]。近年来,一期行门静脉结扎加肝脏分隔离断术后再进行二期肝切除的临床应用逐渐增多,研究者认为选择性肝门静脉结扎术加肝脏离断术可以扩大肝癌的手术适应证,增加手术的安全性,提高患者术后的生存率[10-11]。但是有研究报道[12],行选择性肝门静脉结扎术加肝脏离断术后再行二期手术的间隔时间的选择尚无统一,间隔时间过短,对侧肝再生不完全,效果不确切;间隔时间过长,可能出现血管再通,亦影响栓塞效果,而且可能出现肿瘤生长、转移等问题。
术后残肝的代偿问题是限制手术切除的重要原因。有研究显示,残肝体积可被视为与Child-pugh分级同等重要的评价肝脏储备功能的指标[13]。潘华峰等[14]用CT检查测量肝脏体积和残肝体积来评估肝切除的安全性,并与Child-pugh肝功能分级进行对比,认为CT检查可以有效地预测肝癌手术切除的安全性。另外,残肝比作为评估肝功能储备的重要指标之一,已得到临床医师的广泛认可[15]。鉴于此,本研究为了明确选择性肝门静脉结扎术加肝脏离断术后原发性肝癌逐二期超极限容量肝叶切除术二期手术的时机,应用CT检测残余肝脏体积和残肝分数。结果发现,选择性肝门静脉结扎术加肝脏离断术后7~14 d血常规和肝功能指标均恢复至正常值,且术后7 d、14 d复查肝脏CT获得的残余肝脏体积和残肝分数均较高[术后7 d、14 d残余肝脏体积分别为(873.62±213.24)cm3、(915.27±205.36)cm3,残肝分数分别为(0.78±0.09)、(0.85±0.08)],可判断患者均可行开腹肝脏右三叶切除术,并且行肝切除术后7 d血常规和肝功能指标均恢复至正常值。说明行选择性肝门静脉结扎术加肝脏离断术后7~14 d是患者行二期肝叶切除术的良好时机。
综上所述,CT检测残余肝脏体积和残肝分数,是明确选择性肝门静脉结扎术加肝脏离断术后二步肝切除术治疗巨大原发性肝癌行二期手术时机的良好辅助方法。
