乌索酸调节PI3K/AKT/mTOR信号通路在结直肠癌中的研究进展*
2019-01-29崔宏伟苏秀兰
崔宏伟,苏秀兰
(内蒙古医科大学附属医院临床医学研究中心 呼和浩特市 010050)
研究表明,天然产物是药物活性成分的主要来源,超过80%的生物活性化合物是天然产物[1]。在天然产物的类别中,三萜类化合物构成了一个非常庞大的家族,包含了超过20.000个分子,具有显著的化学多样性和重要的治疗价值。这些三萜类化合物具有多种生物活性,如抗癌、抗生育、抗高血糖、创面愈合、抗溃疡、抗龋齿、抗细菌、抗病毒、心血管和抗炎作用[2-4]。乌索酸(Ursolic acid,UA)是一种五环三萜类物质,分子式C30H48O3,通常以游离酸或者皂苷的糖苷配基形式存在。UA存在于多种药用植物中,如琵琶、迷迭香、白花蛇舌草、女帧子、熊果、越桔、杜鹃、帚石楠及在一些水果如苹果,梨,李子的蜡涂层[5,6]。大量研究已经阐明了UA潜在的药理作用。研究显示,UA具有对癌症生存和进展、心血管和神经损伤相关的多种信号通路调节的功能,包括 Wnt、NF-κB、MAPK、PI3K/AKT/mTOR等[7-10]。此外,研究人员通过对基本结构进行化学修饰实现了UA衍生物的合成,进一步提高其治疗潜力和所需的活性剂量[11]。
PI3K/AKT/mTOR信号通路是不同肿瘤类型包括结直肠癌(colorectal cancer,CRC)的关键失调通路[12]。大量的数据对PI3K/AKT/mTOR信号通路抑制剂,如BEZ235,NVP-BEZ235,BYL719及BKM120等在CRC中的价值进行了评估。结果提示,PI3K/AKT/mTOR信号通路的激活与细胞转化、肿瘤进展、细胞存活和耐药性有关[13]。然而,生物活性天然化合物,如UA等五环三萜类物质对炎症/或氧化应激相关疾病(癌症、心血管和神经退化疾病)的治疗机制尚未阐明[14,15]。因此,深入了解UA在CRC发展过程中调节PI3K/AKT/mTOR信号通路过程,有助于CRC新治疗策略的制定。
1 UA来源、结构与抗肿瘤机制
1.1 UA来源、结构及生物学活性
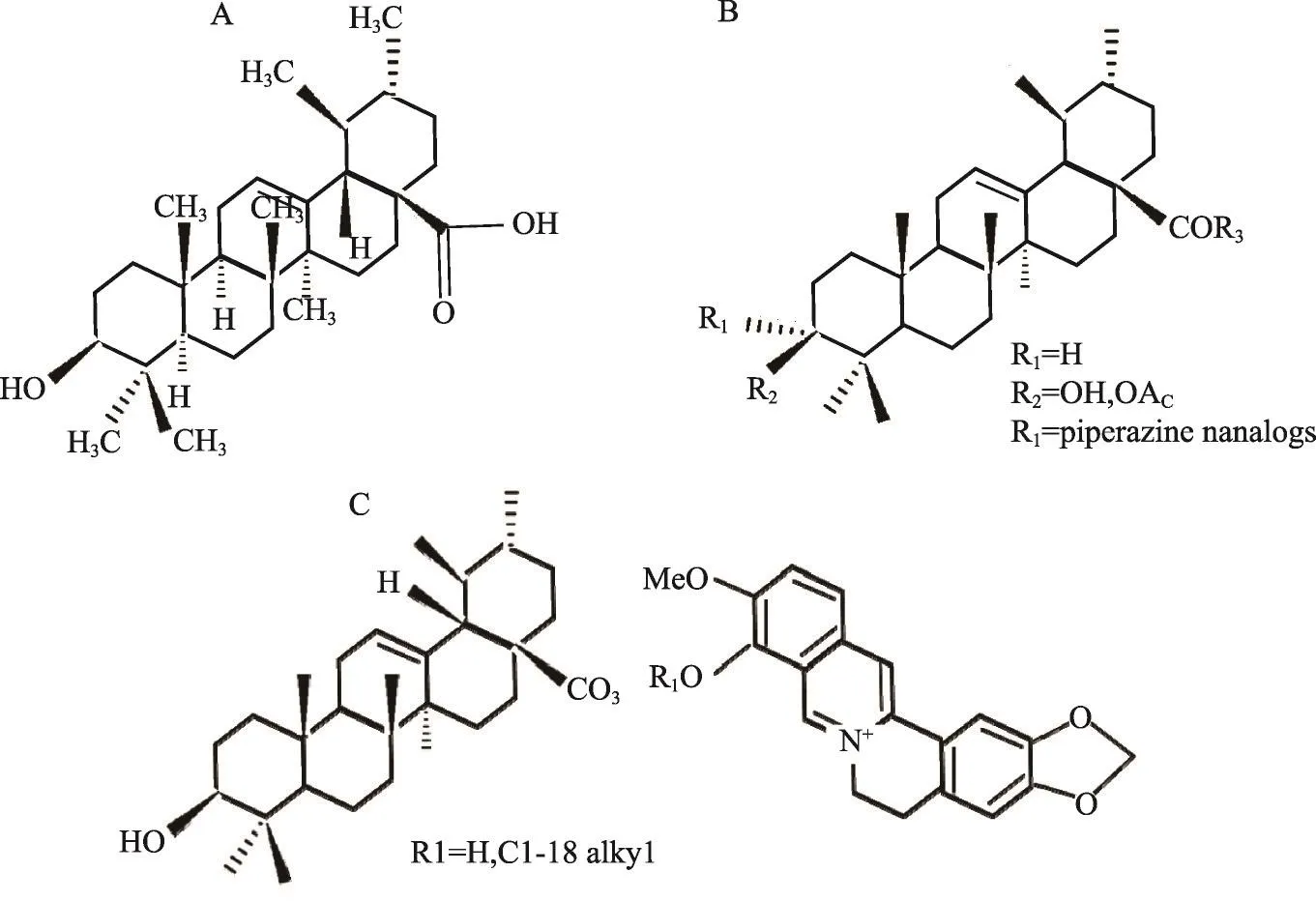
图1 UA的化学结构式及其部分衍生物
UA是一种五环三萜羧基类化合物,通常以游离酸形式或作为三萜皂苷的配体形式广泛存在于植物的根、茎、叶、花、果实以及部分野生食用菌[16]。研究证明乌索酸具有广泛的生物学活性,具有抗癌、保护脏器(肺、肾、肝和脑)、抗炎、抗菌、抗病毒(HIV和HCV)、抗原虫(antiprotozoal)、抗骨质疏松等药理作用,并表现出低毒性[17]。虽然UA对多种疾病具有广泛的生物学活性,但由于其治疗疾病的特异性及生物利用度低等缺点,限制了临床的广泛应用。基于UA化学结构进行综合化学修饰的衍生物可能被用作增强其生物和药理潜在活性重要工具,具有较好的应用前景[18]。据报道,针对UA结构的C-3或者C-28位置进行化学修饰获得的衍生物不仅能够提高其生物活性,而且可改善其生物利用度。Shao等修饰合成的UA氮杂环类似物具有抑制人恶性黑色素瘤A-375细胞,人胃癌BGC-823、AGS细胞增殖,而且其效果与紫杉醇相当[19]。Peng等合成的UA黄连素盐化合物的体内实验显示具有调节糖尿病小鼠血糖水平的作用[20]。见图1。
1.2 UA抗肿瘤机制
1.2.1 诱导细胞凋亡和细胞周期阻滞
细胞凋亡是一种具有一系列明显的形态学和生化变化过程,在调控各种生物反应,如免疫反应、血液生成和胚胎发育、细胞程序性自然死亡过程中起着重要作用[21]。目前,包括UA在内的抗癌药物,治疗肿瘤的原则主要是针对凋亡途径,以抑制肿瘤的生长和增殖。Kim等的研究表明,UA对人肝癌细胞系HepG2作用的机制与其增强线粒体释放细胞色素C,激活caspase-3诱导HepG2细胞凋亡,从而抑制肝癌进程[22]。Wu等研究表明,UA作用HepG2与K562细胞系,抑制前生存蛋白磷酸肌醇激酶-3/Akt(phosphoinositide 3 kinase/Akt,PI3K/Akt)活性及下调肿瘤细胞增值密切相关的Bcl-2的表达[23]。此外,通过对凋亡拮抗剂的剂量依赖性调节,观察到UA对MDR(多药耐药性)SW480(结肠直肠腺癌细胞株)细胞的抗增殖和凋亡作用[24]。
UA并具有调节细胞周期调节分子的功能,如细胞周期蛋白(Cyclin)、依赖细胞周期素激酶(CDK)等发挥细胞周期阻滞效应。Wang等发现,UA处理MCF-7肿瘤细胞后,可致细胞周期发展中起着至关重要作用的Cyclin D1/CDK4的失活[25]。另一项使用SNG-2和HEC108(子宫内膜腺癌细胞癌细胞株)细胞的研究也显示UA通过调节MAPK信号通路对细胞周期内的G1期调节蛋白(Cyclin D1)发挥抑制作用[26]。最近,Wang等的研究显示,UA诱导的GBC-SD和SGC-996(胆囊癌细胞细胞系)细胞的S期阻滞与线粒体凋亡有关[27]。综上分析,UA通过诱导细胞周期阻滞和调节周期相关的靶分子可促进癌细胞凋亡,从而发挥其抑癌作用。
1.2.2 诱导细胞自噬
细胞自噬(Autophagy)也称II型程序性细胞死亡(Type II programmed cell death),是一种进化保守的,循环利用大分子并调解功能失调的蛋白质、受损细胞器和不必要的细胞质成分的溶酶体降解过程,对于细胞存活和维持体内平衡至关重要[28]。研究表明,细胞凋亡和自噬之间相互关联,有助于控制细胞的存活和死亡[29]。这一途径常被如营养饥饿、DNA损伤和器官损害等代谢应激条件激活。常在各种人类疾病进程中发生改变,包括癌症[30,31]。自噬对癌细胞的存活具有积极或消极的作用[32]。尽管自噬作用是一种通过促进多余或受损细胞成分的降解的细胞自我保护机制,但若阻止自噬-溶酶体融合进程,则会阻碍自噬的发生[33]。Jung等研究表明,UA通过诱导凋亡和损害自噬进展促进PC-12细胞的死亡[34]。Luo等研究提示,UA通过抑制增殖、诱导自噬与凋亡以及介导PI3K/AKT与NF-κB信号通路抑制炎性反应从而抑制乳腺癌细胞的生长[35]。Lewinska等研究表明,UA在表型不同的乳腺癌细胞中,介导的糖基化途径的改变进而促进细胞毒性自噬和细胞凋亡[36]。
此外,细胞自噬作为细胞存活机制,在不同的情况下,可能起到促肿瘤细胞死亡或抑制肿瘤细胞死亡乃至参与化疗耐药的作用。Chang等研究提示,UA抑制Huh7细胞乙型肝炎病毒X蛋白(Hepatitis B Virus X Protein,HBx)介导的自噬以及改善化疗耐药性[37]。
1.2.3 抑制上皮-间质转化
上皮-间质转变(epithelial-mesenchymal transition,EMT)是一种细胞从上皮极化表型转变为间叶细胞成纤维母细胞表型的转分化过程。EMT包括细胞极性的丧失,细胞间的粘附性降低,以及迁移能力的增强[38]。Ruan等研究指出,UA通过靶向调节非小细胞肺癌中整合素αVβ5/MMPs信号通路,弱化TGF-β1诱导的EMT进程[39]。Sohn等表明,阻滞EMT及上调let 7b表达对于UA诱导的恶性间皮瘤细胞H28,H2452,MSTO-211H凋亡至关重要[40]。Zhang等认为UA通过EMT抑制人卵巢癌干细胞的增殖[41]。Liu等提出,UA通过抑制人非小细胞肺癌细胞A549中星形胶质细胞提升基因-1(astrocyte-elevated gene-1,AEG-1)从而抑制EMT[42]。
1.2.4 抑制转移
转移是进展期癌症显著的特征,且是造成癌症相关死亡的主要原因。这些癌细胞的转移特性直接导致手术和放射治疗策略的失败,使得化疗成为治愈癌症的唯一途径。基于此,抑制癌细胞转移特性的化疗药物及天然化合物具有较广阔的应用前景[43]。过去二十年对癌症研究表明,UA具有抗癌症转移的作用。Jedinák等研究提示,UA显著抑制与癌症侵袭和转移显著相关的尿激酶和组织蛋白酶的活性[44]。UA作用C6胶质瘤细胞后能够减少白细胞介素-1β(Iinterleukin-1β,IL-1β)、肿瘤坏死因子(Tumor necrotic factor-α,TNF-α)诱导的基质金属白酶(Matrix metallo-proteases,MMPs)的表达。机制为UA介导Iκβα抑制剂的上调导致NF-kβ转录因子失活[45]。以剂量和时间依赖的UA处理人类乳腺癌细胞,通过对JNK、Akt和m-TOR的脱磷酸作用,导致NF-kβ失活,进一步导致了MMP-2、u-PA的下调和纤溶酶原激活物抑制剂-1的上调[46]。Shanmugam等揭示UA通过抑制促炎因子如CXCR4/CXCL12受体-4介导的信号通路,发挥抑制TRAMP小鼠前列腺转基因腺瘤模型肿瘤的生长[47]。UA以浓度依赖形式作用A549,H3255,Calu-6细胞,表现抑制侵袭与转移效应,其可能机制是抑制Na(+)-K(+)-ATPase,人成熟型转化生长因子-β1(Transforming growth factor beta1,TGF-β1),细 胞 间 粘 附 分 子(Intercellular adhesion molecule-1,ICAM-1)的表达[48],这提示UA具有通过多种机制抑制癌症转移。
1.2.5 抑制血管生成
血管生成,意指既存的血管中形成新的毛细血管,其不仅对肿瘤的生长和生存至关重要,而且对增强其侵入性行为也至关重要。研究表明,肿瘤细胞在其周围创造了一个微环境并分泌出各种支持性趋化因子来进行血管生成[49]。Kanjoormana等对C57BL/6小鼠的研究表明,UA可抑制与血管生成相关的血管内皮生长因子(Vascular endothelial growth factor,VEGF)并诱导一氧化氮合酶(inducible Nitric oxide synthase,iNOS)的表达[50]。此外,Lin等研究显示,UA对人肝癌细胞系Hep3B,Huh7,HA22T具有抑制促进血管生成因子的表达,包括VEGF和碱性成纤维细胞生长因子(basic Fibroblast growth factor,β-FGF)、缺 氧 诱 导 因 子(Hypoxia-inducible factor-1α,HIF-1α)。可能的机制与UA抗氧化活性相关[51]。Saraswati等研究显示,UA不仅能够下调血管生成促进蛋白质(VEGF,iNOS,TNF-α)因子的表达,而且显著抑制肿瘤细胞的生长[52]。以上研究表明,因此,UA可以被认为是一种潜在的肿瘤抑制因子,通过多种机制抑制肿瘤血管生成。
2 乌索酸调节PI3K/AKT/mTOR信号通路作用结直肠癌
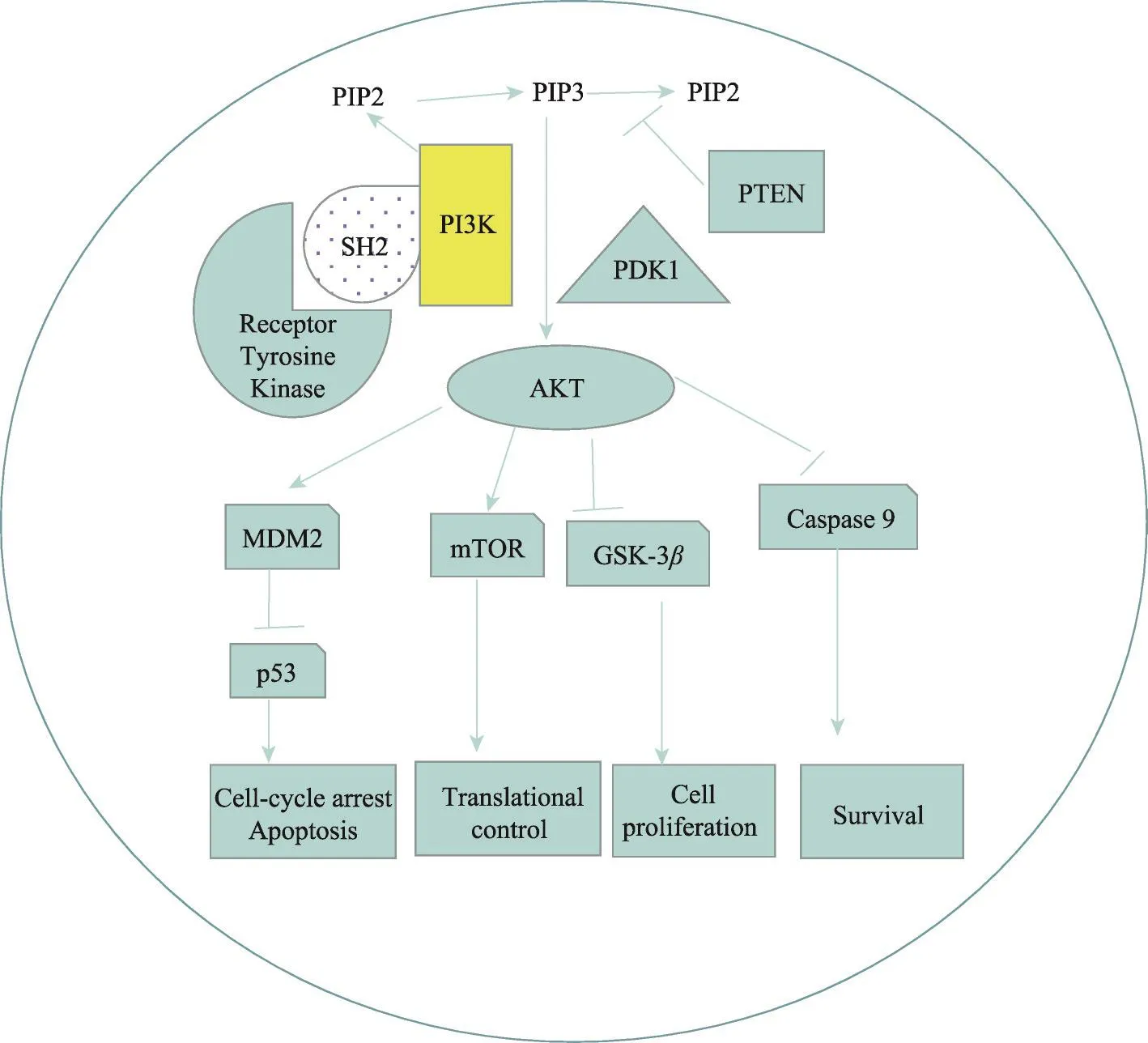
图2 PI3K/AKT信号通路在结直肠癌进程中示意图
结肠直肠癌(Colorectal cancer,CRC)是第三种最常见的恶性肿瘤,也是全球癌症相关死亡的第二大原因[53]。在中国,由于人们的生活方式的改变,CRC的发病率一直在显著增加[54]。尽管CRC具有家族遗传倾向,但环境因素,如食物的诱变剂,慢性肠道炎症,特定的肠道菌群和病原体均可导致CRC的发展[55]。CRC进展涉及多条分子信号转导通路,如PI3K/AKT/mTOR信号通路、信号转导与转录激活因子3(signal transducer and activator of transcription 3,STAT3)通路及胞外调节蛋白酶(extracellular regulated protein kinases,ERK)通路。其中,PI3K/AKT/mTOR信号通路在抑制CRC细胞增殖,诱导凋亡进程中发挥重要作用[56]。PI3K/AKT/mTOR信号通路的抑制剂被认为是治疗CRC的潜在靶向制剂。研究提示,PI3K/AKT/mTOR信号通路与CRC进程显著相关[57]。AKT信号通路的激活及AKT负性调节因子PTEN的异常表达与60-70%的CRC有关[58]。PI3K的催化剂及调节亚单位均可以启动促进癌细胞生长,侵袭、转移及凋亡相关信号转导级联反应[59]。见图2。
CRC进展中,肿瘤血管生成扮演重要角色。肿瘤血管生成受到多种细胞内信号转导通路,如Hedgehog,STAT3,PI3K/AKT/mTOR,p70S6K通路的调节。因此,靶向调节上述信号通路从而抑制肿瘤血管生成是很有潜力的癌症化疗策略[60]。Lin等通过CRC裸鼠移植瘤模型,小鸡鸡胚绒毛膜尿囊的膜(chick embryo chorioallantoic membrane,CAM)模型以及人结直肠癌细胞系HT-29、人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)实验结果显示,UA能够显著抑制CRC裸鼠移植瘤模型肿瘤生长,减少CAM模型中血管数量以及呈现剂量依赖方式抑制HT-29、HUVECs的增殖、侵袭、转移能力。进一步研究提示,UA作用CRC的机制与激活sonic hedgehog(SHH),STAT3,Akt,p70S6K通路有关[61]。Wang等研究提示,UA抑制结直肠癌细胞增殖,诱导凋亡机制涉及MMP9/CDH1,Akt/ERK,COX-2/PGE2,p300/NF-κB/CREB2,细胞色素C/caspase等信号通路[62]。Shan等研究显示,UA抑制结直肠癌细胞的增殖,诱导凋亡,增强奥沙利铂的化疗敏感性。相关作用机制与下调Bcl-xL,Bcl-2,survivin因子表达,激活caspase-3、8、9,抑制KRAS以及MAPK,PI3K/AKT及NF-κB信号通路中BRAF,MEK1/2,ERK1/2,p-38,JNK,AKT,IKKα,IκBα及 p65磷酸化水平相关[63]。Xavier CP等研究提示,UA是KRAS和BRAF突变的人类结直肠癌细胞增殖和诱导凋亡的有效抑制剂,有可能通过MAPK/ERK及PI3K信号通路激活增殖和存活[64]。以上研究说明,乌索酸调节PI3K/AKT/mTOR信号通路抑制结直肠癌细胞增殖、诱导凋亡及抑制新生血管生成及对化疗药物具有增敏减毒的作用。
综上所述,天然产物及经过化学修饰结构来源的UA及其衍生物通过诱导结直肠癌细胞凋亡和阻滞细胞周期,诱导细胞自噬,抑制上皮-间质转化、癌细胞转移及血管生成等机制阻碍结直肠癌进程。过程涉及多条信号通路,但PI3K/AKT/mTOR信号转导通路在CRC的发生、发展中发挥了重要的作用,且与其浸润、转移有关。UA通过调节PI3K/AKT/mTOR信号通路,修复PTEN基因活性,多层次、多途径地抑制肿瘤生长,促进肿瘤细胞凋亡,为CRC的治疗提供了新的思路。但目前对UA调节PI3K/AKT/mTOR通路与其他相关通路的关联性以及相互的作用调控机制尚未阐明,仍需要进一步深入探索。
