川芎赤芍对急性脑梗死大鼠Nogo-A/NgR/RhoA/ROCK mRNA水平的影响*
2019-01-29黄赫,甘雨,袁媛,乔敏,马进
黄 赫,甘 雨,袁 媛,乔 敏,马 进
(1.辽宁省中医药研究院 沈阳 110034;2.辽宁中医药大学附属第二医院 沈阳 110034)
急性脑梗死是一类多见的突发性心脑血管疾病,致残率和死亡率较高,严重危及人类健康[1-4]。血液粘度、血小板聚集、炎症的增加和细胞因子级联反应是患者溶栓后继发血栓和死亡的主要原因[1,5,6]。当急性脑梗死发生时冠状动脉阻塞,血管供应大脑的血流中断并引起坏死或缺血脑组织的软化。急性脑梗死缺血半暗带是正常脑组织之间一个可逆的坏死区域,然而缺血中心组织存在不可逆的功能损害[2]。许多以往研究表明成人大脑有对脑缺血损伤进行自我修复的能力[7]。一般来说,神经营养因子是参与神经可塑性和脑卒中后修复的重要调节因子[7,8]。同时,特异性生长抑制剂的高表达是参与限制神经可塑性[7]。本文意在寻找通过调节内源性生长刺激因子与生长抑制因子来放大某些内源性过程以替代神经修复的疗法。
Nogo-A是一类著名的髓鞘相关轴突生长抑制蛋白,已被证明能抑制神经细胞的迁移和扩散并在阻断轴突再生方面发挥重要作用[9,10]。Nogo-A主要通过与受体NGR结合,通过其功能部件激活胞内Nogo-A信号RhoA和它的下游靶基因ROCK,最终导致轴突生长锥凋亡[7,11,12]。
治疗急性脑梗死包括溶栓药和活血药等。中医药由于其安全性被广泛应用,《本草纲目》中记载:“芎䓖,血中气药也。”川芎有活血行气,祛风止痛之功效,常用来治疗缺血性脑血管病。《滇南本草》中提到赤芍具“行血,破瘀,散血块”之功效。具有高安全性的中医药可能在急性脑梗死过程起神经修复作用。本实验将川芎赤芍作为行气活血方,应用实时定量PCR手段从Nogo-A、NgR、RhoA、ROCK途径探讨川芎赤芍治疗急性脑梗死的机制,并寻求最佳给药剂量,为临床治疗提供指导。
1 材料与方法
1.1 实验试剂与仪器
实验试剂:组织用RNA提取试剂盒Ⅲ0333059-1001,锣盖管03358941001,SYBR GREEN染料04707-516001均购自罗氏诊断产品(上海)有限公司;反转录试剂盒RR047A购自宝生物工程(大连)有限公司;引物由华大基因公司合成。
实验仪器:罗氏全自动核酸分离纯化系统MagNA Pure LC 2.0、罗氏匀浆仪MagNA Lyser、罗氏实时定量PCR仪LC 480。
1.2 动物分组
健康雄性SD大鼠,体质量250±10 g,由辽宁长生生物技术有限公司供应;动物生产合格证号为SCXK(辽)2015—0001,动物使用许可证号为SYXK(辽)2012—0003。随机分为8组,分别为空白组、模型组、假手术组、川赤低剂量组,川赤中剂量组,川赤高剂量组,银杏叶组,尼莫地平组。
1.3 模型建立与给药
线栓法制备大鼠局灶性脑缺血(MCAO)模型。使用10%水合氯醛(3 mL·kg-1)注射大鼠腹腔麻醉,使大鼠仰卧并固定在手术台上,颈前术区脱毛杀菌。无菌操作下做颈部前正中切口长约3 cm,经右侧胸锁乳突肌后气管旁进入,暴露右侧颈总动脉,向外牵引二腹肌及胸锁乳突肌,由颈总动脉向头端依次剥离出颈内动脉、颈外动脉,颈总动脉剪一切口,插入鱼线18.5±0.5 mm,尼龙线固定,依次缝合切口。2 h动物清醒后拔出线栓1 cm,并剪断皮肤外部分,进行神经功能评分,放回笼中常规饲养。
第二日开始喂药,予其等体积的药物,第三日取材,取其受损脑组织和腹腔血清。剩余继续喂药,分别在第7天和14天以上述方法取材。
1.4 RNA提取
本实验在罗氏全自动核酸分离纯化系统中进行。启动系统,油脂工作站检查;洗脱盒、储存盒、加工盒、反应吸头、废物袋、废液瓶、试剂桶放入机器;使用电子天平称取35 mg组织加入装有600 mL组织裂解液的锣盖管中;组织匀浆仪研磨组织,6500 r·min-150 s两次;两次裂解之间的等待将样品放在冷冻块里;冷冻块里培育样品30 min;13000 r·min-1离心2 min,将350 μl裂解的匀浆加入到样本管中备用;按照说明的量加注试剂桶,将样本管放到样本槽,运行“RNA Tissue Fresh-Frozen”程序,进行RNA提取反应。

表1 Nogo-A、NgR、RhoA、ROCK2、GAPDH引物序列
1.5 cDNA合成
cDNA合成使用宝生物cDNA合成试剂盒RR047A,在反应体系1中加入5 μl RNA,1 μl oligo(dT)18,7 μl ddH2O至总体积13 μl,混匀,离心,65 ℃,10 min。在反应1混合物中加入0.5 μl Protector RNase Inhibitor,4 μl反转录酶 Buffer,2 μl Deoxynucleotide Mix,0.5 μl反转录酶至总体积 20 μl,混匀,离心,55℃ 30 min,85℃ 5 min,4℃ +∞。
1.6 实时定量PCR
实时定量PCR反应体系包括cDNA 1 μl,上、下游引物各1 μl(引物序列见表1),10 μl Master Mix,7 μl ddH2O。反应程序如下95 ℃ 10 min;95℃ 30 s,60℃30 s,72℃ 1 min,40个循环;95℃ 5 s,65℃ 1 min,4℃30 s。
1.7 统计学分析
使用 2-ΔΔCt公式计算 mRNA 的相对表达量。使用SPSS18.0软件对结果进行统计学处理,采用单因素方差分析。P<0.05为有统计学意义,P<0.01为有显著性差异。
2 结果分析
为探索川芎赤芍对大鼠急性脑梗死的疗效,检测不同川赤剂量组与空白组、模型组、假手术组Nogo-A、NgR、RhoA、ROCK2 mRNA相对表达量的差异,银杏叶组和尼莫地平组分别作为中药阳性和西药阳性对照组。同时,本研究对用药3天、7天和14天后急性脑梗死大鼠Nogo-A、NgR、RhoA、ROCK2 mRNA相对表达量进行对比,统计其差异。
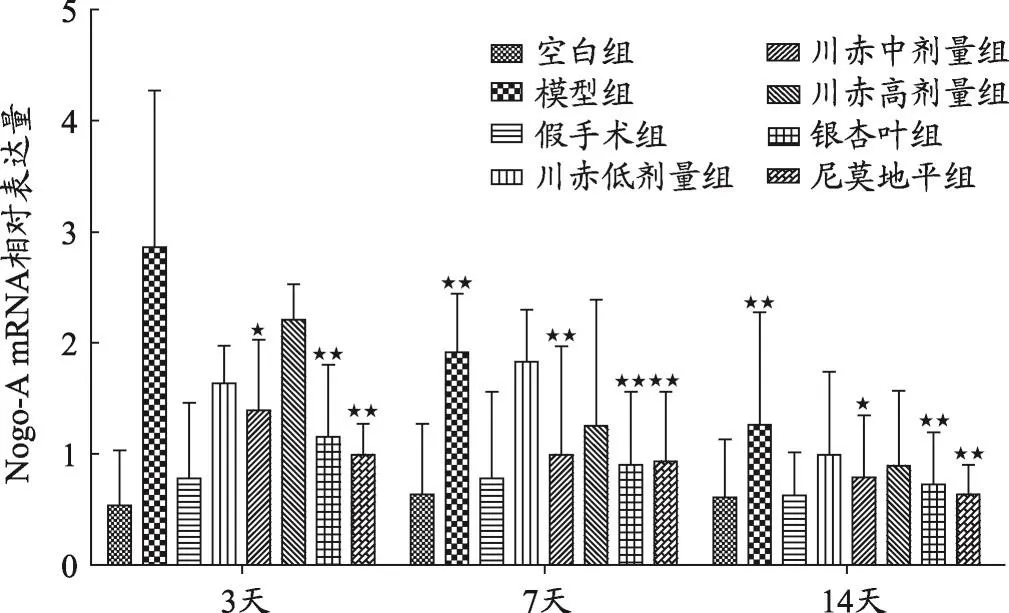
图1 不同组大鼠Nogo-A mRNA相对表达量变化
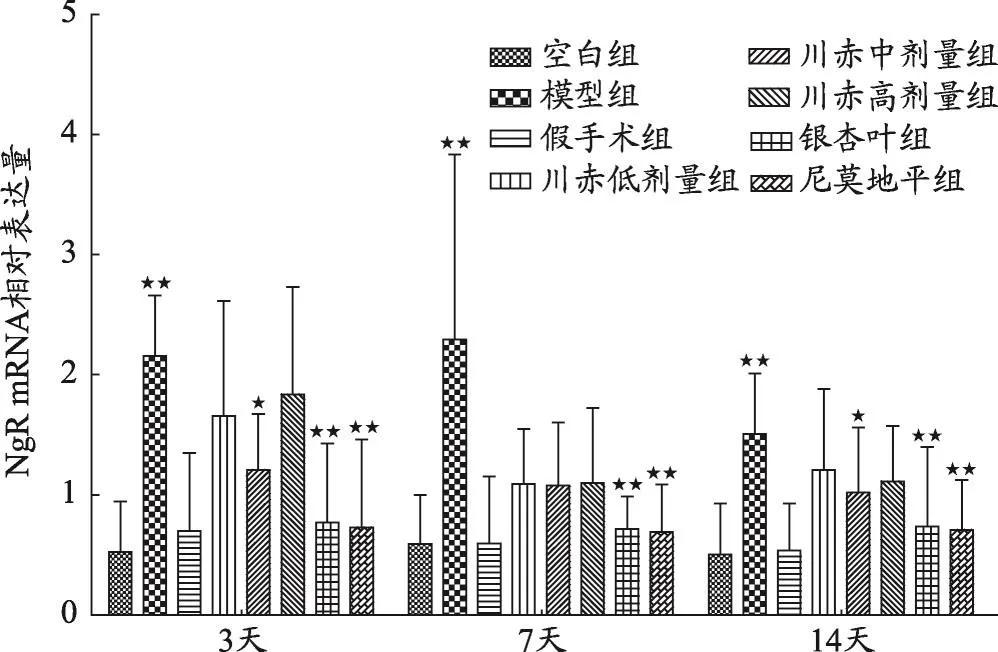
图2 不同组大鼠NgR mRNA相对表达量变化
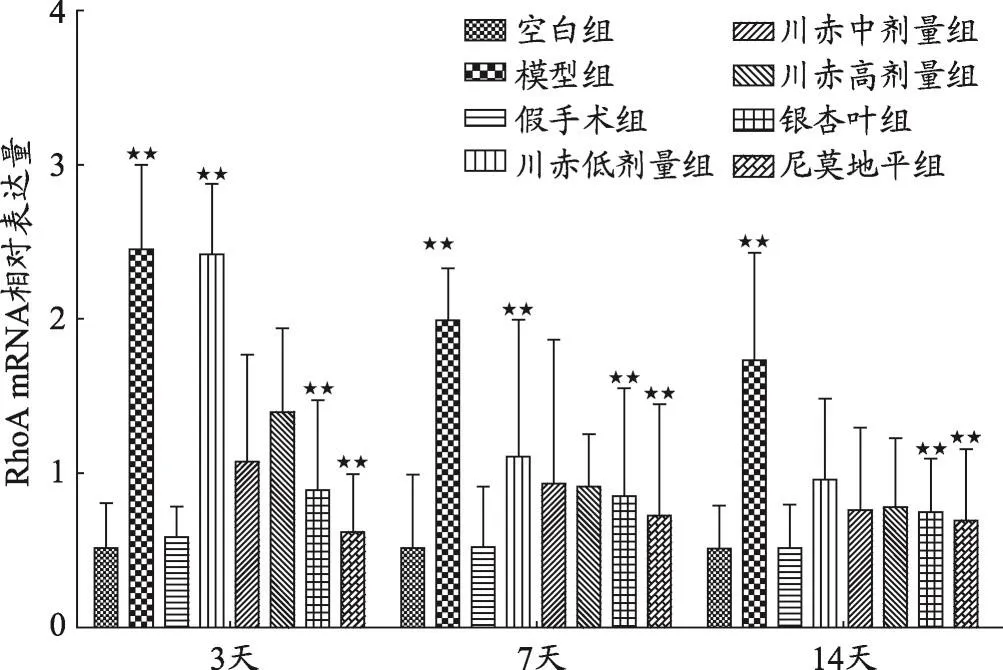
图3 不同组大鼠RhoA mRNA相对表达量变化
结果如图1、2、3、4,不同用药天数模型组与空白组、假手术组相比,Nogo-A、NgR、RhoA、ROCK2 mRNA相对表达量明显升高(P<0.05)。
见图1,给药3天后Nogo-A mRNA相对表达量川赤高剂量组>低剂量组>中剂量组(P<0.05),且与模型组相比以上三组都显著降低(P<0.01),银杏叶组和尼莫地平组Nogo-A mRNA相对表达量亦显著低于模型组(P<0.01)。给药7天后,川赤中、高剂量组与模型组相比Nogo-A mRNA相对表达量显著降低(P<0.01)。川赤低剂量组对Nogo-A mRNA相对表达量的抑制作用低于川赤中、高剂量组(P<0.01),川赤中高剂量组Nogo-A mRNA相对表达量无显著差异,银杏叶组和尼莫地平组与模型组相比Nogo-A mRNA相对表达量显著降低(P<0.01)。给药14天后,川赤低、中、高剂量组Nogo-A mRNA相对表达量与模型组相比显著降低(P<0.01),且川赤中剂量组Nogo-A mRNA相对表达量低于高剂量组(P<0.05),川赤低、高剂量组无明显差异,而银杏叶组和尼莫地平组与模型组相比Nogo-A mRNA相对表达量显著降低(P<0.01)。
如图2,给药3天后,川赤低、中、高剂量组NgR mRNA相对表达量与模型组相比显著降低(P<0.01),且川赤中剂量组<低剂量组<高剂量组(P<0.05),银杏叶组和尼莫地平组与模型组相比NgR mRNA相对表达量显著降低(P<0.01)。给药7天后与模型组相比,川赤低、中、高剂量组NgR mRNA相对表达量显著降低(P<0.01),但川赤低、中、高剂量组之间该基因相对表达量无显著性差异,银杏叶组和尼莫地平组与模型组相比NgR mRNA相对表达量显著降低(P<0.01)。给药14天后川赤低、中、高剂量组比模型组NgR mRNA相对表达量显著降低(P<0.01),川赤中剂量组NgR mRNA相对表达量略低于川赤高剂量组(P<0.05),川赤中剂量组NgR mRNA相对表达量显著低于川赤低剂量组(P<0.01),川赤低、高剂量组之间NgR mRNA相对表达量无显著性差异,银杏叶组和尼莫地平组与模型组相比NgR mRNA相对表达量显著降低(P<0.01)。
如图3所示,给药3天后与模型组相比,川赤低、中、高剂量组RhoA mRNA相对表达量显著降低(P<0.01),川赤低剂量组RhoA mRNA相对表达量高于川赤中、高剂量组(P<0.01),银杏叶组和尼莫地平组与模型组相比明显降低(P<0.01)。给药7天后与模型组相比,川赤低、中、高剂量组RhoA mRNA相对表达量显著降低(P<0.01),川赤低剂量组RhoA mRNA相对表达量高于川赤中、高剂量组(P<0.01),川赤中、高剂量组RhoA mRNA相对表达量无显著差异,银杏叶组和尼莫地平组与模型组相比显著降低(P<0.01)。给药14天后与模型组相比,川赤低、中、高剂量组RhoA mRNA相对表达量显著降低(P<0.01),川赤低、中、高剂量组RhoA mRNA相对表达量无明显差异,而银杏叶组和尼莫地平组与模型组相比显著降低(P<0.01)。
给药3天后与模型组相比,川赤低、中、高剂量组ROCK mRNA相对表达量显著降低(P<0.01),川赤低剂量组ROCK mRNA相对表达量高于川赤中、高剂量组(P<0.05),川赤中、高剂量组之间无显著性差异,银杏叶组和尼莫地平组与模型组相比显著降低(P<0.01)。给药7天后与模型组相比,川赤低、中、高剂量组ROCK mRNA相对表达量显著降低(P<0.01),川赤中剂量组ROCK mRNA相对表达量低于川赤低、高剂量组(P<0.01),川赤低、高剂量组ROCK mRNA相对表达量无显著差异,银杏叶组和尼莫地平组与模型组相比显著降低(P<0.01)。给药14天后与模型组相比,川赤中、高剂量组ROCK mRNA相对表达量显著降低(P<0.01),川赤低剂量组低于模型组(P<0.05),川赤低剂量组ROCK mRNA相对表达量高于中剂量组(P<0.05),川赤高剂量组与中剂量组ROCK mRNA相对表达量无显著性差异,而银杏叶组和尼莫地平组与模型组相比显著降低(P<0.01)(图4)。
3 讨论
急性脑梗死是一类严重的神经系统疾病[13]。当前关于急性脑梗死的研究大多集中在炎症细胞因子[1,13]和细胞凋亡[2]的角度上,从保护神经角度研究的较少。本研究从轴突生长抑制因子mRNA水平的改变入手探讨川芎赤芍治疗急性脑梗死的分子机制。
信号因子Nogo-A、NgR、RhoA、ROCK2可以限制轴突生长和神经可塑性[7,14]。Nogo-A是一类众所周知的髓鞘相关轴突生长抑制蛋白,已被证明参与抑制神经细胞的迁移和扩散,并在阻止轴突再生和中风后轴突重建方面具有重要作用[7,9,15]。NgR为Nogo-A受体,通常与Nogo-A一起发挥抑制神经突生长的作用[11]。抑制RhoA能显著促进小鼠神经干细胞神经突生长与神经元分化[7,16]。抑制ROCK可调节轴突生长并保护神经元免于兴奋性毒性诱导的细胞死亡[7,17,18]。在小胶质细胞中,活化的ROCK会影响神经炎症和多巴胺能神经变性,而被抑制的ROCK主要在多巴胺能神经元的神经保护方面发挥作用[7,19]。
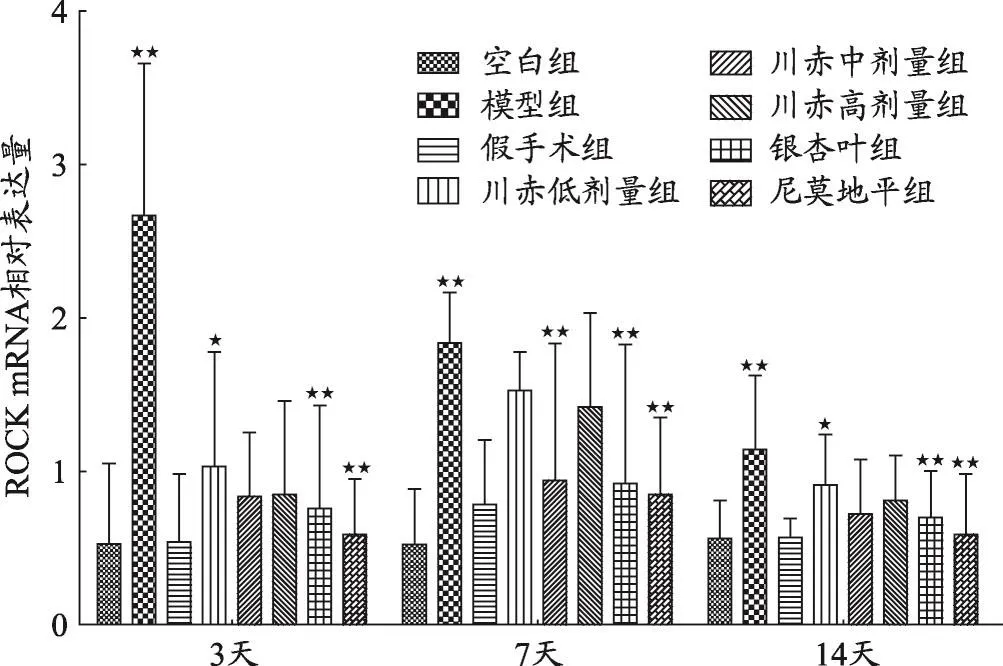
图4 不同组大鼠ROCK mRNA相对表达量变化
当脑血管疾病发生时,Rho和ROCK活动通常增加,不仅仅在血管平滑肌和内皮细胞,也存在于炎症细胞和神经元[20,21]。Rho和ROCK通过细胞信号转导系统对平滑肌细胞功能产生影响[22]。Rho通过其下游效应物ROCK调节细胞重组肌动蛋白骨架,广泛参与细胞迁移、基因转录、细胞凋亡和神经再生[23]。ROCK是Rho下游产物,包括两种细胞亚型ROCK1和ROCK2,后者主要存在于中枢神经系统中像海马锥体神经元和脑区皮质。韦斯等人[24]表明ROCK通过许多渠道影响细胞信号转导系统,并参与平滑肌细胞增殖和再狭窄的调节。其作用机制已得到证实,如促进MLC磷酸化,增加内皮细胞渗透,并下调内皮型一氧化氮合酶的表达[25,26],上述机制可导致大脑供血障碍,影响记忆与学习能力。
实验结果显示,模型组Nogo-A、NgR、RhoA、ROCK2相对表达量与空白和假手术组相比上调,提示急性脑梗死可能增加大鼠轴突生长抑制因子的表达。川赤中剂量组Nogo-A相对表达量在给药3天和14天与川赤低、高剂量相比下调最多(P<0.05),在7天时川赤中高剂量组间相对表达量无差异,且低于川赤低剂量组(P<0.01)。川赤中剂量组NgR相对表达量在给药3天、7天和14天均低于川赤低、高剂量组(P<0.05)。给药3天、7天川赤中、高剂量组RhoA相对表达量下调最多(P<0.01),而给药14天川赤低、中、高剂量组RhoA相对表达量差异不明显。给药3天川赤中、高剂量组ROCK相对表达量低于川赤低剂量组(P<0.05);给药7天与川赤低、高剂量组比,川赤中剂量组下调最多(P<0.01);给药14天,川赤中剂量组比低剂量组下调明显(P<0.05),与高剂量组无差异。由此可以推测,川芎赤芍组成的益气活血方能够下调内在生长抑制因子Nogo-A/RhoA/ROCK2 mRNA的表达以降低急性脑梗死带来的神经损伤,且中剂量川芎赤芍疗效可能较好。
通过本研究我们发现川芎赤芍可降低急性脑梗死大鼠Nogo-A、NgR、RhoA、ROCK2 mRNA的相对表达量(P<0.05),且给药3天、7天和14天后这种下降趋势依然存在,因此推测川芎赤芍对于急性脑梗死大鼠神经损伤的保护是持续性的,川赤中剂量组可能治疗效果较好。这些数据均支持川芎赤芍可能有神经修复作用,为研究其作为治疗急性脑梗死潜在新药打下基础。
