不良反应因果关系判定方法对上市后中成药安全性评价的指导意义*
2019-01-29陈诗琪李幼平邝心颖商洪才
陈诗琪,郑 蕊,李幼平,邝心颖,商洪才**
(1.北京中医药大学东直门医院 北京 100700;2.四川大学华西医院中国Cochrane中心/中国循证医学中心 成都 610041)
不良反应因果关系判定是药品不良反应报告的重要步骤之一,以确定发生的不良反应是否与目标药物相关,相关程度有多少,是否与其他药物、疾病进程密切相关等。上市前部分中成药缺乏严格的Ⅰ-Ⅲ期临床试验,临床应用过程中群体安全性无法预测,上市后中成药的安全性评价就更为重要。而临床用药环境复杂,如何对中成药进行客观、公正的个体化安全性评价,需要临床医师、药师对不良反应报告进行全面的资料搜集,并及时应用标准的因果关系判定方法进行药物关联性分析。本文将介绍国内外常见的不良反应因果关系判定方法,并针对我国药品不良反应监测中心制定的判定准则(简称为卫生部评定法),进行有关上市后中成药安全性评价的解读和说明。
1 常见的不良反应因果关系的判定方法
1.1 世界卫生组织乌普萨拉监测中心药品-事件因果关系评价方法(WHO Collaboration Center for International Drug Monitoring(The Uppsala Monitoring Centre),简称WHO-UMC评定法)[1]
WHO-UMC是专家判断法的代表性方法[2],其评定内容来源于1977年提出的Karch与Lasagna方法[3],原始方法主要从5个方面进行判定:①不良反应症状消失后,再次用药是否发生相同的不良反应(再激发试验);②是否为该药物已知的不良反应发生类型;③停止或减少用药后,不良反应症状是否减轻或消失(去激发试验);④可疑药物与不良反应发生的时间顺序是否合理;⑤是否有其他的原因或混杂因素。考虑到以上5个方面的因素,WHO-UMC将药物因果关系的评定分为以下6个等级(表1)。

表1 WHO-UMC评定法[1,4]

表2 我国现行因果判定关联性评价标准[6]
1.2 我国药品不良反应监测中心制定的判定准则(简称为卫生部评定法)[5,6]
2011年,我国原卫生和计划生育委员会发布了最新的中华人民共和国卫生部令81号《药品不良反应报告和监测管理办法》[5],将药品不良反应/事件报告表中的关联性评价继续按6级评定方法进行关联性分析,分为肯定,很可能,可能,可能无关,待评价,无法评价6种级别,该方法很大程度的借鉴了WHO-UMC评定法。详细内容发布在2012年版《药品不良反应报告和监测工作手册》[6]中(表2)。
1.3 法国Naranjo的APS评分法
该方法属于标准判断法[7]的代表性评分方法,即按照相关问题的设定和评分标准,对引起不良反应的因素进行评分后,评估不良反应的药物的相关程度。共划分为4个等级:“肯定”(分值总分≥9分)、“很可能”(分值总分在5-8分)、“可能”(分值总分在1-4分)、可疑(分值总分≤0分)。该方法考察的重点内容[8]包括时间顺序、去激发试验、再激发试验、有无类似反应资料、与其他因素是否相关、实验室检查结果等(表3)。
1.4 药物和草药诱导性肝损伤的评估工具——新版RUCAM法(Roussel Uclaf CausalityAssessment Method)
作为广泛认可的药物和草药诱导性肝损伤因果关系评估工具,RUCAM法自1993年制定以来,经过大量的实践经验,大大改善了对药物和草药诱导性肝损伤的诊断状况,促进了临床研究的发展[9,10]。新版RUCAM法在旧版的基础上增强了数据链评估的完整性,分别设计了肝细胞损伤型、胆汁淤积性与混合型肝损伤专用量表[11]。量表的评估要素包括7个方面:用药至发病的时间间隔、停用药物/草药后肝功能指标(丙氨酸氨基转移酶、门冬氨酸氨基转移酶等)的动态变化过程、相关危险因素(酒精、年龄、妊娠)、同时应用的药物/草药、其他病因的排查、既往肝毒性史、非故意的再暴露反应等。总评分范围在+14--9之间,分为5级评价标准:可排除(≤ 0);不可能(1-2);有可能(3-5);很可能(6-8);极可能(≥ 9)。与其他不良反应因果关系判定方法相比,新版RUCAM法是一种具有肝毒性特异性并能及时评估药物因果关系的诊断方法[11]。然而,该方法也有一定的局限性,不适用于评估慢性药源性肝损伤和已有肝病患者的疑似药源性肝损伤,可供前瞻性分析,不适用于回顾性分析[12]。
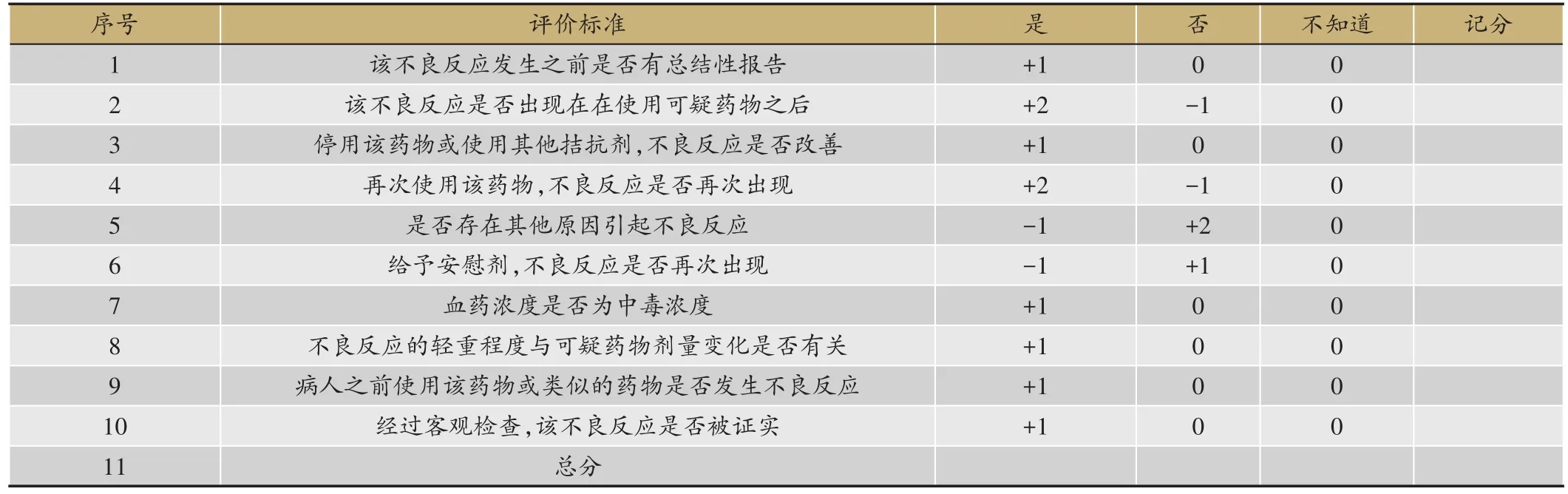
表3 Naranjo的APS评分法[8]
1.5 贝叶斯不良反应诊断法(简称贝叶斯法)
可疑药物与不良反应的因果关系评价常常是复杂的鉴别诊断过程,需要排除其他药物、非药物的干扰,应用科学的统计学手段进行评定。在相关流行病学资料与病例信息的支持下,贝叶斯法应用统计学的概率语言得出可疑药物因果评价的结果,即支持可疑药物是不良反应原因的后验比[13]。该评价方法需要5个实施步骤:确定病例的参数、收集病例有关资料、估算先验比、估算似然比、估算后验比。在应用过程中,需要计算5个似然比,评价可疑药物引发不良反应/事件发生的5个可能的影响因素,即去激发试验结果、用药史、症状特征、发作时间、再激发试验结果。通过筛选、排列出具有引发不良反应最大概率的原因,推断出主因,可进一步得出客观、定量、准确的结果[14]。然而,该法计算复杂,难以掌握,缺乏背景资料,仍未被广泛应用[2]。
2 上市后中成药不良反应的关联性分析要点
2.1 可疑药物与不良反应发生的时间顺序
可疑中成药使用后,发生不良反应的时间是否合理,是判断关联程度为“可能相关”的前提。不同中成药发生不良反应的时间存在差异,临床判定时,要充分考虑毒性药物的潜伏期,如壮骨关节丸引起肝损伤的发病率较高,平均潜伏期为46.8天[15];含有马兜铃酸成分(关木通、广防己等)的中成药的毒性靶器官为肾脏和泌尿系统,其特点为慢性蓄积性,随剂量加大而加重[16]。中药注射剂静脉注射临床常见过敏反应与类过敏反应,不良反应发生较快,临床使用时需要密切监测[17]。
2.2 去激发试验
去激发试验是指停药以后反应立即停止,或迅速减轻、好转(根据机体免疫状态某些不良反应可出现在停药数天后)。该试验是在时间顺序合理的基础上,进一步确定“很可能相关”的必要条件。中成药在用药过程中出现不良反应,停药后予以对症治疗症状迅速减轻,也应属于去激发试验阳性的范畴。
2.3 再激发试验
再激发试验阳性是指临床已经出现不良反应的药物再次使用,不良反应再现,并出现明显加重的情况,是判定因果关系为“肯定相关”的重要条件之一。在临床判定过程中,此试验具备一定的风险,当有可能被伦理道德接受时,应尽可能进行激发试验[18];若已发生严重不良反应或不可逆的器官损害,不应继续进行。若临床用药过程中非目的性地得到了激发试验的结果,应详细记录,并作为重要的不良反应资料加以论证。
2.4 既往不良反应资料
关联性判断的一致性是指可疑药物发生的不良反应/事件是否与药物已有的信息一致[4]。既往不良反应资料可以从药品说明书、最新的药理毒理学研究、国家药监部门公开发布的警示信息、《药典》、《国家基本药物临床应用指南》(中成药卷)、发表文献等资料中进行收集。当可疑药物出现了新的严重的不良反应,应将其因果关系暂时判定为“待评价”,待相关文献资料进一步佐证,并通过逐一排除其他原因引起的不良反应后,继续进行因果关系判定。
2.5 其他因素的影响
其他因素是指合并用药、疾病进展、其他治疗手段等混杂因素的影响。上市后中成药与其他中成药、西药的联合应用十分普遍,临床医师应详细报告发生不良反应人群的基础疾病与合并用药情况,便于3级评价单位(报告单位、省级及国家不良反应监测中心)依据详细的报告信息进行可疑药品的关联性评价。
3 对上市后中成药安全性评价的指导意义
3.1 完善中成药不良反应报告内容
以上国内外常见的不良反应因果关系判定方法虽各有差异,但均考察了我国卫生部评定法中重点考察的5个方面(时间性、再激发试验、去激发试验、既往资料、其他因素等),提示上市后中成药的不良反应报告应重点对这些内容进行补充完善,以便于对药物不良反应的因果关系进行充分的判定。
针对具有可疑肝毒性的中成药,笔者团队认为应在卫生部评定法的基础上,进一步采用新版RUCAM法对药物和草药诱导性肝损伤进行评估,以明确中药药源性肝损伤的风险,应加强基础与临床安全性证据的研究,指导此类中成药临床的合理使用。
3.2 挖掘有效的中成药安全性预警信号
国家药品不良反应监测中心的自发呈报系统(spontaneous reporting system,SRS)可广泛收集到一定时期和一定区域内可疑药品的不良反应,经过严格的3级因果关系判定,确定与药品的关联程度。该系统具有监测范围广、易于实施、不受时间和空间的限制、便于对病例进行追踪等优点,是目前世界上挖掘不良反应信号、进行不良反应监测最基本的手段,也是目前针对上市后中成药不良反应监测主要采取的方法[19]。通过运用该方法对上市后中成药早期警戒信号进行数据挖掘,并进行严格的关联性评价,能够及时有效的发现药品不良反应信号并主动预警,有效预防并避免严重不良反应的发生[20]。
3.3 探索不良反应机制,补充不良反应资料
上市后中成药需要进行有效性、安全性、经济性、适用性的整体评价,提升药品质量,明晰安全性证据体,保证用药安全[21]。但是临床用药环境复杂,中成药说明书内容不尽完备,在使用中成药过程中,不合理用药、联合用药常常会导致不良事件/反应发生数量增加,因果关系的评定也相对复杂,追溯较为困难。
考虑到不良反应因果关系的评定要求,上市后中成药的使用必须首先明确临床定位,包括优势病种、疾病症状以及适用证型等,结合循证医学系统评价的证据,合理地应用于临床实践。对临床有较多不良事件/反应报告的中成药,应重点关注其安全性监测、安全性评价结果,进行药品风险控制。通过真实世界临床研究、SRS监测数据、基础实验相结合的方法,明确不良反应发生的时间、不良反应类型和机制等,分析相关药物成分的风险因素[22]。通过进一步补充不良反应资料,逐步完善中成药药品说明书。随着新技术、新方法的不断出现,应用网络药理学预测药物相互作用的靶点和通路,药动学明确药物相互作用的体内过程,各种组学技术监测体内内源性物质变化规律,构建药物分子-作用靶点-内源性物质的安全性评价新模式[23],也可以作为一种新的思路与方法。
