高表达SEMG1蛋白的弱精子症大鼠模型的建立
2019-01-28郭晓彬张万松肖卓裕吕娴媛王鹏杨诚刘存东周其赵
郭晓彬 张万松 肖卓裕 吕娴媛 王鹏 杨诚 刘存东 周其赵
南方医科大学第三附属医院泌尿外科(广州 510630)
随着不孕不育发病率的升高,生殖健康成为一个全球性的健康难题。调查显示育龄夫妇中约有10%~15%患有不孕不育,其中接近一半由男性不育导致[1]。男性不育患者中绝大部分由于精子数量及活力显著低下引起,即弱精子症。弱精子症的病因复杂多样,发病机制尚未清楚[2]。既往的研究发现SEMG1基因(semenogelin I)编码的蛋白质是男性精液中主要的蛋白质,功能是将射精精子包裹在一种凝胶状的基质中,在射精后迅速被前列腺特异抗原PSA(prostate⁃specific antigen)酶解成小的多肽,这种蛋白酶解过程破坏了凝胶状基质的性质,从而使精液液化,精子也获得更多的运动能[3-4]。多项研究[5-7]表明SEMG1在弱精子症患者精子中表达水平明显升高,在弱精子症发生发展过程中起到重要作用。同时研究[4-8]表明SEMG1不仅表达于精囊及精子中,在附睾及睾丸中也有少量表达,但其在睾丸中表达所发挥的作用尚未清楚,在动物模型中睾丸SEMG1蛋白表达水平与弱精子症的关系尚未明确。环磷酰胺(cy⁃dophosphamide,CP)是一种临床常见的烷化剂类抗肿瘤药物,广泛应用于对各种血液系统疾病和实体肿瘤的治疗[9]。研究表明CP能够破坏生精细胞,导致各级精母细胞脱落,进而造成弱精的表现[10],因此被广泛用于弱精子症动物模型的构建[11]。本研究使用环磷酰胺腹腔注射法成功构建弱精子症大鼠动物模型,检测发现弱精子症大鼠睾丸中SEMG1蛋白的表达水平较对照组明显升高,成功构建了睾丸中高表达SEMG1蛋白的弱精子症大鼠模型。本研究将为进一步研究SEMG1在睾丸生精过程中的作用奠定了良好的动物模型基础。
1 材料和方法
1.1 实验动物7~8周龄清洁级健康雄性SD大鼠,由南方医科大学医学实验动物中心提供[实验动物许可证号:SYXK(粤)2011-0074]。
1.2 主要仪器及试剂正置显微镜(Leica⁃DME日本),冰冻切片机(德国美康HM550),电泳仪和电转仪(Bio⁃Rad,美国),环磷酰胺由江苏恒瑞医药有限公司生产(国药准字H32020856,0.1 g/支,粉末状),购于本院门诊药房.总蛋白提取试剂盒(Beyotime,上海),蛋白浓度测定试剂盒(Beyo⁃time,上海),SEMG1、GAPDH单克隆抗体(abcam,美国),CASPASE-3、BCL2多克隆抗体(abconal,美国),HRP标记羊抗兔IgG(RayAntibody,北京),PVDF膜(BioTrace,墨西哥)。
1.3 方法
1.3.1 动物模型建立、取材健康6~8周龄雄性体重约(340±10)g的SD大鼠30只,饲养环境温度为23~25℃,每天自然光光照12 h,过程中大鼠均可自由摄食、饮水,适应性饲养5 d。大鼠被随机分为空白对照组、阴性对照组和实验组,每组10只。空白对照组不做任何处理,实验组按60 mg/kg腹腔注射环磷酰胺,阴性对照组按60 mg/kg腹腔注射0.9%生理盐水,每天1次,持续5 d。第30天时,颈椎脱臼处死大鼠,称其质量,摘取大鼠双侧睾丸并称量质量,睾丸指数=单侧睾丸质量/大鼠质量,剪取附睾尾部置于细胞培养箱内让精子游离,取精子悬液在光学显微镜下分别计数a级和b级精子数量,一侧大鼠睾丸用10%多聚甲醛固定,另一侧大鼠睾丸置于-80℃冰冻备用。
1.3.2 睾丸指数、精子密度及各级精子活力计数在6 cm培养皿中加入37℃预热的生理盐水1 mL,放入剪碎的附睾尾并将培养皿置入37℃温箱孵育20 min制成精子悬液,紧接着用生理盐水将精子悬液稀释至100倍轻轻混匀,用吸管吸取5 μL悬液,光学显微镜下计算精子的密度,并在多个视野下观察200个精子中a级和b级精子的数量。根据WHO标准,a级为快速向前运动的精子,b级为慢或呆滞的向前运动。
1.3.3 睾丸组织HE染色空白对照组,阴性对照组及实验组睾丸组织置于10%中性甲醛溶液浸泡24 h,梯度酒精脱水,二甲苯透明石蜡包埋,石蜡切片机制备5 μm的连续切片,分别随机选取各组睾丸组织石蜡切片3张,常规HE染色后显微镜下观察睾丸组织生精结构形态学观察并拍照。
1.3.4 蛋白质免疫印迹提取睾丸组织蛋白加入上样缓冲液,沸水煮沸变性10 min,每个上样孔加入40 μg样品,10%SDS⁃PAGE凝胶电泳将蛋白质分离。电泳结束后,湿法转印至PVDF膜上,转膜结束后,用5%BSA室温封闭1 h。相应的抗体按说明书进行稀释,分别置于4℃过夜。TBS⁃T洗膜3次,每次10 min,加入二抗兔抗羊抗体室温下孵育1 h,TBS⁃T彻底洗膜5次,每次5 min后,Bio⁃Rad凝胶成像系统获取蛋白条带图。
1.4 统计学方法使用SPSS 17.0软件进行实验数据统计分析。正态分布的计量资料用均数±标准差表示,多组比较用单因素方差分析,P<0.05为差异具有统计学意义。
2 结果
2.1 环磷酰胺对大鼠质量、睾丸质量、睾丸指数和精子密度及活力的影响空白对照组,阴性对照组及实验组之间大鼠质量差异无统计学(P>0.05)。实验组睾丸质量以及睾丸指数明显低于空白对照组及阴性对照组(P<0.001);实验组的精子数量及a、b级精子活力明显低于空白对照组及阴性对照组(P<0.001)。见表1。
表1 环磷酰胺对大鼠质量、睾丸质量、睾丸指数和精子密度及活力的影响Tab.1 Effects of cyclophosphamide on rat quality,testicular mass,testicular index,sperm density and viability±s
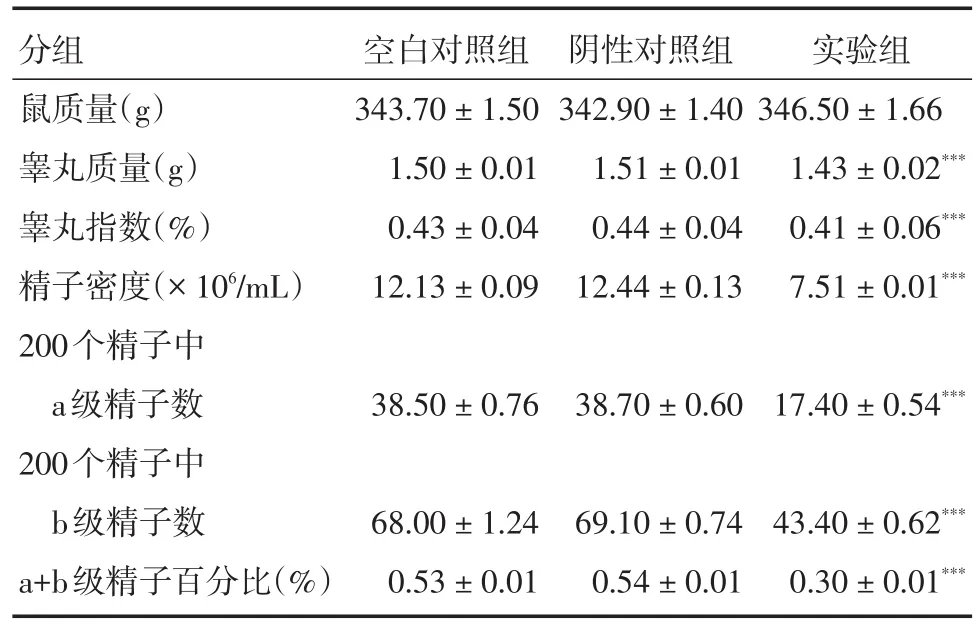
表1 环磷酰胺对大鼠质量、睾丸质量、睾丸指数和精子密度及活力的影响Tab.1 Effects of cyclophosphamide on rat quality,testicular mass,testicular index,sperm density and viability±s
注:***0.001
分组鼠质量(g)睾丸质量(g)睾丸指数(%)精子密度(×106/mL)200个精子中a级精子数200个精子中b级精子数a+b级精子百分比(%)空白对照组343.70±1.50 1.50±0.01 0.43±0.04 12.13±0.09阴性对照组342.90±1.40 1.51±0.01 0.44±0.04 12.44±0.13实验组346.50±1.66 1.43±0.02***0.41±0.06***7.51±0.01***38.50±0.7638.70±0.6017.40±0.54***68.00±1.24 0.53±0.01 69.10±0.74 0.54±0.01 43.40±0.62***0.30±0.01***
2.2 环磷酰胺对大鼠睾丸形态结构的影响根据睾丸切片HE染色图可以看到,空白对照组及阴性对照组睾丸生精小管结构完整,各级生精细胞层次分明,可见大量长形精子细胞(见图1A、1B)。实验组中可以看到各级生精细胞排列紊乱、细胞间隙增宽、数量明显减少,管腔内精子数量明显减少(图1C)。
2.3 弱精子症大鼠睾丸中SEMG1及CASPE⁃3及BCL⁃2蛋白表达水平变化Western blot结果显示,与对照组相比,实验组睾丸中SEMG1及CASPE⁃3蛋白表达水平升高(P<0.05),BCL⁃2蛋白表达水平降低(P<0.05)。见图2。
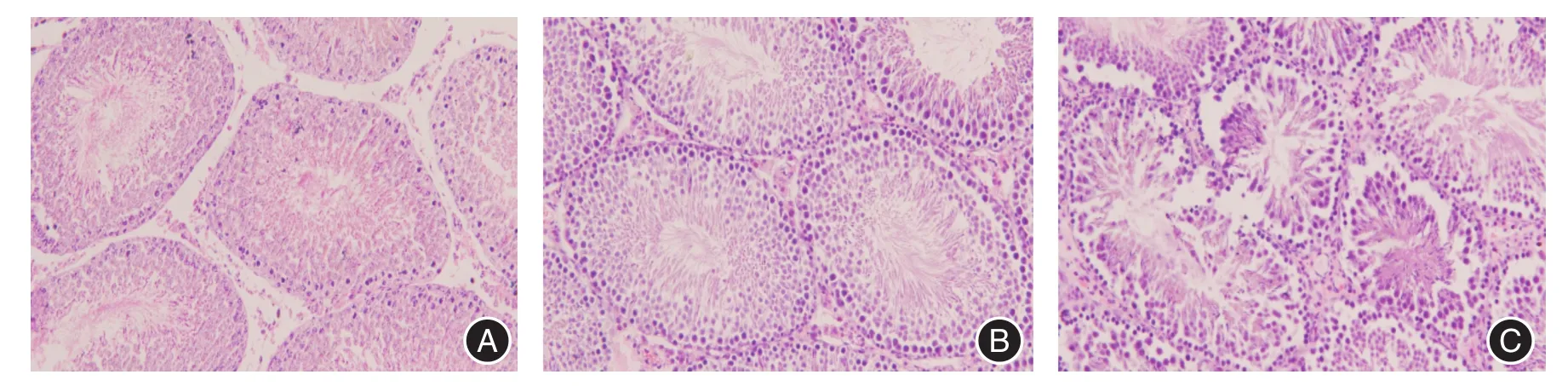
图1 各组睾丸组织HE染色高倍镜下的形态结构(×40)Fig.1 Morphological structure of HE stained in testis of each group(×40)
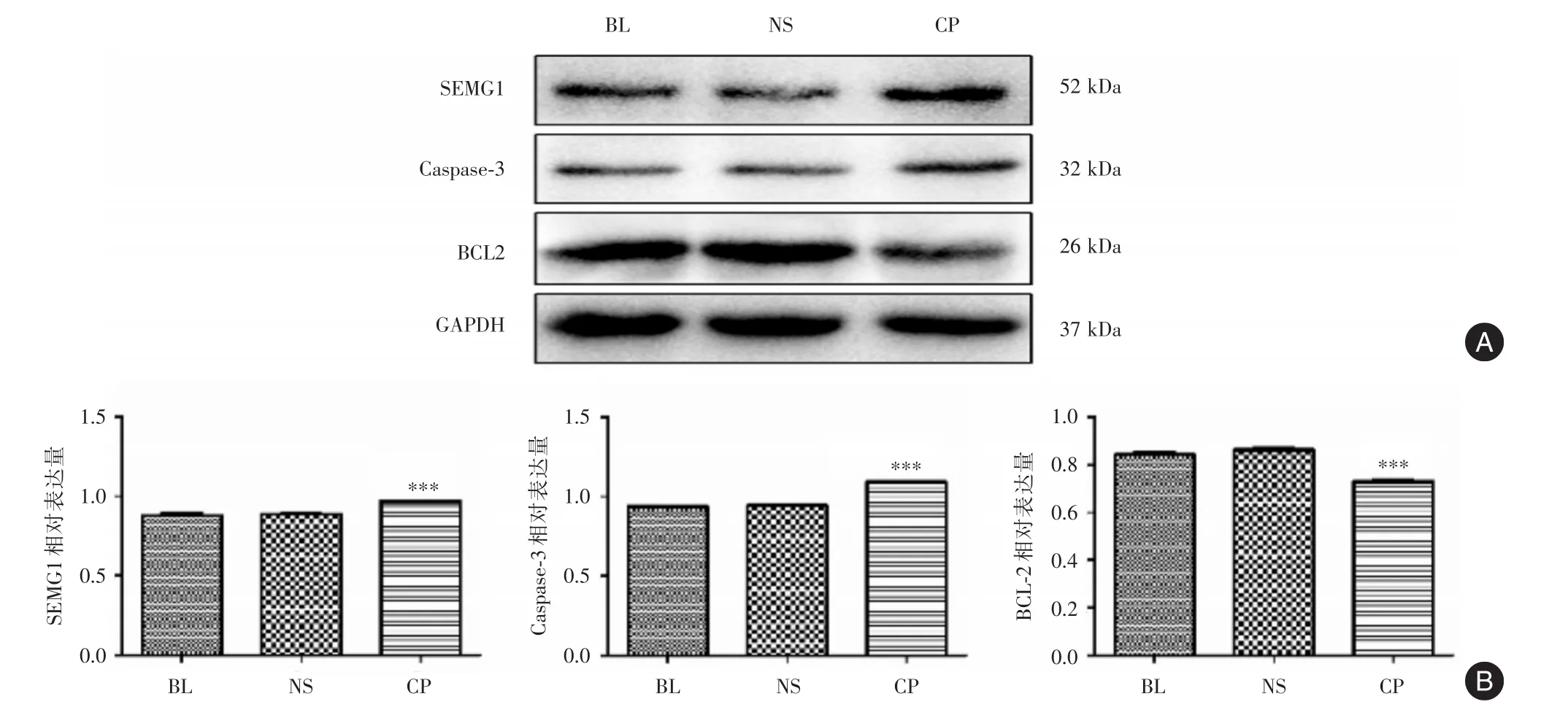
图2 弱精子症大鼠睾丸中SEMG1及CASPASE⁃3及BCL⁃2蛋白表达水平Fig.2 SEMG1,CASPASE⁃3 and BCL⁃2 protein expression levels in the testis of asthenozoospermia rats
3 讨论
弱精子症发生发展与多种因素有关,如:泌尿系感染[12],精索静脉曲张[13]等,但具体的分子机制尚未清楚。近年来,男性不育的研究取得一定的进展,如WANG等[14]发现DJ⁃1和NDUFS3之间的相互作用被破坏以及精子和睾丸DJ⁃1蛋白的下调可导致弱精子症的发生。XU等[15]发现RNASET2可以通过抑制PKA/PI3K/钙信号传导途径来降低精子活力。在本研究前期研究及多项研究中发现SEMG1在人弱精子症患者精子中表达水平比正常精子明显升高[5-6,16-17],但尚未有研究报道该基因在弱精子症鼠模型睾丸中的表达水平。本研究根据文献报道[11],使用环磷酰胺腹腔注射法构建弱精子症大鼠模型。虽然实验结果显示不同组大鼠的质量无明显差异,但实验组睾丸质量及睾丸指数较对照组下降,该实验结果与目前文献报道一致[18]。同时观察到腹腔注射环磷酰胺后大鼠精子密度及精子活力明显降低,睾丸组织HE染色见睾丸生精小管中各级生精细胞排列紊乱,生精细胞数量减少。此外,腹腔注射环磷酰胺后大鼠睾丸中CASPASE⁃3表达水平升高,BCL2表达水平下降。Caspase家族在介导细胞凋亡的过程中起着非常重要的作用,其中Caspase⁃3为关键的执行分子;BCL2在哺乳动物细胞中可调节线粒体外膜通透性,大多数定位在线粒体外膜上,在受到信号刺激后转移到线粒体外膜上,可抑制细胞凋亡。本研究结果表明,注射环磷酰胺后大鼠睾丸中Cas⁃pase⁃3表达水平升高,BCL2表达水平下降,这些结果表明大鼠腹腔注射环磷酰胺后睾丸中的生精细胞凋亡增加。高学勇等[19]使用原位缺口末端标记法(TUNEL)检测腹腔注射环磷酰胺后生精细胞的凋亡情况也得到了相同的结果,证明本研究弱精子症大鼠模型构建成功。
Western blot检测SEMG1蛋白在构建成功后的弱精子症大鼠睾丸中的表达发现,SEMG1的表达水平明显高于对照组(P<0.001)。既往研究表明,SEMG1是精液中的主要蛋白质,与弱精子症有密切的的关系,SEMG1基因失能或突变会导致男性不育。研究者利用计算机辅助运动轨迹分析、流式细胞术、共聚焦荧光显微镜等研究方法发现SEMG1降低精子活力是通过修饰精子细胞膜的结构,调节细胞膜跨膜电位,以时间依赖的方式增加精子细胞膜的渗透性,间接抑制精子的运动[20-22]。睾丸是精子发生的部位,睾丸内含有不同时期的生精细胞,本研究表明环磷酰胺腹腔注射后其代谢产物刺激各级生精细胞,使生殖细胞内SEMG1表达水平升高,从而使生殖细胞的细胞膜通透性增加,最终导致生殖细胞的凋亡增加。睾丸中包含各个时期的生殖细胞,腹腔注射环磷酰胺后睾丸中哪一时期的生殖细胞SEMG1升高或者所有时期的生殖细胞SEMG1蛋白表达均升高尚未清楚,有待进一步的研究。文献报道[23]环磷酰胺可引起睾丸DNA损伤,诱导生殖细胞DNA畸形、断裂或突变,导致精子DNA断裂,最终导致雄性不育、诱发肿瘤、甚至子代畸形。本研究发现腹腔注射环磷酰胺后大鼠睾丸中凋亡蛋白CASPASE⁃3升高,抗凋亡蛋白BCL2表达降低,提示睾丸中的生殖细胞凋亡增加。有趣的是腹腔注射环磷酰胺后睾丸中SEMG1蛋白的表达水平也升高了,本研究首次报道了该蛋白在弱精子症的大鼠睾丸中高表达。
综上所述,本研究使用环磷酰胺腹腔注射法成功构建了睾丸中高表达SEMG1蛋白的弱精子症鼠模型,为进一步研究SEMG1蛋白在睾丸中的生物学功能及其在弱精子症中高表达的分子机制奠定了良好的动物模型保证。
