不同用量风化煤腐殖酸对玉米根系的影响
2019-01-28周丽平袁亮赵秉强李燕婷林治安
周丽平,袁亮,赵秉强,李燕婷,林治安
不同用量风化煤腐殖酸对玉米根系的影响
周丽平,袁亮,赵秉强,李燕婷,林治安
(中国农业科学院农业资源与农业区划研究所/农业农村部植物营养与肥料重点实验室,北京 100081)
【目的】我国风化煤腐殖酸储量丰富,腐殖酸含有多种活性官能团,其对植物生长发育具有重要意义。当腐殖酸施于土壤时,根系对腐殖酸的响应是促进植物生长的最初动力。因此,研究腐殖酸对玉米根系生长发育的影响机制,可为风化煤腐殖酸资源的高效利用和作物的增产提质提供理论依据。【方法】采用霍格兰营养液溶液培养试验,供试玉米品种为郑单958,待玉米幼苗长至两叶一心时移到营养液培养盆钵中缓苗1 d,外源添加不同添加量(0、5、10、15和20 mg C·L-1)腐殖酸,研究其对玉米生物量、根冠比、根系形态以及根部养分状况的影响。【结果】(1)腐殖酸可显著增加玉米根系和地上部干物质量、根冠比、根系活力和根系TTC还原总量,较对照分别平均提高42.31%、19.33%、18.18%、46.54%和81.01%。(2)腐殖酸可改善玉米根系的形态,其处理玉米总根长、总根数量、根体积、根表面积和平均直径分别比对照平均提高13.51%、16.74%、69.62%、14.68%和49.28%。(3)添加腐殖酸可增加玉米根系的轴根数、轴根长度和侧根数,腐殖酸处理分别比对照提高16.28%、21.65%和16.80%。(4)随腐殖酸添加量的增加,对玉米根系生长的促进作用呈现先升高后降低的变化,以中等浓度(10mg C·L-1)腐殖酸对玉米根系的作用效果最明显,其根干物质量和根系活力分别比对照提高了69.36%和69.07%。(5)腐殖酸处理(尤其是10 mg C·L-1)可有效增加玉米根系糖类、碳水化合物、脂类物质、蛋白质、多肽和氨基酸类物质等的含量。【结论】添加腐殖酸可明显增加玉米干物质量和根系活力,增加根冠比,改善根系形态,有效增加玉米根系主要化学组分的含量。本试验条件下,中等浓度(10 mg C·L-1)的腐殖酸对玉米根系的促进作用最好。
腐殖酸;玉米;根系;风化煤;添加量
0 引言
【研究意义】腐殖酸是动植物遗骸经过微生物的分解和转化以及地球化学、物理的一系列变化过程而形成积累起来的一类具有多种官能团的大分子有机弱酸混合物[1]。活性官能团使腐殖酸具有酸性、亲水性、界面活性、阳离子交换能力、络合作用及吸附分散能力[2-3],这些特性使其对作物生长具有良好的促进作用。腐殖酸广泛存在于土壤、水和煤中。其中土壤和水中的腐殖酸含量很低,而一些低热值的煤炭,如泥煤、褐煤和风化煤不仅储量丰富,腐殖酸含量也很高,具有较好的开发利用价值[1]。国外的研究多集中在土壤、泥炭和褐煤腐殖酸上,对风化煤腐殖酸的研究较少。我国风化煤资源储量丰富,其腐殖酸含量较高,且含氧官能团的数量相对较高[4-5],在农业中具有极大的应用前景[6-7]。研究发现,在植物生长过程中,腐殖酸对根系生长的刺激作用是其对植物产生刺激作用的最初动力[8]。因此,研究明确风化煤腐殖酸对玉米根系的影响规律,对于我国农业生产意义重大。【前人研究进展】DOBBSS等[9]的研究表明,腐殖酸可促进植物根系的生长发育,蚯蚓粪腐殖酸促进不同作物生长的最适浓度不同,对于拟南芥、玉米和番茄,诱导侧根出苗的腐殖质的最适浓度分别为3.87、2.05和4.54 mmol C·L-1。MAGGIONI等[10]的研究结果表明,中间浓度的土壤腐殖酸对燕麦根系K+和SO42-吸收的促进效果明显优于过低或过高浓度的腐殖酸处理。AZCONA等[11]研究了200和500 mg C·L-1的堆肥污泥腐殖酸和褐煤腐殖酸对番茄根系生长的影响,结果发现,500 mg C·L-1的堆肥污泥腐殖酸和褐煤腐殖酸处理的根干重均明显高于200 mg C·L-1的处理。MORA等[12]研究了低浓度(5mg·L-1)和高浓度(100 mg·L-1)的褐煤腐殖酸对黄瓜生长的影响,结果发现,高浓度腐殖酸具有较好的促根效果,并且腐殖酸对黄瓜地上部生长的影响涉及在植株根系和芽中与硝酸盐浓度有关的细胞分裂素、多胺和矿质营养浓度的变化。【本研究切入点】过去关于腐殖酸添加量对作物根系生长发育影响的研究多集中在土壤腐殖酸和褐煤腐殖酸,对于风化煤腐殖酸对作物根系调控的研究相对较少,且结论不一。【拟解决的关键问题】本研究以来源较广的风化煤腐殖酸为试验材料,以研究玉米根系对不同添加量风化煤腐殖酸的响应,探究风化煤腐殖酸对玉米根系的作用规律,从而为风化煤腐殖酸资源在农业中的优化利用提供理论依据和技术支持。
1 材料与方法
1.1 供试材料
供试夏玉米品种为郑单958(L.)。供试风化煤来自内蒙古棋盘井煤矿(东经107°12'E,北纬 39°21'N,内蒙古自治区鄂尔多斯市),腐殖酸是采用IHSS标准方法从风化煤中提取[13],提取率为50.40%。供试腐殖酸的碳、氢、氧和氮含量分别为47.00%、4.89%、1.04%和33.56%。
1.2 试验设计
试验在中国农业科学院农业资源与农业区划研究所人工气候室进行,白天温度为28 ℃,夜间温度为20 ℃,光照强度为500 μmol·m-2·s-1。试验共设置5个处理,分别为不添加腐殖酸对照(CK),添加5mg C·L-1腐殖酸(HA1),添加10 mg C·L-1腐殖酸(HA2),添加15 mg C·L-1腐殖酸(HA3)和添加20 mg C·L-1腐殖酸(HA4)。每个处理6次重复,随机区组排列,为测定不同的生物指标,试验分3次进行。
所用营养液为霍格兰营养液,其组分为Ca(NO3)2·4H2O:1.18 g·L-1;KNO3:0.51 g·L-1;MgSO4·7H2O:0.49 g·L-1;KH2PO4:0.14 g·L-1;EDTA- Fe:0.036 g·L-1;H3BO3:2.86 mg·L-1;MnCl2·4H2O:1.81 mg·L-1;ZnSO4·7H2O:0.22 mg·L-1;CuSO4·5H2O:0.08 mg·L-1;H2MoO4·4H2O:0.09 mg·L-1[14]。
玉米种子经70%的酒精表面消毒10 min,用蒸馏水洗净后,在蒸馏水中浸泡24 h,转移至石英砂中,在25 ℃下遮光环境中萌发3 d,出苗后移入生长室。两叶一心时,精选出苗整齐的幼苗,去掉胚乳后移入盆钵中缓苗,每盆一株。缓苗营养液pH为 6.0±0.5(用1 mol·L-1的NaOH溶液和1 mol·L-1的HCl溶液调节营养液pH),2 d后换成完全营养液,每隔一天更换一次营养液。
1.3 样品测定
1.3.1 干物质量测定 移苗20 d后,将植株分为地上部与根系,蒸馏水清洗后,于105 ℃下杀青30 min,65 ℃下烘干至恒重并称重。根冠比为根系干重与地上部干重的比值。
1.3.2 根系活力测定 移苗20 d后,采集植株根系,蒸馏水洗净后,采用TTC还原法测定根系活力[15],根系TTC还原总量为根鲜重与TTC还原强度的乘积。
1.3.3 根系形态指标测定 移苗20 d后,截取植株 根系,蒸馏水洗净后,利用平板扫描仪扫描(扫描仪设置:专业模式、胶片(带导轨)、8位灰度、400 dpi、黑白正片、保存格式.tif格式)得到根系扫描图片,图片利用WinRhizo根系分析软件处理分析,获得玉米根系形态指标(总根长、根体积、根表面积和根平均直径),并测定轴根长和轴根数,计算出总侧根长和侧根密度。
1.3.4 植株红外光谱分析 将烘干的玉米植株根系磨碎后过0.2 mm筛,分别称取1 mg样品与200 mg溴化钾(KBr),放入玛瑙研钵中研磨均匀后进行压片,采用傅里叶变换红外光谱仪(型号:VERTEX 70,德国Bruker公司)检测玉米根系的光谱特征(波数范围为400—4 000 cm-1,分辨率为4 cm-1,扫描次数为32次)。
1.4 数据处理与分析
试验数据采用 Excel 2003和Origin 9.0软件对数据进行处理和作图,采用 SAS 9.1统计软件 Duncan方法进行方差分析。
2 结果
2.1 不同用量腐殖酸对玉米干物质量的影响
腐殖酸处理可提高玉米根系与地上部干物质量,各部位干物质量随腐殖酸添加量的增加呈先增加后降低的趋势(表1,>0.05)。与对照相比,腐殖酸处理根系干物质量提高17.95%—69.36%,地上部干物质量提高12.43%—32.02%,总重提高15.00%—38.70%,其中,HA2处理各部位干物质量最高。总体来看,腐殖酸处理玉米根系、地上部与总干物质量比对照分别提高42.28%、18.73%和22.94%,根冠比提高19.03%。
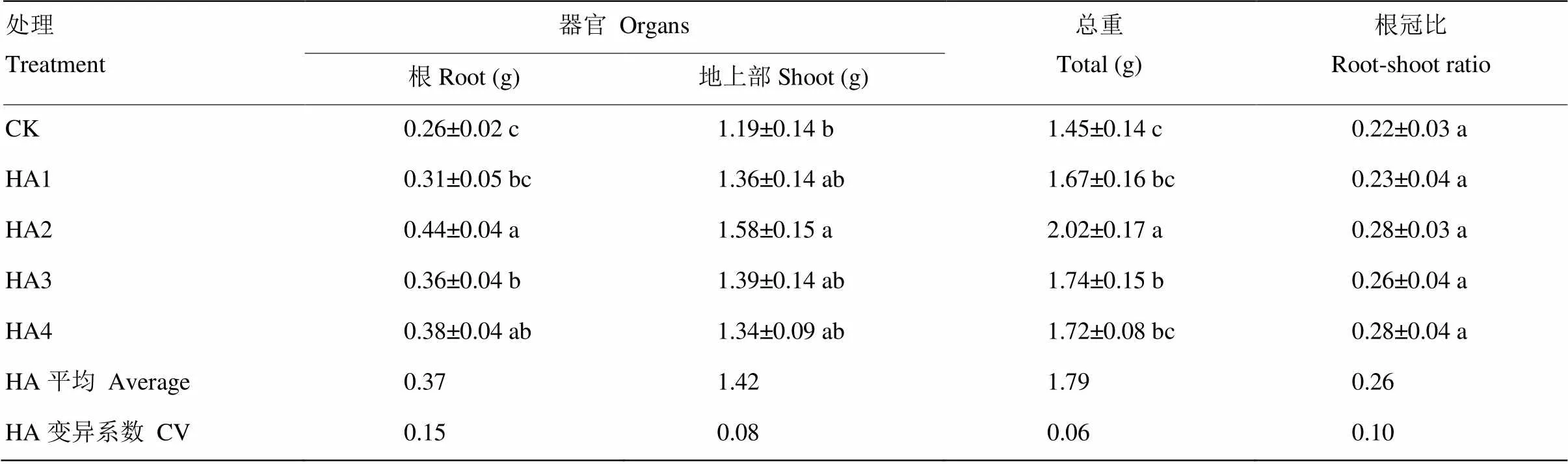
表1 腐殖酸对玉米干物质量的影响
CK:不添加腐殖酸;HA1:添加5 mg C·L-1腐殖酸;HA2:添加10 mg C·L-1腐殖酸;HA3:添加15 mg C·L-1腐殖酸; HA4:添加20 mg C·L-1腐殖酸。同列不同字母表示处理间差异达5%显著水平。下同
CK: No HA; HA1: 5 mg C·L-1HA; HA2: 10 mg C·L-1HA; HA3: 15 mg C·L-1HA; HA4: 20 mg C·L-1HA. Different letters in acolumn mean significant difference at the 5% level. The same as below
2.2 不同用量腐殖酸对玉米根系活力的影响
腐殖酸处理可显著提高玉米根系活力(表2,<0.05)。TTC还原强度与TTC还原总量随腐殖酸添加量的提高先增加后降低。与对照相比,腐殖酸处理玉米根系TTC还原强度和TTC还原总量分别提高46.53%和81.03%。其中,HA2处理(腐殖酸添加量为10 mg C·L-1)效果最好,其玉米根系TTC还原强度和TTC还原总量分别比对照提高69.07%和136.15%。HA3、HA4和HA1处理的玉米根系的TTC还原强度分别比对照提高48.83%、39.40%和28.82%,玉米根系TTC还原总量分别比对照提高75.48%、68.05%和44.45%。
2.3 不同用量腐殖酸对玉米根系形态的影响
添加腐殖酸可增加玉米根系的总根长、总根数量、根体积、根表面积和平均直径(表3)。与对照相比,腐殖酸处理的玉米总根长、总根数量、根体积、根表面积和平均直径的平均值分别比对照增加了13.51%、16.74%、69.62%、14.68%和49.28%。各项指标随腐殖酸添加量的增加先增加后降低。腐殖酸处理玉米总根长、总根数量、根体积、根表面积和平均直径分别比对照提高6.26%—24.78%、9.66%—30.92%、47.87%—94.14%、6.39%—26.23%和40.75%—61.55%。各腐殖酸处理中,腐殖酸添加量为10 mg C·L-1时,对根系构型各指标提高幅度最大,且与对照处理均达到显著差异(<0.05)。
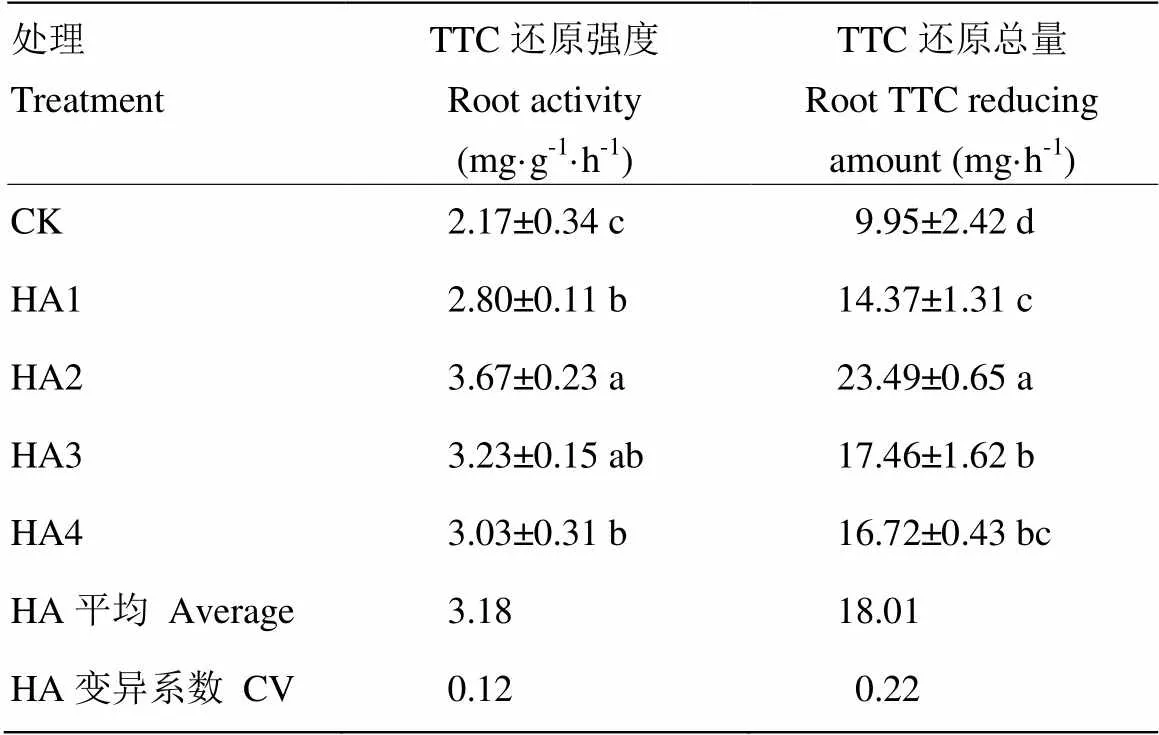
表2 腐殖酸对玉米根系活力的影响
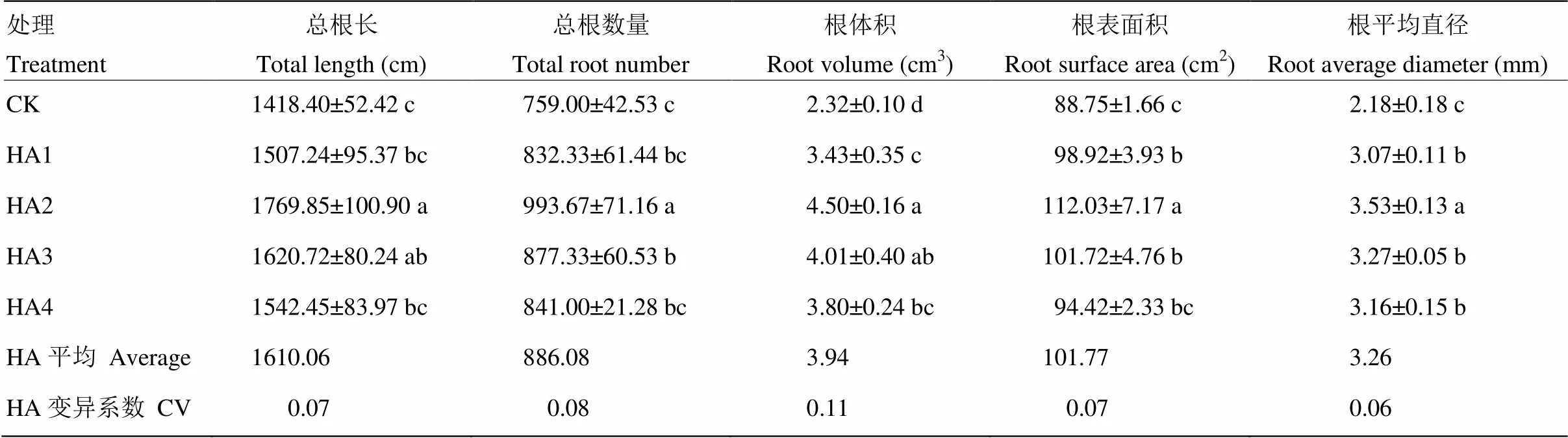
表3 腐殖酸对玉米根系形态的影响
适量添加腐殖酸可提高玉米根系的轴根数和轴根长度(图1),改善玉米根系的侧根数和侧根密度(图2)。腐殖酸处理玉米轴根数和轴根长度的平均值分别比对照提高16.28%和21.65%。HA4处理玉米轴根数最多、轴根长度最长,其次为HA2。与对照相比,HA4、HA2、HA3和HA1的轴根数分别提高27.91%、18.60%、9.30%和9.30%,轴根长度分别提高36.51%、30.07%、12.36%和7.67%。适量添加腐殖酸可提高玉米根系的侧根数,但其作用规律却与腐殖酸对玉米主根的影响不同。腐殖酸处理的玉米侧根数平均比对照提高16.8%。HA2处理的玉米侧根数最多。与对照相比,HA2、HA3、HA4和HA1的侧根数分别提高31.15%、15.71%、10.47%和9.67%,HA2的侧根密度最大,比对照处理提高了8.76%。
2.4 玉米根系FTIR分析
所有处理的玉米根系均具有相似的主要红外光谱吸收峰(图3),主要有(1)3 420 cm-1:-OH的伸缩振动和-NH的伸缩振动,主要来自糖类等碳水化合物[15];(2)2 920 cm-1:主要来自脂类物质中饱和甲基C-H伸缩振动[16-18];(3)1 750—1 500 cm-1:主要来自蛋白质、多肽、氨基酸类物质C=O伸缩振动、N-H弯曲振动[19-20];(4)1 380 cm-1:蛋白质甲基弯曲振动[20-21];(5)1 250 cm-1:核酸中 P = O 伸缩振动[21-23];(6)1 050 cm-1:为糖类C-O-C伸缩振动,糖类在植物体内主要以纤维素、多糖等存在于细胞壁中[21-24]。
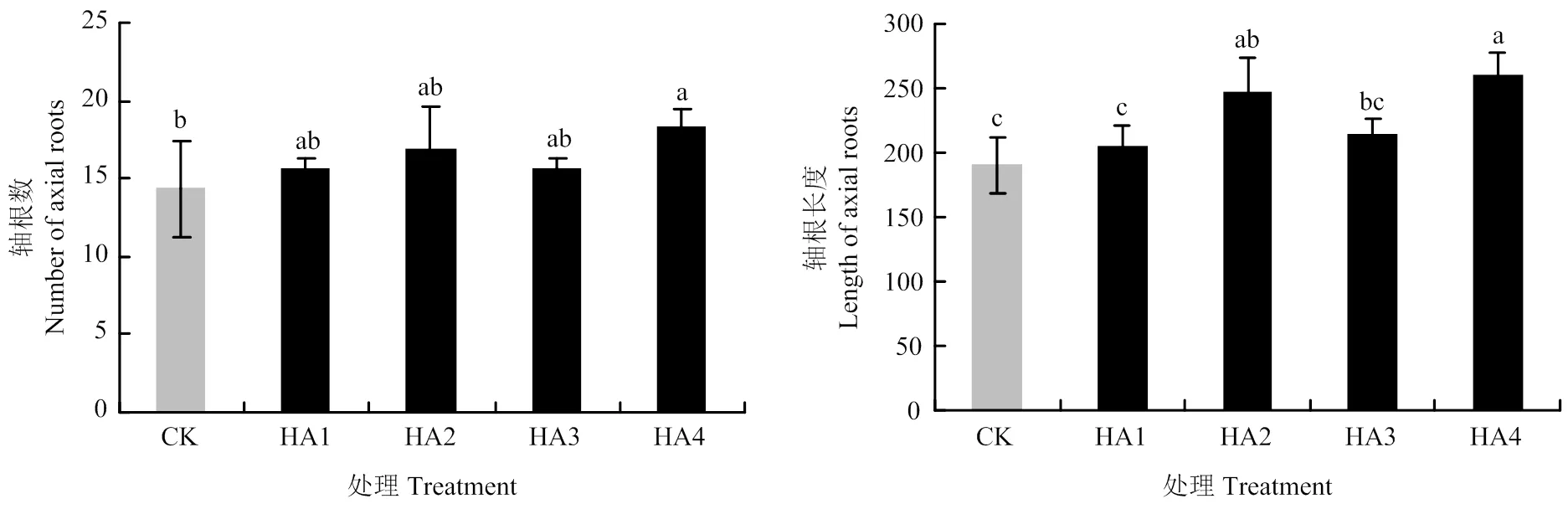
图1 不同用量腐殖酸的玉米轴根数和轴根长度
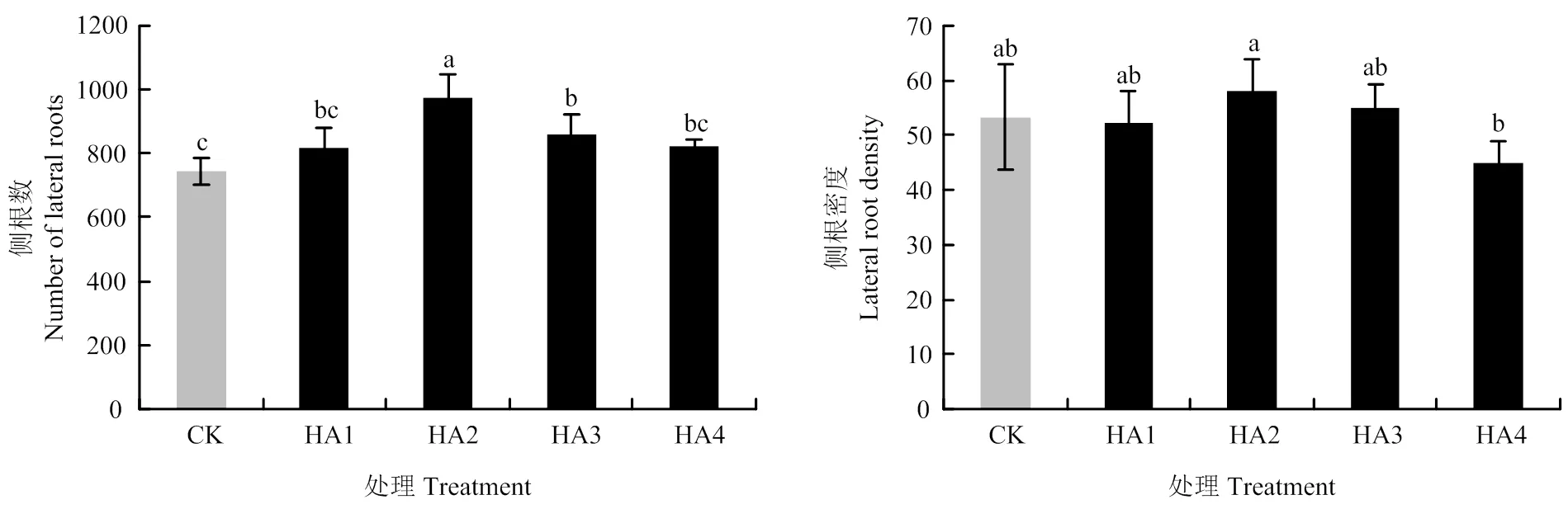
图2 不同用量腐殖酸的玉米侧根数和侧根长度
腐殖酸处理玉米根系在3 420 cm-1、2 920 cm-1、1 735 cm-1、1 380 cm-1和1 050 cm-1波长处的透射率均低于CK,这说明,腐殖酸处理可有效增加玉米根系糖类、碳水化合物、脂类物质、蛋白质、多肽、氨基酸类物质等的含量。其中,在各腐殖酸处理中,HA2处理玉米根系在各波长处的透射率最低。
3 讨论
3.1 腐殖酸对玉米根系生长发育的影响
腐殖酸对植物根系生长有明显的刺激作用。根系作为植物体活跃的吸收器官和合成器官,其生长情况和活力水平直接影响地上部分的生长和营养状况及产量水平[14],腐殖酸可以增加玉米根系的根系活力,以促进玉米对营养物质的吸收利用,维持植物旺盛代谢。腐殖酸处理增加根系与地上部干物质量,这可能与改善了根系形态(表3),扩展了根系的有效吸收空间以及腐殖酸的超分子结构中含有类似生长素的物质有关[25-26],这些物质可接近植物细胞和细胞外的受体,从而增加质子泵的活力,促进有关基因的表达,继而增加侧根出现位点数量[27],诱导侧根生长。在根系伸长区和分化区有很多小的、分布密集的分生组织细胞,它们具有连续的代谢活性并易受腐殖酸的刺激[25],从而促进根系的形成。此外,腐殖酸对植物根系的促进作用,也可能与腐殖酸含有生物活性物质有关。腐殖酸含有多种官能团,具有很高的生物活性,由于超分子结构的存在,有些生物活性物质(可能是生长素类物质)会封存在腐殖质上层结构的异质和移动分子中,这些生物活性物质可以促进根系的生长发育[28]。而且以小分子量物质为主的腐殖酸本身是一种营养物质,更易于为植物吸收利用[3]。
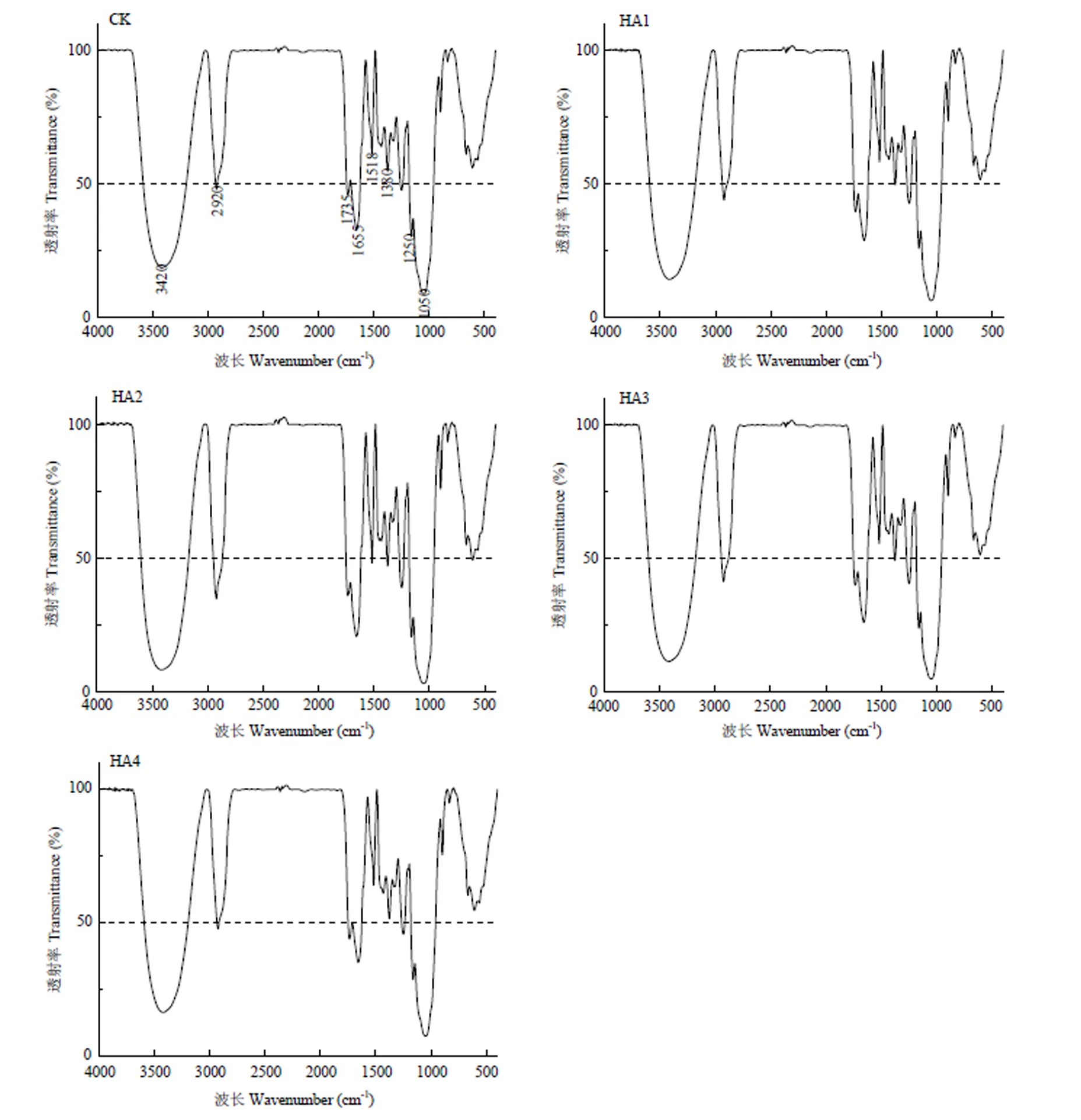
图3 不同用量腐殖酸玉米根系FTIR光谱图
Fig. 3 FTIR spectra of maize roots with different additive amounts of humic acids
此外,腐殖酸作为一种外源添加物,能够通过不同的途径影响植物体的原生代谢和次生代谢过程,以影响根系糖类、碳水化合物、脂类物质、蛋白质、多肽和氨基酸类物质等的含量[29-31]。腐殖酸影响植物体的代谢可通过多种途径发挥作用,其中一个原因是腐殖酸可发挥生物刺激素功能,腐殖酸可以影响根系质膜H+-ATP酶的活性,促进H+泵作用,降低细胞壁的pH值,激活细胞壁上的pH敏感酶和蛋白质,使细胞壁疏松,以使植物生长[32]。
3.2 适宜的浓度是腐殖酸促进玉米根系生长的关键
腐殖酸对植物生长的刺激作用与添加量密切相关,添加量过高,对根系的生长有明显的抑制作用[27]。在本研究中,10 mg C·L-1添加量的风化煤腐殖酸对玉米根系的促进作用最为显著,添加量继续增高,根系干物质量与根系构型改善幅度均开始受到限制,这与薛世川等[33]、GARCÍA等[34]的研究类似。这可能因为,腐殖酸对根系的作用效果除了受浓度的影响,还受官能团、成分、分子量和来源的影响,添加不同量的腐殖酸就伴随引入了不同含量的官能团和成分,腐殖酸对玉米根系作用效果的不同是否归因于官能团和成分的含量仍有待确定。
本研究是在水培环境中开展,而腐殖酸在土壤中的作用效果与水培环境中的异同值得关注。另外,腐殖酸的结构和成分对根系的作用效果影响很大。Malcolm、Mato和Pflug等的研究表明,羧基和羟基官能团可能在决定腐殖物质活性方面起主要作用,同时,虽然腐殖物质的高分子量组分具有残余效果,但是腐殖物质的低分子量组分特别活跃[28,35-36]。Zandonadi等研究了土壤、蚯蚓粪和污泥中腐殖酸对玉米根系的影响,结果发现,其作用效果主要受分子量和聚合程度的影响[25]。腐殖酸结构和成分十分复杂,其对根系的影响可能是正作用和负作用结构/成分的综合效果,深入研究腐殖酸的结构-性质-功能关系,明确起作用的腐殖酸结构及成分,探明其作用机理具有重要的理论和实践意义。
4 结论
添加风化煤腐殖酸可以增加玉米生物量、根冠比、根系活力和根系TTC还原总量,从而促进玉米根系的生长发育,同时,风化煤腐殖酸可以通过增加玉米根系的总根长、总根数量、根体积、根表面积和平均直径改善其根系形态,并增加玉米根系糖类、碳水化合物、脂类物质、蛋白质、多肽、氨基酸类物质等的含量。本试验条件下,添加10 mg C·L-1的腐殖酸对玉米根系生长的促进作用最明显。
[1] 郑平. 煤炭腐植酸的生产和应用. 北京: 化学工业出版社, 1991: 28.
ZHENG P.. Beijing: Chemical Industry Press, 1991: 28. (in Chinese)
[2] 韦良开, 李瑞, 潘杰, 黄兴国. 腐植酸类物质的生物学功能及其在畜禽养殖中的应用. 中国饲料, 2017(14): 10-14.
WEI L K, LI R, PAN J, HUANG X G. Biological function of humic acid substances and its application in livestock production.2017(14): 10-14. (in Chinese)
[3] CANELLAS L P, PICCOLO A, DOBBSS L B, SPACCINI R, OLIVARES F L, ZANDONADI D B, FAÇANHA A R. Chemical composition and bioactivity properties of size fractions separated from a vermicompost humic acid., 2010, 78(4): 457-466.
[4] 李善祥. 我国煤炭腐植酸资源及其利用. 腐植酸, 2002(3): 7-13.
LI S X. China's coal humic acid resources and their utilization., 2002(3): 7-13. (in Chinese)
[5] 文雅, 李东旭. 风化煤腐殖酸在土壤改良中的应用. 科技情报开发与经济, 2010, 20(33): 148-150.
WEN Y, LI D X. The applications of weathered coal humic acid in soil amelioration.2010, 20(33): 148-150. (in Chinese)
[6] TAO Z, YANG Y, SHENG F. Spectroscopic and structural characterization of a fulvic acid from weathered coal., 2008, 49(1/2): 45-56.
[7] MARINO G, RIGHI V, SIMONI A, SCHENETTI L, MUCCI A, TUGNOLI V, MUZZI E, FRANCIOSO O. Effect of a peat humic acid on morphogenesis in leaf explants ofand. Metabolomic analysis at an early stage of regeneration., 2013, 61(21): 4979-4987.
[8] CALVO P, NELSON L, KLOEPPER J W. Agricultural uses of plant biostimulants., 2014, 383(1/2): 3-41.
[9] DOBBSS L B, CANELLAS L P, OLIVARES F L, AGUIAR N O, PERES L E P, AZEVEDO M, SPACCINI R, PICCOLO A, FAÇANHA A R. Bioactivity of chemically transformed humic matter from vermicompost on plant root growth., 2010, 58(6): 3681-3688.
[10] MAGGIONI A, VARANINI Z, NARDI S, PINTON R. Action of soil humic matter on plant roots: Stimulation of ion uptake and effects on (Mg2++K+) ATPase activity., 1987, 62(87): 355-363.
[11] AZCONA I, PASCUAL I, AGUIRREOLEA J, FUENTES M, GARCÍA-MINA J M, SÁNCHEZ-DÍAZ M. Growth and development of pepper are affected by humic substances derived from composted sludge., 2011, 174(6): 916-924.
[12] MORA V, BACAICOA E, ZAMARRENO A M, AGUIRRE E, GARNICA M, FUENTES M, GARCÍA-MINA J M. Action of humic acid on promotion of cucumber shoot growth involves nitrate-related changes associated with the root-to-shoot distribution of cytokinins, polyamines and mineral nutrients., 2012, 167(8): 633-642.
[13] GARCIA-MINA J M. Stability, solubility and maximum metal binding capacity in metal–humic complexes involving humic substances extracted from peat and organic compost., 2006, 37(12): 1960-1972.
[14] 毛达如, 申建波. 植物营养研究方法. 北京: 中国农业大学出版社, 2011.
MAO D R, SHEN J B.. Beijing: China Agricultural University Press, 2011. (in Chinese)
[15] 赵世杰, 刘华山, 董新纯. 植物生理学实验指导. 北京: 中国农业科技出版社, 1998.
ZHAO S J, LIU H S, DONG X C.. Beijing: China Agricultural Science and Technology Press, 1998. (in Chinese)
[16] DZIUBA B, BABUCHOWSKI A, NAŁĘCZ D, NIKLEWICZ M. Identification of lactic acid bacteria using FTIR spectroscopy and cluster analysis.2007, 17(3): 183-189.
[17] JACKSON M. Biomembrane structure from FTIR spectroscopy.1993, 15: 53-69.
[18] WILLIAMS D H, FLEMING I.London: McGraw-Hill, 1996.
[19] SALZMANN D, HANDLEY R, MULLER-SCHARER H. Functional significance of triazine-herbicide resistance in defence ofagainst a rust fungus.2008, 9(5): 577-587.
[20] 孙素琴, 周群, 陈建波. 中药红外光谱分析与鉴定. 北京: 化学工业出版社, 2010.
SUN S Q, ZHOU Q, CHEN J B.Beijing: Chemical Industry Press, 2010. (in Chinese)
[21] NELSON W H. Modern Techniques for Rapid Microbiological Analysis//Modern Techniques for Rapid Microbial Analysis. Wiley & Sons, 1991: 75-76.
[22] ZEROUAL W, CHOISY C, DOGLIA S M, BOBICHON H, ANGIBOUST J F, MANFAIT M. Monitoring of bacterial growth and structural analysis as probed by FT-IR spectroscopy., 1994, 1222(2): 171-178.
[23] 陆婉珍. 现代近红外光谱分析技术. 北京: 中国石化出版社, 2000.
LU W Z.. Beijing: China Petrochemical Press, 2000. (in Chinese)
[24] WONG P T, WONG R K, CAPUTO T A, GODWIN T A, RIGAS B. Infrared spectroscopy of exfoliated human cervical cells: evidence of extensive structural changes during carcinogenesis., 1991, 88(24):10988-10992.
[25] ZANDONADI D B, CANELLAS L P, FAçANHA A R. Indolacetic and humic acids induce lateral root development through a concerted plasmalemma and tonoplast H+pumps activation., 2007, 225(6): 1583-1595.
[26] RÜCK A, PALME K, VENIS M A, NAPIER R M, FELLE H H. Patch‐clamp analysis establishes a role for an auxin binding protein in the auxin stimulation of plasma membrane current inprotoplasts., 1993, 4(1): 41-46.
[27] CANELLAS L P, OLIVARES F L, OKOROKOVAFAÇANHA A L, FAÇANHA A R. Humic acids isolated from earthworm compost enhance root elongation, lateral root emergence, and plasma membrane H+-ATPase activity in maize roots., 2002, 130(4):1951-1957.
[28] MALCOLM R E, VAUGHAN D. Effects of humic acid fractions on invertase activities in plant tissues., 1979, 11(1): 65-72.
[29] NARDI S, MUSCOLO A, VACCARO S, BAIANO S, SPACCINI R, PICCOLO A. Relationship between molecular characteristics of soil humic fractions and glycolytic pathway and krebs cycle in maize seedlings., 2007, 39(12): 3138-3146.
[30] CANELLAS L P, BALMORI D M, MÉDICI L O, AGUIAR, N O, CAMPOSTRINI E, ROSA R C, FAÇANHA A R, OLIVARES F L. A combination of humic substances andinoculation enhances the growth of maize (L.).2013, 366(1/2): 119-132.
[31] ERTANI A, FRANCIOSO O, TUGNOLI V, RIGHI V, NARDI S. Effect of commercial lignosulfonate-humate onL. metabolism., 2011, 59(22): 11940-11948.
[32] HAGER A. Role of the plasma membrane H+-ATPase in auxin-induced elongation growth: historical and new aspects., 2003, 116(6): 483-505.
[33] 薛世川, 刘秀芬, 邓景华. 施用腐植酸复合肥对小麦抗旱防衰能力的影响及其机理. 中国生态农业学报, 2006(1): 139-141.
XUE S C, LIU X F, DENG J H. Effect and mechanism of humic acid compound fertilizer on the drought and senility-resistant ability of wheat.2006(1): 139-141. (in Chinese)
[34] GARCÍA A C, SOUZA L G A D, PEREIRA M G, CASTRO R N, GARCÍAMINA J M, ZONTA E, LISBOA F J G, BERBARA R L L. Structure-property-function relationship in humic substances to explain the biological activity in plants., 2016, 6: 20798.
[35] MATO M C, OLMEDO M G, MENDEZ J. Inhibition of indoleacetic acid-oxidase by soil humic acids fractionated on sephadex., 1972, 4(4): 469-473.
[36] PFLUG W, ZIECHMANN W. Inhibition of malate dehydrogenase by humic acids.1981, 13(4): 293-299.
Response of Maize Roots to Different Additive Amounts of Weathered Coal Humic Acids
ZHOU LiPing, YUAN Liang, ZHAO BingQiang, LI YanTing, LIN ZhiAn
(Institute of Agricultural Resources and Regional Planning, Chinese Academy of Agricultural Sciences/Key Laboratory of Plant Nutrition and Fertilizer, Ministry of Agriculture and Rural Affairs, Beijing 100081)
【Objective】Weathered coal humic acid possesses abundant reserves in China, which has multiple active functional groups. The response of roots to humic acid, which acts as a humic acid acting on the first contact organ of plant, is the initial motive force to promote plant growth. Hence researching the effect of humic acid on the growth and development of maize roots is of significance for crops’ production increase and quality improvement, and can provide a theoretical basis for the effective utilization of weathered coal resource of China.【Method】Zhengdan958 maize cultivar was used as the tested cultivar, and Hogland nutrient solution hydroponics was adopted in this experiment. When maize seedlings grew to two leaves and one terminal bud, they were moved to the hydroponic basin for one day for readaption time. Then, the effect of applying different concentrations of humic acid (0, 5, 10, 15, and 20 mg C·L-1) on the growth of maize biomass, root-shoot ratio, root systematic architecture and root nutrient were studied. 【Result】 (1) Humic acids could significantly increase the root dry weight, shoot dry weight, root-shoot ratio, root activity, and root TTC reducing amount of maize roots. Compared with the control treatment (0 humic acid), the average value of the above indicators with humic acid treatment increased by 42.31%, 19.33%, 18.18%, 46.54%, and 81.01%, respectively. (2) Humic acid could improve the root morphology of maize roots by increasing root length, root number, root volume, root surface area, and average diameter of the maize roots. Compared with the control, the average value of the total root length, total root number, root volume, root surface area and average diameter of maize with humic acid treatment increased by 13.51%, 16.74%, 69.62%, 14.68%, and 49.28%, respectively. (3) The addition of humic acid increased the number of axial roots, length of axial roots and number of lateral roots in maize roots. The average value above of maize roots with the addition of humic acids increased by 16.28%, 21.65% and 16.80%, respectively, compared with the control treatments. (4) The promoting effect of humic acid on the growth of maize roots showed the tread of first increase and then decrease with the increasing additive amount of humic acid. When the medium concentration was 10 mg C/L, the promotion effect on maize roots was the most significant. Compared with the control, the root dry weight and root activity of maize roots increased by 69.36% and 69.07%, respectively. (5) The addition of humic acids (10 mg C·L-1) could increase the content of carbohydrates, lipids, proteins, peptides, amino acids, and nucleic acids in maize roots. 【Conclusion】The addition of humic acid could significantly increase the biomass, root activity and root-shoot ratio of maize. In addition, it could also improve the root architecture of the maize and the content of main chemical components in maize roots. The medium concentration (10 mg C·L-1) of humic acid had the most significant effect on the promotion of maize roots.
humic acid; maize; root; weathered coal; additive amount
10.3864/j.issn.0578-1752.2019.02.008
2018-09-10;
2018-10-25
“十三五”国家重点研发计划项目(2016YFD0200402)
周丽平,E-mail: zhoulipingcaas@126.com。通信作者赵秉强,E-mail: zhaobingqiang@caas.cn
(责任编辑 李云霞)
