脂肪酸环氧化酶SlEPX转基因大豆的表型分析
2019-01-28郝青婷张飞吉夏洁薛金爱李润植
郝青婷,张飞,吉夏洁,薛金爱,李润植
脂肪酸环氧化酶转基因大豆的表型分析
郝青婷,张飞,吉夏洁,薛金爱,李润植
(山西农业大学分子农业与生物能源研究所,山西太谷 030801)
【目的】植物源环氧化脂肪酸(epoxy fatty acids,EFAs)是生产高值化工产品的优异可再生原材料。EFAs仅在一些野生植物种子中高水平合成和积累,难以规模化利用。通过在普通油料作物大豆((L.) Merr.)发育种子中组装环氧化脂肪酸合成途径,以期实现这类珍稀脂肪酸(unusual fatty acids,UFAs)的商业化绿色生产。【方法】通过构建琉璃菊()脂肪酸环氧化酶(,)基因种子特异表达载体,基于体细胞胚发生的粒子轰击法对大豆(cv. Jack)进行遗传转化,经连续选择和鉴定,获得表型稳定的高代转基因大豆株系。分别运用PCR和实时荧光定量PCR检测外源基因的整合及在大豆发育种子中的表达谱。统计分析转基因大豆籽粒形态和大小、百粒重以及种子萌发率等表型,应用气相色谱和凯氏定氮法测试种子油脂和蛋白等相关生理生化特性。【结果】外源基因稳定整合于大豆基因组,且能在高代转基因大豆发育种子中正确有效表达。转基因大豆种子新合成积累了2.9%的EFAs,相应的亚油酸(18﹕2Δ9,12)含量减低8%。与对照相比,转基因大豆种子变长,表皮多皱褶。种子大小测量显示,转基因大豆小粒种子(粒径<4 mm)占比明显增加。转基因与对照大豆的种子发芽率无明显差异,然而转基因植株生长缓慢。转基因大豆种子油脂含量、蛋白质含量和百粒重分别减少5%、6%和8.28%。进一步生化分析发现,转基因大豆新合成的EFAs,绝大部分结合于卵磷脂(phosphatidylcholine,PC,占12.6%)分子,仅少量结合于甘油三酯(triacylglycerol,TAG,占2.3%)。这些数据表明在转基因大豆种子中,外源SlEPX酶能正确催化亚油酸(18﹕2Δ9,12)生成环氧化脂肪酸即斑鸠菊酸(vernolic acid,Va)(12-epoxy-18﹕1Δ9)。但是,绝大多数斑鸠菊酸积累于构成细胞膜的主要成分PC分子中,而没有转移整合进入贮藏的TAG分子。大量新合成的斑鸠菊酸结合于PC分子可能损伤宿主细胞膜稳态和生理反应,导致转基因大豆产生不利表型。【结论】在大豆发育种子中单独表达外源脂肪酸环氧化酶,能催化合成少量EFAs,但同时产生一些不利表型。在转基因大豆种子中共表达或,既可实现环氧化脂肪酸在TAG中富集,同时还能消除环氧化脂肪酸在细胞膜中的积累及其所导致的负效应。
大豆;环氧化脂肪酸;环氧化酶;转基因大豆;表型分析
0 引言
【研究意义】油料作物的种子不仅是食用油的主要来源,亦是日益重要的可再生优质原料,用于生物柴油和各种油脂化工品的商业化生产[1-2]。普通油料作物的种子油包含5种常见的脂肪酸﹕棕榈酸(16﹕0)、硬脂酸(18﹕0)、油酸(18﹕1Δ9)、亚油酸(18﹕2Δ9,12)和亚麻酸(18﹕3Δ9,12,15),这些脂肪酸已广泛应用于食品和其他工业。然而,很多未商业化的野生植物种子能合成和高水平积累一些稀有脂肪酸(unusual fatty acids,UFAs),如羟化脂肪酸、环氧化脂肪酸、乙炔酸脂肪酸和共轭脂肪酸等[3]。它们是油漆、涂料、黏合剂、增塑剂等化工产品的可再生优质原材料,具有独特的商业价值[4]。例如,蓖麻(L.)种子中积累的蓖麻油酸高达总脂的90%[5],斑鸠菊()和琉璃菊()种子中的环氧化脂肪酸的含量约为总脂的80%[6-7]。但是,由于这些植物存在种子小、产量低、可种植地理区域有限等不良农艺性状,使得这些稀有脂肪酸难以商业化生产以满足工业化应用的需求。因此,越来越多的研究聚焦于使用基因工程手段在普通油料作物种子中组装这些UFA的合成途径,以期实现规模化生产。大豆是中国及世界主要栽培油料作物之一,全球种植广泛,面积大,产量高[8]。大豆油的产量是世界植物油总产量的30%[9]。近年来由于生物柴油的兴起,大豆作为一种优质的生物燃油工业原料也成为研究热点之一。自2010年栽培大豆和野生型大豆基因组序列相继问世以来[10],在基因水平改造大豆的技术越来越成熟,研究周期也大幅缩短,有助于人类选育更符合要求的大豆品种。【前人研究进展】已有一些研究聚焦于在大豆种子中组装相关油脂合成途径,建立利用普通油料作物种子为平台,以期商业化生产各种高值珍稀脂肪酸。例如,棕榈油酸(16﹕1Δ9)是一种高值健康型珍稀脂肪酸,大豆种子不能合成这种脂肪酸,但含有它的前体物质棕榈酸(16﹕0)。表达源于哺乳动物的CoA-Δ9脱氢酶基因可使大豆种子棕榈酸的一半转化成棕榈油酸,含量达10%,而棕榈酸含量则从25% 降低到5%[11]。山西农业大学李润植课题组与美国肯塔基大学Hildebrand实验室先前合作研究从一种平菇()中分离到CoA-Δ9脱氢酶基因,用种子特异启动子驱动该基因在大豆体细胞胚中表达,获得棕榈油酸含量高达14%的转化体[12]。长链ω-3多不饱和脂肪酸EPA (20﹕5)和DHA(22﹕6)是人类必须从食物中获取的健康型脂肪酸,普通油料作物种子不能合成。Kinney等[13]在大豆种子中成功组装了EPA和DHA合成途径,共表达7个相关基因(Δ6脱氢酶、Δ6延长酶、Δ15脱氢酶和Δ17脱氢酶等),转基因种子含EPA和DHA分别达20%和2.3%。环氧化脂肪酸(epoxy fatty acids,EFAs)是在酰基链上的单个或多个位置处含有跨越相邻碳原子的氧桥,使得它们具有高反应性并易于交联,用于多种高值化工品的生产[14-16]。工业上,植物油脂可经一系列化学反应生成各种环氧化脂肪[17-18]。相关研究表明,EFAs的生物合成是由2种类型的脂肪酸环氧化酶(P450型-环氧化酶和FAD2型-环氧化酶)催化的。脂肪酸环氧化酶以亚油酸(18﹕2Δ9,12)为底物,催化其碳链上Δ12位置处的双键加入一个氧原子,生成具有1个氧桥和一个双键的环氧化脂肪酸(12-epoxy-18﹕1Δ9),即斑鸠菊酸(Vernolic acid,Va)[19-20]。将来自于大戟属植物的P450型-环氧化酶基因在大豆体细胞胚中表达,体细胞胚可合成8% Va[21]。将来自还阳参属植物的FAD2型-环氧化酶基因(2)在拟南芥种子中表达,Va合成积累达6.2%[22]。2表达也可使棉花种子中Va积累达8.3%[23]。【本研究切入点】前期研究已从高积累Va的琉璃菊()发育种子中分离到编码FAD2型-环氧化酶的[24],并通过转基因拟南芥()验证了SlEPX催化合成Va的酶活性。进一步构建了种子特异表达载体,采用基于体细胞胚的粒子轰击法对大豆进行遗传转化,获得种子特异表达大豆转化体材料[25],但转基因遗传稳定性、表型及相关生理生化特征还未详尽鉴定。【拟解决的关键问题】本研究经连续选择获得表型一致、遗传稳定的高代转基因大豆株系,重点鉴定和解析该基因种子特异表达所导致的大豆籽粒不利表型材料以及产生不利表型的分子机理。探讨转基因大豆种子出现负效应的机制,以及进一步提高转基因种子合成积累环氧化脂肪酸和减少负效应的基因工程策略。
1 材料与方法
1.1 试验材料
试验所用目的基因来自高积累环氧化脂肪酸的琉璃菊()的环氧化酶基因(GenBank accession,AY462108,1 137 bp),种子特异表达载体pCAMBIA1301含有种子特异性菜豆蛋白(Phaseolin)启动子驱动目的基因表达盒及潮霉素(Hyg)抗性基因选择标记。转基因受体种质材料为大豆Jack品种。经过基于体细胞胚发生的粒子轰击法进行大豆遗传转化。经连续跟踪选择鉴定获得第六代遗传稳定、表型一致的纯合转基因株系。
试验于2012年至2018年在山西农业大学进行,所有转化载体和转基因大豆材料保存于山西农业大学分子农业与生物能源研究所。
1.3 叶片DNA提取及PCR
田间种植非转基因Jack品种大豆、空载体转化大豆对照及环氧化酶转基因的第六代大豆株系。在植株生长处于幼嫩时期,采用传统的CTAB法分别提取Jack及转基因大豆的顶端嫩叶的DNA,以大豆Jack品种的非转基因植株基因组为阴性对照、表达载体DNA为阳性对照,用特异性引物进行PCR扩增(表1),PCR产物经琼脂糖凝胶电泳检测,确定为转基因的植株挂牌标记,便于后期取样。
1.4 种子总RNA提取及荧光定量PCR
分别提取转基因植株叶片及3个发育时期(大豆植株开花后7、20和35 d)的种子样品,按照RNA提取试剂盒说明书提取总RNA,并反转录合成cDNA。进行实时荧光定量PCR反应,用Primer 5.0软件设计引物(表1),以为内参基因,参照GenStar说明书配置荧光定量PCR体系,每个样品6个重复,反应程序为95℃10 min;95℃15 s;60℃1 min,40个循环。
1.5 SlEPX转基因种子3个发育时期TAG含量及脂肪酸成分的测定
分别将早期(开花后12—15 d)、中期(25—35 d)、晚期(45 d)的Jack及转基因种子研磨成粉末,并称取10 mg样品置于干燥玻璃试管中。参照张玲慧[26]方法进行油脂和甲酯化的分析。甲酯化脂肪酸样品置于GC瓶中,-20℃保存用于气相检测。使用安捷伦7890B气相色谱仪检测TAG中脂肪酸的成分和含量,色谱柱型号为:HP-88,阶梯升温程序为:140℃保持5 min,然后以2℃·min-1的速率上升至210℃,最后保持12.5 min;FID的温度保持250℃。
1.6 斑鸠菊酸(Va)在SlEPX转基因大豆种子不同脂类分子中的含量测定
将转基因大豆成熟风干的种子充分研磨,称取适量样品,加入氯仿﹕甲醇(2﹕1)混匀,离心后吸出底部的氯仿相,浓缩至50—100 µL后,通过薄层层析(thin-layer chromatography,TLC)将细胞内不同类别的脂类分开,2次的展开剂分别为氯仿﹕甲醇﹕水(65﹕25﹕4)和正己烷﹕乙醚﹕乙酸(100﹕100﹕2)。将薄层板上的样品条带刮下转移到带玻璃纤维的吸管中,用氯仿﹕甲醇洗脱2次,将脂类样品用氮气吹干后加入甲醇钠进行甲酯化反应。甲酯化的样品用于GC分析。
1.7 SlEPX转基因大豆种子总脂含量测定
称取50 mg野生型Jack和转基因大豆成熟风干的种子粗粉末,3个重复,加入石英砂充分研磨,先后分2次加入7.5 mL甲醇﹕氯仿(2﹕1),置于37℃的摇床分别抽提24 h,离心后收集上层有机相合并。加入5 mL氯仿、9 mL 1%的NaCl溶液,使得氯仿﹕甲醇﹕H2O为2﹕2﹕1.8,混匀后8 000 r/min离心10 min,收集下层有机相,氮气吹干后计算脂肪酸的总重量。计算方法:总脂含量=[(提取后总重)-(提取前管重)]/0.05。
1.8 SlEPX转基因大豆发芽率、种子形态、百粒重及蛋白含量的检测
百粒重测定:利用分析天平对非转基因大豆Jack和转基因大豆进行百粒重测定,至少6次重复。
发芽率测定:分别选取非转基因大豆Jack和转基因大豆150粒种子,放入铺有专用发芽滤纸的培养皿内,50粒/皿,各设3个重复。置于20℃—25℃培养箱内,发芽率测定期间,保持滤纸湿润。以胚根突破种皮,长度达到种子长度的1/2作为发芽标准,从培养的第2天开始统计发芽数量,并将每天发芽的种子移出培养皿,直到再无种子萌发为止。计算方法:发芽率=(发芽种子总数)/(供试种子总数)×100%。
形态学观察:利用体式显微镜对非转基因大豆Jack和转基因大豆的成熟种子进行形态学观察。
种子籽粒大小统计:随机选取转基因和空载体、非转基因对照种子样品,用一系列不同孔径的筛子将不同大小种子分开。分别统计各孔径大小的种子所占比例,至少6次重复。
蛋白含量检测:采用凯氏定氮法测定蛋白质含量,至少6次重复。
所有设置重复的数据(脂肪酸含量、总脂含量、百粒重、发芽率及蛋白质含量)均使用SPSS软件进行检验统计分析。
2 结果
2.1 高代转基因大豆材料靶基因SlEPX整合及表达鉴定
以非转基因大豆Jack(负对照)、转基因大豆的叶片基因组及表达载体质粒DNA(阳性对照)为模板进行PCR扩增结果(图1)表明,对照Jack植株基因组中未扩增出环氧化酶片段,转基因大豆基因组和表达载体质粒DNA中分别扩增出大小一致的目的条带(1 137 bp),证明目的基因依然稳定整合在所检测的高代转基因大豆基因组中。

表1 引物序列
通过对各样品进行实时荧光定量PCR检测(图2),目的基因在转基因大豆种子3个不同发育时期均有表达,但在叶片中没有表达,表明目的基因在种子中特异表达。在发育种子中的表达水平呈现标准的抛物线型增长,中期表达量最高,早期和晚期表达量低,并且中期的表达量是其他2个时期的2—3倍。这表明在高代转基因大豆中,主要在转基因大豆种子发育中期稳定有效表达,而此时期正是大豆种子油脂高速积累期。
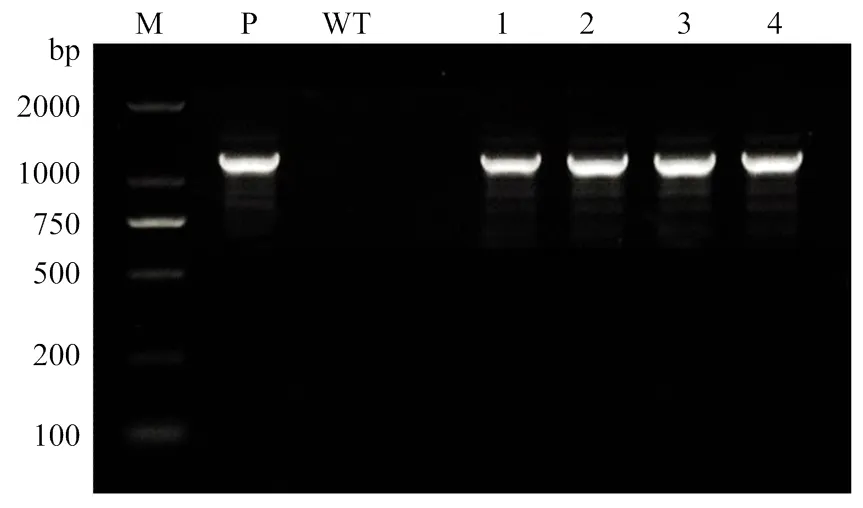
M:Marker;WT:非转基因Jack植株;P:SlEPX表达载体质粒DNA;1—4:SlEPX转基因大豆株系
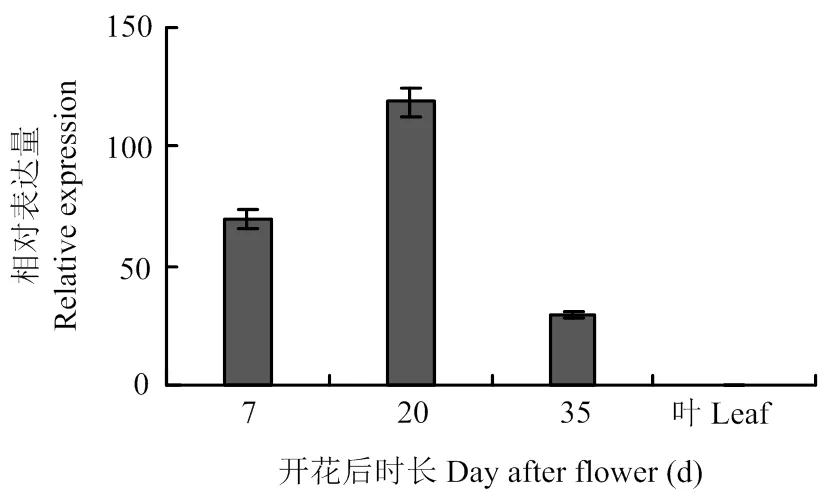
图2 大豆种子不同发育时期SlEPX的表达分析
2.2 SlEPX转基因大豆种子油脂肪酸成分分析
为检测转入大豆的编码的脂肪酸环氧化酶是否能催化合成斑鸠菊酸(Va)以及是否对其他脂肪酸合成产生影响,运用气相色谱分析转基因种子和非转基因对照种子不同发育时期样品种子油脂肪酸成分,结果(图3)显示,非转基因大豆Jack和转基因大豆TAG中主要脂肪酸成分包括棕榈酸(16﹕0)、硬脂酸(18﹕0)、油酸(18﹕1)、亚油酸(18﹕2)和亚麻酸(18﹕3)。转基因大豆TAG中含有极少量的斑鸠菊酸(Va),仅占TAG总量的2.9%。与非转基因大豆(空载体转化体表型和非转基因大豆表型一致,下同)相比,在转基因大豆种子油脂中其他5种主要脂肪酸含量发生了明显的变化。在种子发育中期和后期,转基因种子油中亚油酸(18﹕2)含量显著降低,亚麻酸(18﹕3)含量亦相应减少。然而,油酸(18﹕1)含量却增加。亚油酸(18﹕2)含量显著减少,说明转入的编码的环氧化酶正确行使功能,即以亚油酸(18﹕2Δ9,12)为底物,在Δ12位置的双键处插入氧原子,生成斑鸠菊酸(Va)(12-epoxy-18﹕1Δ9)。亚油酸是亚麻酸的前体物质,亚油酸减少必然导致亚麻酸含量减低。油酸(18﹕1)含量的升高,可能是导入的FAD-型环氧化酶(SlEPX)部分干扰了大豆本身正常的FAD2催化油酸生成亚油酸的功能。
2.3 SlEPX转基因大豆种子新合成的斑鸠菊酸在不同脂类分子中的分布
为解析转基因大豆种子油中斑鸠菊酸(Va)积累量较少的机理,应用TLC对从种子萃取的总脂质样品进行层析分离,分别收集TAG和PC脂质分子样品,甲酯化后进行GC分析。结果(图4)显示,转基因大豆TAG和PC脂质分子均含有16﹕0、18﹕0、18﹕1、18﹕2、18﹕3和Va 6种脂肪酸。Va在TAG中的含量仅为2.3%,比例远远低于在PC分子中的含量(12.6%)。与此不同的是,在Va高积累的斑鸠菊和琉璃菊种子中,绝大部分Va分布在TAG分子中。
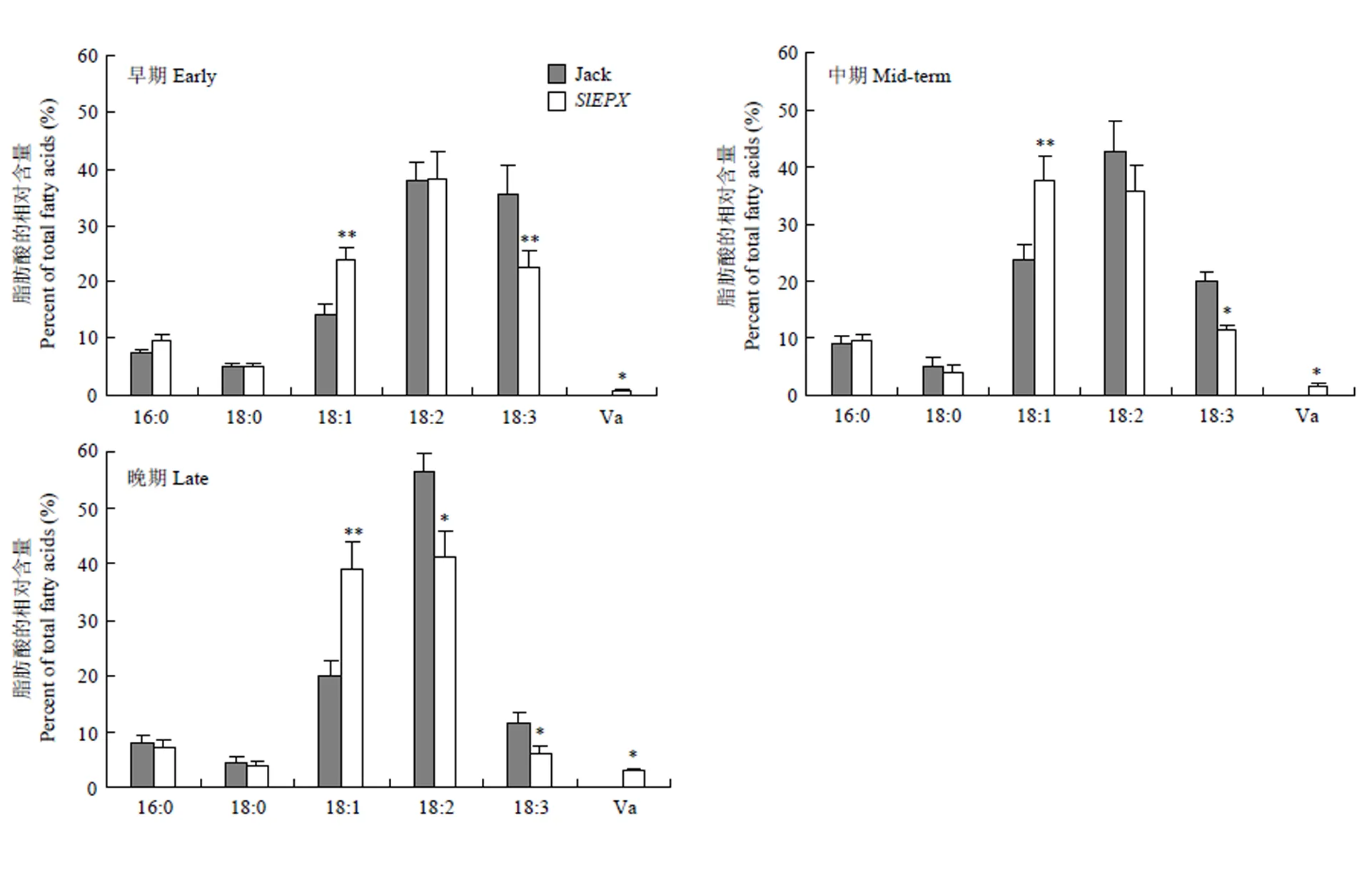
**和*分别表示在p<0.01和p<0.05水平差异极显著。下同
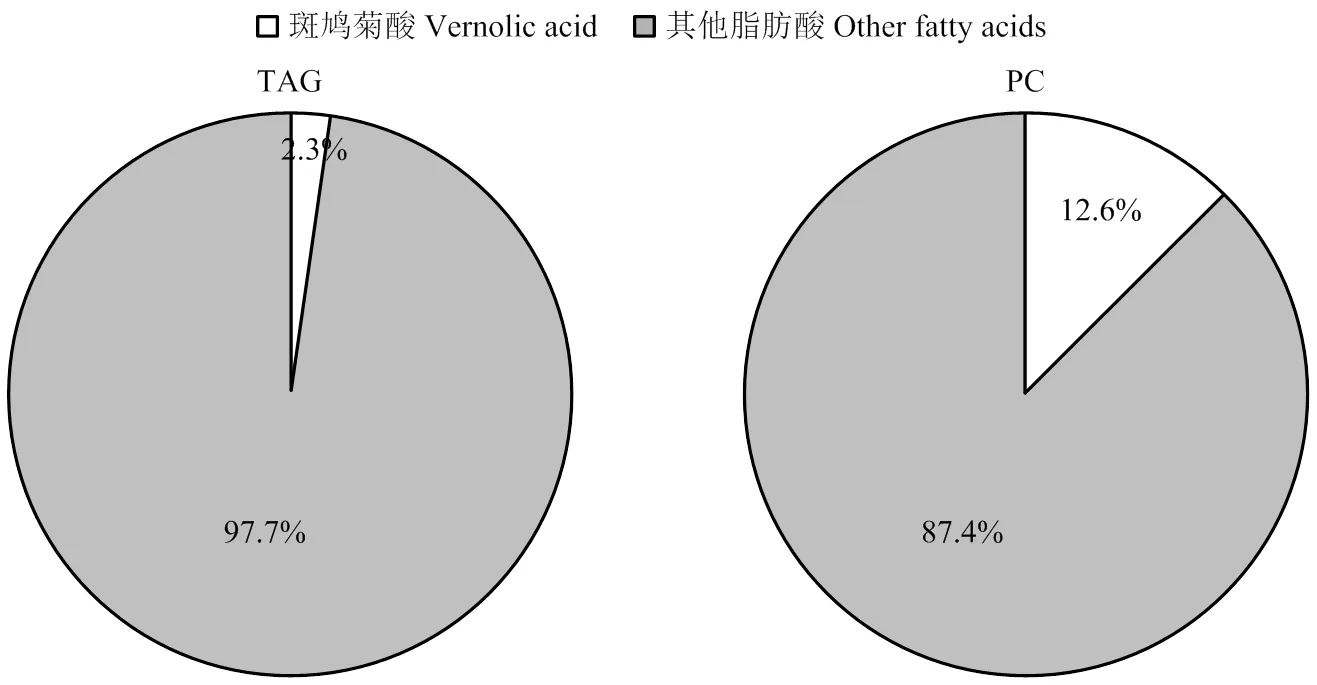
图4 SlEPX转基因大豆种子中斑鸠菊酸(Va)在TAG和PC脂质分子中的分布
2.4 SlEPX转基因对大豆总脂含量和蛋白含量的影响
为分析种子特异表达是否对大豆种子贮藏物积累产生影响,分别测试了非转基因大豆Jack和转基因大豆种子总脂含量和蛋白含量(图5),野生大豆Jack的总脂含量占其种子干重的21.06%,转基因大豆的总脂含量比对照降低了5%左右,仅为其种子干重的16.84%。与非转基因大豆相比,转基因大豆种子蛋白含量亦降低,且比对照下降了6%左右。显然,转基因对大豆种子油脂和蛋白贮藏物积累构成负效应。
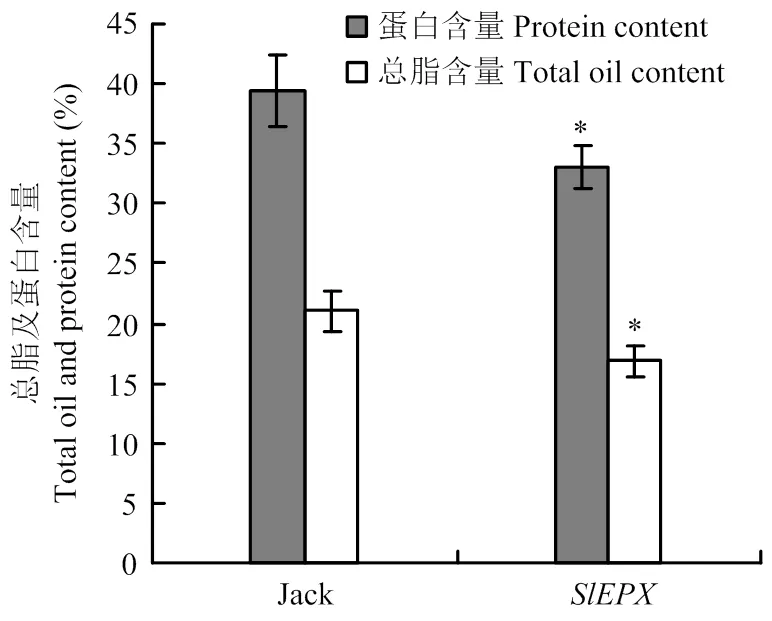
图5 SlEPX转基因大豆种子总脂和总蛋白质含量
2.5 SlEPX转基因对大豆百粒重、发芽率和种子其他表型的影响
为分析种子特异表达是否对大豆种子其他 农艺性状产生影响,分别测试了非转基因大豆Jack和转基因大豆种子的百粒重、发芽率、种子形态及植株表型差异(图6),转环氧化酶基因的大豆植株矮小,种子表皮皱缩,种子变长。转基因种子百粒重比对照Jack种子减轻8.28%。对照和转基因大豆种子发芽率没有显著差异,均高达93%—96%。与对照相比,转基因大豆种子粒径<4 mm的种子所占比例明显增加。表明仅导入和种子特异表达脂肪酸环氧化酶基因,尽管能新合成一定量的高值脂肪酸Va,但也导致种子表皮皱缩、总脂和蛋白含量及百粒重减低等不良表型。这些不利农艺性状的产生可能与在大豆种子中新合成的Va未能有效从PC分子转移整合到TAG分子有关。因为Va在非原宿主细胞中产生、并主要积累在构成细胞膜系统的PC分子中,可能影响到细胞一些正常功能。
3 讨论
3.1 异源表达催化珍稀脂肪酸合成酶的表型效应
一些野生植物种子合成积累的环氧化脂肪酸、羟化脂肪酸和共轭脂肪酸等珍稀脂肪酸(unsaturated free fatty acids,UFAs)可加工成油漆、黏合剂等多种化工产品,具有极其重要的商业应用价值[4,27],一些环氧化脂肪酸还可应用于临床医学[28-29]。现今,已从能高水平合成此类脂肪酸的非农业植物中分离到多种负责合成UFAs的关键酶基因[30]。相关研究利用这些优异基因,在传统油料作物(品种产量高、种植管理技术成熟)种子中组装特殊脂肪酸的合成途径[31]。这样所培育的工程油料作物及其推广种植,就可以实现低成本生产可再生和环境友好型工业用油原料,进而替代传统的不可再生的石油资源[32]。例如,早在1998年已从斑鸠菊和琉璃菊等植物发育种子中克隆到脂肪酸环氧化酶基因[33-34],并将这些基因转入拟南芥中,拟南芥种子合成并积累了近10%的环氧化脂肪酸[35]。在烟草愈伤中过表达源于大戟属植物的环氧化酶基因,使烟草中积累了15%的Δ12-环氧化脂肪酸[21]。这些研究均展示了利用普通油料作物种子为平台可持续生产高值特异脂肪酸的发展前景。

A:种子的发芽率;B:种子的百粒重;C:转基因(右)和非转基因(左)大豆种子形态;D:种子大小(粒径);E:转基因(左)和非转基因(右)大豆植株
本文对高代转基因大豆材料种子籽粒表型分析揭示了异源种子特异表达,可使大豆种子新合成积累一定量的环氧化脂肪酸Va,但也导致一些不利表型。例如,与非转基因品种Jack相比,转基因大豆油脂总量占种子干重的比例下降了5%,蛋白质含量下降了6%,百粒重也降低了8.28%,种子变得狭长且表皮皱缩。这些性状的变化均说明单独表达对大豆的生理生化活动造成了不良的影响。类似的现象曾在转基因拟南芥研究中报道,单独表达脂肪酸环氧化酶基因导致转基因拟南芥种子不能正常发芽和生长发育受损等问题[35]。单独表达催化羟化脂肪酸(蓖麻酸)合成的脂肪酸羟化酶基因的拟南芥[36]及表达α-桐酸合成基因的大豆体细胞胚亦出现负效应[37-38]。这些报道和本文研究结果均表明异源特殊脂肪酸的合成积累会影响宿主种子的代谢和生理。一些研究显示,蓖麻酸在异源内质网上合成而不能有效转运储藏于油体,就会诱导质体中乙酰-CoA羧化酶活性的翻译后抑制,从而抑制脂肪酸合成和总油脂积累[39]。本文研究发现转基因大豆新合成的Va大部分结合在PC分子(12.6%)上,而在TAG分子中极少。新合成珍稀脂肪酸Va大量分布在膜脂PC分子中,势必影响到宿主细胞的生命活动,进而导致大豆种子产生一些不利表型。
3.2 在普通油料作物种子中组装珍稀油脂合成途径的基因工程优化策略
对斑鸠菊和琉璃菊发育种子中斑鸠菊酸合成积累研究发现,结合在TAG分子而储藏于油体的斑鸠菊酸含量可高达50%—80%[6-7],相反,结合于细胞膜PC分子中的斑鸠菊酸极少。这表明,这些原产斑鸠菊酸的植物经长期进化,细胞形成了独特机制,能高效地将脂肪酸环氧化酶催化合成的结合于PC的斑鸠菊酸转移整合到TAG分子而储存于油体中。DGAT(二酰基甘油酰基转移酶)和PDAT(磷脂二酰甘油酰基转移酶)是控制TAG合成的最后一步酰化反应的限速酶,它们能将CoA分子结合的酰基或PC分子上sn-2位置的酰基链转移到DAG(二酰甘油)分子的sn-2位置而合成TAG分子。立体化学分析证实,斑鸠菊酸等特异脂肪酸合成后就结合在PC的sn-2位置。显然,原产这些珍稀脂肪酸的植物细胞存在能特异识别这些珍稀脂肪酸酰基、并将其从PC分子转移整合到TAG分子中的酰基转移酶(DGAT和PDAT等)。这在异源植物种子中组装原产于蓖麻的蓖麻酸合成途径相关研究得到证实。例如,在拟南芥种子中特异性表达蓖麻酸羟化酶(RcFAH)时,种子新合成羟化脂肪酸(蓖麻酸),但是含量低,仅占种子油的17%,且大多数分布在细胞膜PC分子上[40-41]。与野生型拟南芥种子相比,转的拟南芥种子油脂含量下降。将来自蓖麻发育种子或与共表达,转基因拟南芥的油脂含量接近在蓖麻种子的水平,新合成的羟化脂肪酸含量分别上升至27%和30%[42-43]。山西农业大学李润植课题组与美国肯塔基大学Hildebrand实验室先前合作研究发现高积累环氧化脂肪酸Va的斑鸠菊、琉璃菊发育种子中的DGAT对Va有底物特异性,能有效将Va-酰基转移到TAG分子中[44]。然而,大豆本身的DGAT对环氧化脂肪酸酰基没有底物选择性[45]。本研究检测的转基因大豆种子虽然合成了Va,但在TAG中仅有2.3%左右,相反在PC中的Va的高达12.6%。推测转大豆种子中Va含量低且在TAG分子积累少的原因是大豆本身缺少像斑鸠菊或琉璃菊能特异高效将环氧化脂肪酸酰基从CoA或PC转入TAG的DGAT或PDAT等相关酶。据此,我们提出在大豆种子中组装环氧化脂肪酸合成途径的优化策略,即在种子特异表达环氧化酶SlEPX大豆种子中,进一步共表达来自斑鸠菊的或以及其他相关基因,能够将结合于CoA及PC分子中的Va酰基有效转移到TAG分子中,大幅提高Va在种子油中的积累量。同时,消除新合成积累的Va对细胞伤害,进而培育获得富含环氧化脂肪酸且其他农艺性状优良的大豆新种质,为这些高值珍稀脂肪酸的规模化绿色生产和应用奠定基础。
4 结论
种子特异表达异源脂肪酸环氧化酶(SlEPX)可使大豆种子合成环氧化脂肪酸即斑鸠菊酸(Va),但含量低且有负效应。在转基因大豆种子中共表达或,可实现大幅提高Va在种子油中的积累量,并消除Va积累于细胞膜所导致的不利表型。
[1] NAPIER J A, GRAHAM I A. Tailoring plant lipid composition: designer oilseeds come of age., 2010, 13(3): 329-336.
[2] WILSON R F, HILDEBRAND D. Engineering status, challenges and advantages of oil crops., 2010: 209-259.
[3] VAN DE LOO F J, FOX B G, Somerville C. Unusual fatty acids//.Boca Raton: CRC Press,1993: 91-126.
[4] JAWORSKI J, CAHOON E B. Industrial oils from transgenic plants., 2003, 6(2): 178-184.
[5] 孙振钧, 吕丽媛, 伍玉鹏. 蓖麻产业发展: 从种植到利用. 中国农业大学学报, 2012, 17(6): 204-214.
SUN Z J, LüL Y, WU Y P. Castor industry development: from cultivation to product exploitation., 2012, 17(6): 204-214. (in Chinese)
[6] PERDUE R E. Vernonia-bursting with potential., 1989, 70: 11-13.
[7] THOMPSON A E, DIERIG D A, KLEIMAN R. Variation inflowering characteristics, seed oil and vernolic acid contents., 1994, 3(3):175-183.
[8] 路子显. 论大豆进口与我国粮食质量安全. 粮食问题研究, 2017(1): 4-9.
Lu Z X. Soybean import and grain quality and safety in China., 2017(1): 4-9. (in Chinese)
[9] 李擎天, 牛素玲, 陈受宜, 张劲松. 植物种子油脂积累的转录调控及在大豆中的研究进展. 大豆科学, 2013, 32(1): 124-129, 132.
LI Q T, NIU S L, CHEN S Y, ZHANG J S. Transcriptional regulation of seed oil accumulation and current advances in soybean research., 2013, 32(1): 124-129, 132. (in Chinese)
[10] SCHMUTZ J, CANNON S B, SCHLUETER J, MA J, MITROS T, NELSON W, HYTEN D L, SONG Q, THELEN J J, CHENG J, XU D, HELLSTEN U, MAY G D, YU Y, SAKURAI T, UMEZAWA T, BHATTACHARYYA M K, SANDHU D, VALLIYODAN B, LINDQUIST E, PETO M, GRANT D, SHU S, GOODSTEIN D, BARRY K, FUTRELL-GRIGGS M, ABERNATHY B, DU J, TIAN Z, ZHU L, GILL N, JOSHI T, LIBAULT M, SETHURAMAN A, ZHANG X C, SHINOZAKI K, NGUYEN H T, WING R A, CREGAN P, SPECHT J, GRIMWOOD J, ROKHSAR D, STACEY G, SHOEMAKER R C, JACKSON S A. Genome sequence of the palaeopolyploid soybean., 2010, 463(7278): 178-183.
[11] LIU W, TORISKY R S, MCALLISTER K P, AVDIUSHKO S, HILDEBRAND D, COLLINS G B. A mammalian desaturase gene lowers saturated fatty acid levels in transgenic soybean embryos., 1996, 47: 33-42.
[12] 岳爱琴, 孙希平, 李润植. 食用植物油脂的代谢工程. 植物生理与分子生物学学报, 2007, 33(6): 489-498.
YUE A Q, SUN X P, LI R Z. Metabolic engineering of edible vegetable oils., 2007, 33(6): 489-498. (in Chinese)
[13] KINNEY A J, CAHOON E B, DAMUDE H G, HITZ W D, LIU Z B, KOLAR C W. Production of very long chain polyunsaturated fatty acids in oil seed plants: US, US 8084074 B2[P]. 2011.
[14] CAHOON E B, OHLROGGE J B. Metabolic evidence for the involvement of a [delta]4-palmitoyl- acyl carrier protein desaturase in petroselinic acid synthesis in coriander endosperm and transgenic tobacco cells., 1994, 104(3): 827-837.
[15] CARLSSON A S. Plant oils as feedstock alternatives to petroleum-a short survey of potential oil crop platforms., 2009, 91(6): 665-670.
[16] DAI S, PETRUCCELLI S, ORDIZ M I, ZHANG Z, CHEN S, BEACHY R N. Functional analysis of RF2a, a rice transcription factor., 2003, 278(38): 36396-36402.
[17] XIA W, BUDGE S M. Simultaneous quantification of epoxy and hydroxy fatty acids as oxidation products of triacylglycerols in edible oils., 2018, 1537: 83-90.
[18] ZHANG X, WAN X, CAO H, DEWIL R, DENG L, WANG F, TAN T, NIE K. Chemo-enzymatic epoxidation offatty acids catalyzed with. 99-125 lipase in a solvent-free system., 2017, 98: 10-18.
[19] BAFOR M, SMITH M A, JONSSON L, STOBART K, STYMNE S. Biosynthesis of Vernoleate (cis-2-epoxyoctadeca-cis-9-enoate) in microsomal preparations from developing endosperm of., 1993, 303(1): 145-151.
[20] LIU L, HAMMOND E G, NIKOLAU B J.studies of the biosynthesis of vernolic acid in the seed of., 1998, 33(12): 1217-1221.
[21] CAHOON E B, RIPP K G, HALL S E. Transgenic production of epoxy fatty acids by expression of a cytochrome P450 enzyme fromseed., 2002, 128(2): 615-624.
[22] LEE M, LENMAN M, BANAŚ A, BAFOR M, SINGH S, SCHWEIZER M, NILSSON R, LILJENBERG C, DAHLQVIST A, GUMMESON P O, SJÖDAHL S, GREEN A, STYMNE S. Identification of non-hemediiron proteins that catalyze triple bond and epoxy group formation., 1998, 280(5365): 915-918.
[23] ZHOU X R, SINGH S, LIU Q, GREEN A. Combined transgenic expression of D12-desaturase and D12-epoxygenase in high linoleic acid seeds leads to increased accumulation of vernolic acid., 2006, 33(6): 585-592.
[24] HATANAKA T, SHIMIZU R, HILDEBRAND D. Expression of aepoxygenase gene., 2004, 65(15): 2189-2196.
[25] LI R Z, YU K S, WU Y M, TATENO M, HATANAKA T, HILDEBRAND D F. Vernoniacan complement the disrupted oil and protein metabolism in epoxygenase-expressing soybean seeds., 2012, 14(1): 29-38.
[26] 张玲慧. 紫苏种子油脂代谢及限速酶基因的表达分析[D]. 太谷: 山西农业大学, 2014.
ZHANG L H. Study on the lipid metabolism in seeds and expression pattern of the rate-limiting enzyme geneof Perilla[D]. Taigu: Shanxi Agricultural University, 2014. (in Chinese)
[27] CAHOON E B, SHOCKEY J M, DIETRICH C R, GIDDA S K, MULLEN R T, DYER J M. Engineering oilseeds for sustainable production of industrial and nutritional feedstocks: solving bottlenecks in fatty acid flux., 2007, 10(3): 236-244.
[28] EL-SAYED R. Synthesis of an Efficiency Heterocyclic Systems, Surface Properties and Potential Pharmacological Interest., 2018, 67(8): 991-1003.
[29] ROY J, WATSON J E, HONG I S, FAN T M, DAS A. Antitumorigenic Properties of Omega-3 Endocannabinoid Epoxides., 2018, 61(13): 5569-5579.
[30] SPECTOR A A, KIM H Y. Cytochrome P450 epoxygenase pathway of polyunsaturated fatty acid metabolism., 2015, 1851(4): 356-365.
[31] HASLAM R P, SAYANOVA O, KIM H J, CAHOON E B, NAPIER J A. Synthetic redesign of plant lipid metabolism., 2016, 87(1): 76-86.
[32] FURUHASHI T, NAKAMURA T, FRAGNER L, ROUSTAN V, SCHON V, WECKWERTH W. Biodiesel and poly-unsaturated fatty acids production from algae and crop plants a rapid and comprehensive workflow for lipid analysis., 2016, 10: 1262-1267.
[33] BLEE E. Biosynthesis of phytooxylipins: the Peroxygenase pathway., 1998, 100(4/5): 121-127.
[34] HITZ W D. Fatty acid modifying enzymes from developing seeds of:US, US 5846784A[P]. 1998.
[35] SINGH S, THOMAEUS S, LEE M, STYMNE S, GREEN A. Transgenic expression of a D12-epoxygenase gene inseeds inhibits accumulation of linoleic acid., 2001, 212(5): 872-879.
[36] BROWSE J A, SHOCKEY J M, BURGAL J J. Enhancement of hydroxy fatty acid accumulation in oilseed plants: EP, US 8101818[P]. 2012.
[37] CAHOON E B, DIETRICH C R, MEYER K, DAMUDE H G, DYER J M, KINNEY A J. Conjugated fatty acids accumulate to high levels in phospholipids of metabolically engineered soybean andseeds., 2006, 67(12): 1166-1176.
[38] CAHOON E B, RIPP K G, HALL S E, KINNEY A J. Formation of conjugated delta 8,delta 10-double bonds by delta 12-oleic-acid desaturase-related enzymes: biosynthetic origin of calendic acid., 2001, 276(4): 2637-2643.
[39] BATES P D, JOHNSON S R, CAO X, LI J, NAM J W, JAWORSKI J G, OHLROGGE J B, BROWSE J. FA synthesis is inhibited by inefficient utilization of unusual FAs for glycerolipid assembly., 2014, 111(3): 1204-1209.
[40] BROUN P, SOMERVILLE C. Accumulation of ricinoleic, lesquerolic, and densipolic acids in seeds of transgenicplants that express a fatty acyl hydroxylase cDNA from castor bean., 1997, 113 (3): 933-942.
[41] LU C F, FULDA M, WALLIS J G, BROWSE J. A high-throughput screen for genes from castor that boost hydroxy fatty acid accumulation in seed oils of transgenic., 2006, 45(5): 847-856.
[42] ERP H V, BATES P D, BURGAL J, SHOCKEY J, BROWSE J. Castor phospholipid: diacylglycerol acyltransferase facilitates efficient metabolism of hydroxy fatty acids in transgenic., 2011, 155(2): 683-693.
[43] BURGAL J, SHOCKEY J, LU C F, DYER J, LARSON T, GRAHAM I, BROWSE J. Metabolic engineering of hydroxy fatty acid production in plants:drives dramatic increases in ricinoleate levels in seed oil., 2008, 6(8): 819-831.
[44] LI R Z, YU K S, HILDEBRAND D F.,andexpression in seeds and other tissues of epoxy and hydroxy fatty acid accumulating plants., 2010, 45(2): 145-157.
[45] LI R Z, HATANAKA T, YU K S, WU Y M, FUKUSHIGE H, HILDEBRAND D. Soybean oil biosynthesis: role of diacylglycerol acyltransferases., 2013, 13(1): 99-113.
Phenotypic analysis of epoxygenase-transgenic soybeans
HAO QingTing, ZHANG Fei, JI XiaJie, XUE JinAi, LI RunZhi
(Institute of Molecular Agriculture and Bioenergy, Shanxi Agricultural
【Objective】Epoxy fatty acids (EFAs) derived from plants are renewable materials for production of high-valued chemical products. Such unusual fatty acids (UFAs) are only highly synthesized and accumulated in some wild plant seeds, with difficult in utilization on a large scale. This study was conducted to assembly epoxy fatty acid biosynthesis pathway in developing seeds of soybean ((L.) Merr) for commercial production of these unusual fatty acids. 【Method】In this paper,, an epoxygenase gene from(a high accumulator of EFAs)was cloned into pCAMBIA1301 expression vector driven by a seed-specific promoter. Soybean (cv. Jack) was genetically transformed using the particle bombardment method based on somatic embryogenesis system. The high-generation lines of-transgenic soybean with stable phenotypes were obtained by continuous selection and identification. The integration of heterologousgene and its expression profiles were examined by PCR and Real-time quantitative PCR, respectively. Seed phenotypic examinations were statistically analyzed including seed morphology, size, 100-seed weight and germination rate. Seed oil and protein contents and other physiological properties were measured by gas chromatography and Kjeldahl method. 【Result】The results showed thatgene was stably integrated into soybean genome, with its accurate and effective expression in developing seeds of high-generation soybeans. EFAs were newly synthesized but low content (2.9%) in-transgenic soybean seeds, and linoleic acid (18﹕2Δ9,12)was accordingly reduced by 8%. Compared to the control, the transgenic soybean seeds were a little longer and wrinkled seed coat. The percentage of small seeds (diameter <4mm) was increased significantly in the transgenic soybean. Seed germination rate had no difference between transgenic and control whereas the transgenic plant exhibited slow growth. The oil and protein content as well as 100-seed weight of transgenic soybean seeds were reduced by 5%, 6% and 8.28%, respectively. Further biochemical analysis demonstrated that newly-synthesized vernolic acid (one kind of EFAs) in the transgenic seeds mostly bound to phosphatidylcholine (PC) (12.6% of total fatty acid) while only a small amount existed in triacylglycerol (TAG) (2.3%). These data indicated that heterologous SlEPX enzyme did correctly catalyze oleic acid (18﹕2Δ9,12) to vernolic acid (Va)(12-epoxy-18﹕1Δ9) in the transgenic soybean seeds. However, most of Va molecules were accumulated in PC (the major cell membrane lipid) but not in storage TAG. A large amount of Va bound to PC could damage cell membrane homeostasis, causing unfavorable phenotypes in transgenic soybeans. 【Conclusion】The present study revealed that the overexpression of a heterologous epoxygenase alone in soybean developing seeds can catalyze biosynthesis of EFAs at small amount, but results in some undesirable agronomy traits. It is needed to further co-express the acyltransferase that can specifically transfer the Va-acyl group from PC into TAG molecules in-transgenic soybean for enriching epoxy fatty acids in TAG and simultaneously, to eliminate negative effect caused by EFA accumulation in cell membrane.
L.; epoxy fatty acids; epoxygenase; transgenic soybean; phenotype analysis
10.3864/j.issn.0578-1752.2019.02.001
2018-07-13;
2018-10-11
国家自然科学基金(31401430)、国家“948”计划(2014-Z39)、山西省煤炭重点科技攻关项目(FT-2014-01)、山西省重点研究发展计划重点项目(201603D312005)、山西省留学基金委研究项目(2015-064)
郝青婷,E-mail:957108583@qq.com。张飞,E-mail:18235445421@163.com。郝青婷和张飞为同等贡献作者。通信作者李润植,E-mail:rli2001@126.com
(责任编辑 李莉)
