黄淮海夏玉米主产区茎腐病主要病原菌及优势种分析
2019-01-28刘树森马红霞郭宁石洁张海剑孙华金戈
刘树森,马红霞,郭宁,石洁,张海剑,孙华,金戈
黄淮海夏玉米主产区茎腐病主要病原菌及优势种分析
刘树森,马红霞,郭宁,石洁,张海剑,孙华,金戈
(河北省农林科学院植物保护研究所/农业部华北北部作物有害生物综合治理重点实验室/河北省农业有害生物综合防治工程技术研究中心,河北保定 071000)
【目的】明确黄淮海夏玉米主产区玉米茎腐病的主要病原菌组成及优势种,为病原菌致病机制、抗性育种及茎腐病防治提供依据。【方法】于2014—2017年采集黄淮海夏玉米主产区3个省(河北、河南、山东)的玉米茎腐病样本850份。通过形态学、通用引物和特异引物对病组织分离物进行鉴定,并采用上述引物直接检测病组织。整合分析分离物鉴定法和组织分子检测法的结果以确定玉米茎腐病的主要病原菌及优势种;分析主要病原菌在各省间以及同一省份不同年度的检出率,揭示主要病原菌的种群动态变化;分析单个样本中病原菌的检出率,探讨多种病原菌的共存模式。【结果】有667份样本检测出真菌或卵菌,占总样本的78.47%;年度间样本检出率存在差异,2014年的检出率不足50%,而2015—2017年的检出率相近,均高于90%。在所有样本中共检出20属46种真菌或卵菌,其中镰孢菌(spp.)的检出率最高,为89.96%,包括禾谷镰孢复合种(species complex)、层出镰孢()、拟轮枝镰孢()、厚垣镰孢()、亚粘团镰孢()、尖镰孢()、黄色镰孢()、藤仓镰孢()、变红镰孢()木贼镰孢()和茄镰孢()11个种;腐霉菌(spp.)的检出率为34.18%,包括芒孢腐霉()、禾生腐霉()、棘腐霉()、孤雌腐霉()和寡雄腐霉()5个种。拟轮枝镰孢、禾谷镰孢复合种、芒孢腐霉和层出镰孢为4种主要病原菌,检出率依次为62.07%、46.93%、29.09%和28.04%,其中拟轮枝镰孢为优势种。各省之间,上述4种主要病原菌的检出率存在一定差异。拟轮枝镰孢在河北省的检出率为73.98%,明显高于该菌在河南省和山东省的检出率;禾谷镰孢复合种在3个省的检出率相近;层出镰孢和芒孢腐霉在山东省的检出率分别为35.78%和34.31%,均高于在其他两省的检出率。同一省份不同年度上述4种主要病原菌的检出率呈动态变化,其中任何一种病原菌均有可能上升为优势种。进一步分析表明,单个样本中可以检测出一种或多种病原菌,检测出1种菌的样本占38.38%,检出2种和3种病原菌的样本分别占29.24%和19.04%;2种及以上病原菌共存以镰孢菌和腐霉菌、镰孢菌和镰孢菌模式为主。【结论】黄淮海夏玉米主产区茎腐病主要病原菌为拟轮枝镰孢、禾谷镰孢复合种、芒孢腐霉和层出镰孢,其中拟轮枝镰孢为优势种;拟轮枝镰孢在河北省的检出率最高,层出镰孢和芒孢腐霉在山东省的检出率最高,禾谷镰孢复合种在3个省的检出率相近;单个样本中存在多种病原菌共存的模式。
玉米茎腐病;黄淮海地区;病原菌检测;优势种;镰孢菌;腐霉菌
0 引言
【研究意义】黄淮海夏玉米区是指收获小麦后播种玉米的区域,包括河南省和山东省的全部、河北省中南部、安徽省和江苏省北部、山西省南部和陕西省东南部地区,种植面积在1 000万公顷左右[1],主产区为河南省、山东省和河北省。玉米茎腐病是该区域的重要病害,自2013年起连续多年发生,发病重的年份部分品种亩产仅有250 kg,损失高达60%以上,严重影响玉米生产。茎腐病的防治以种植抗性品种和种子包衣为主,两种防治技术的研究和推广均建立在病原菌的研究基础上。因此,明确黄淮海夏玉米主产区茎腐病主要病原菌的种类及其组成,对病害的防控具有重要意义。【前人研究进展】已报道玉米茎腐病的病原菌有20余种[2],这些病原菌单独或复合侵染导致玉米茎腐病的发生,优势病原菌则因年份、地理环境和气候的差异而有所不同。国内在20世纪80年代末至2000年初是茎腐病病原菌研究的高峰期,随后日趋减少。我国茎腐病主要病原菌为镰孢菌(spp.)和腐霉菌(spp.)[3]。已明确为病原菌的镰孢菌有禾谷镰孢()、拟轮枝镰孢()、层出镰孢()[4]、腐皮镰孢()、木贼镰孢()、镰状镰孢()[5]、串珠镰孢中间变种(var.)、半裸镰孢()[6]、藤仓镰孢()、厚垣镰孢()、尖镰孢()[7]、黄色镰孢()[8]、变红镰孢()[9]、亚粘团镰孢()[10]、同色镰孢()[11]等;腐霉菌为肿囊腐霉()禾生腐霉()、瓜果腐霉()、强雄腐霉()、寡雄腐霉()和棘腐霉()等[12]。在黄淮海夏玉米主产区,罗畔池等认为20世纪90年代引起河北省玉米茎腐病的主要病原菌为串珠镰孢、禾谷镰孢和腐霉菌[13-14],而石洁[15]认为禾谷镰孢和串珠镰孢是主要病原菌。徐作珽等[16]认为20世纪80年代山东省茎腐病病原菌以瓜果腐霉为主,其与禾谷镰孢形成复合侵染;张艺铭[17]于2014年分离鉴定了山东省84份典型茎腐病株的病原菌,认为主要为瓜果腐霉和禾谷镰孢。袁虹霞等研究表明,河南省2009—2012年度茎腐病的优势病原菌为禾谷镰孢[18-21]。何婧[22]于2008—2009年共分离鉴定了河北、山东和河南34点次的病样,其中16点次分离到了腐霉菌,32点次分离到了镰孢菌,镰孢菌以禾谷镰孢和拟轮枝镰孢为主。上述研究结果基于对病组织分离物进行形态学和分子生物学鉴定,但样本采集时期以及分离过程中诸多因素常常影响分离结果[22],进而影响鉴定结果。马红霞等[23]采用病原菌的通用引物和特异性引物,以病组织基因组DNA为模板,直接检测病组织中的病原菌,同时对分离物进行鉴定,整合分析两种方法的检测结果,在一定程度上提高了检测的灵敏度和结果的准确性。【本研究切入点】黄淮海区域内有关玉米茎腐病病原菌的研究较少,且大部分年代久远,结论分歧也较大[16,24-25]。已有研究仅为部分省内病原菌的检测结果,而以整个黄淮海夏玉米主产区茎腐病病原菌为对象的研究尚未见报道。【拟解决的关键问题】采用分离物鉴定和组织分子检测相结合的方法,对2014—2017年黄淮海夏玉米主产区的玉米茎腐病样本进行病原菌检测,以期明确该区域的主要病原菌,为玉米茎腐病抗病育种和病害综合治理提供依据。
1 材料与方法
1.1 茎腐病样本采集与处理
2014—2017年,共采集茎腐病样本850份。采集地点涉及黄淮海夏玉米主产区3个省的154个县,具体为河北省(26县141份)、河南省(62县419份)、山东省(66县290份)。
马铃薯葡萄糖琼脂培养基(PDA):马铃薯200 g、葡萄糖20 g、琼脂粉20 g,蒸馏水定容至1 L,高温高压灭菌20 min,备用。玉米粉琼脂培养基(CMA):玉米粉30 g、琼脂粉17 g,蒸馏水定容至1 L,高温高压灭菌20 min,备用。
参考马红霞等[23]的方法进行样本处理:采集玉米茎腐病发病初期植株,在田间采用70%的酒精棉擦拭茎基部,并将其在酒精灯火焰上掠过进行表面灭菌。用无菌手术刀纵剖茎秆为两半,通过观察排除细菌性茎腐病后,首先切取一侧髓部病健交界处组织放到1.5 mL离心管中,液氮保存;然后切取另一侧髓部相同部位的组织分别放置在准备好的PDA和CMA平板培养基上,每皿4块,常温培养,待采样结束返回实验室后及时将分离物纯化,并于4℃保存待用。
1.2 病原菌鉴定
分离物鉴定法:参照《真菌鉴定手册》[26]和《中国真菌志-青霉属及其相关有性型属》[27],依据菌落形态和分生孢子的大小及形态特征等对纯化的分离物进行形态学鉴定;并以真菌基因组DNA快速提取试剂盒(北京艾德莱生物科技有限公司)提取的分离物DNA作为模板,采用真菌、镰孢菌和卵菌的通用引物以及镰孢菌的种特异性引物进行PCR扩增,对分离物进行分子生物学鉴定。组织分子检测法[23]:使用CTAB植物基因组DNA快速提取试剂盒(北京艾德莱生物科技有限公司)提取玉米髓部组织的基因组DNA,并使用上述引物进行PCR扩增。所用引物如表1所示,由北京诺赛基因组研究中心有限公司合成。PCR扩增体系及反应程序参考孙华等[28]的方法。25 μl PCR反应体系:DNA 2.0 μl,10 μmol·L-1上游引物和下游引物各0.5 μl,2×MasterMix 12.5 μl,补ddH2O至25 μl。PCR反应程序:95℃预变性5 min;95℃变性1 min,退火30 s(各引物退火温度如表1所示),72℃延伸45 s,进行35个循环;72℃延伸10 min,4℃保存PCR产物。PCR产物经1%的琼脂糖凝胶电泳,阳性产物由北京诺赛基因组研究中心进行测序,测序结果在NCBI网站上进行BLAST比对。
1.3 检测结果分析
将分离物鉴定法和组织分子检测法检测的结果相结合,任何一种方法从样本中检出某种真菌或卵菌即判定该样本携带该菌。检出率(%)=(某一真菌或卵菌检出样本数量/检出真菌和卵菌的样本总量)×100。
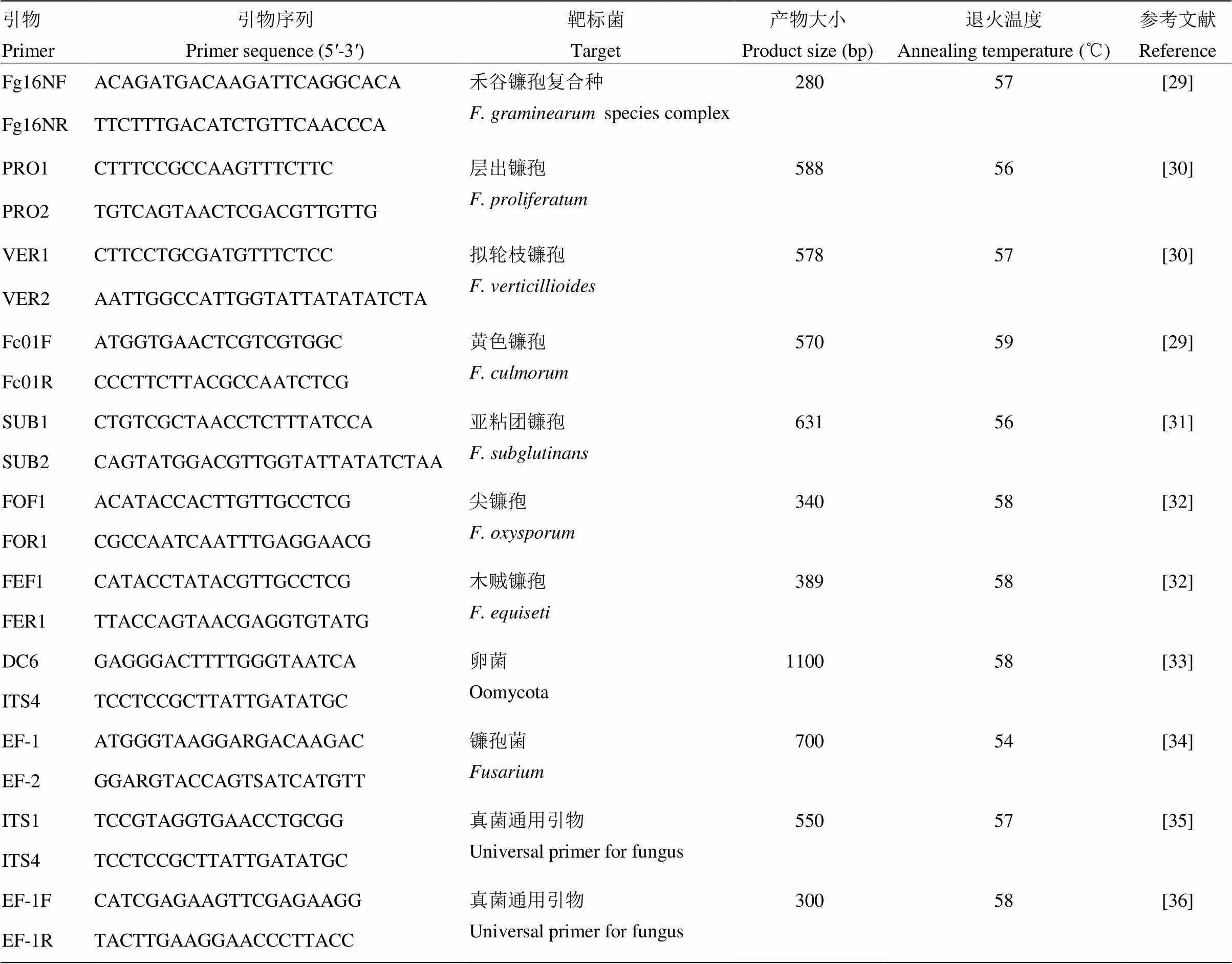
表1 本研究使用的引物
2 结果
2.1 真菌或卵菌的检出情况及主要病原菌
采用分离物鉴定和组织分子检测两种方法,在2014—2017年采集的850份茎腐病样本中,共有667份检测出真菌或卵菌,检出率为78.47%;年度间的检出率差异较大,2014年度的检出率不足50%,而2015—2017年的检出率相近,均高于90%。检出的真菌或卵菌涉及20属46种。其中,镰孢菌普遍存在于各地区样本中,检出率为89.96%,在检出的11个种中拟轮枝镰孢、禾谷镰孢复合种和层出镰孢的检出率依次为62.07%、46.93%和28.04%;腐霉菌的检出率为34.18%,芒孢腐霉()的检出率最高,为29.09%;其余各属检出率在0.15%—5.70%。所有11种镰孢菌和除孤雌腐霉以外的4种腐霉菌均为明确的茎腐病病原菌。其中,拟轮枝镰孢、禾谷镰孢复合种、层出镰孢和芒孢腐霉(另文发表)是本区域4种主要的病原菌;其他几种病原菌的检出率较低,说明在田间只有少量或极少量玉米植株被这些病原菌侵染,为不常见病原菌。此外,两种检测方法的效果存在差异,分离物鉴定法能检测出20属44种菌,而组织分子检测法仅能检测出9属22种菌,但组织分子检测法对上述4种主要病原菌的检出率明显高于分离物鉴定法(表2)。
2.2 主要病原菌在省份和年度间的差异
在各省之间,拟轮枝镰孢、禾谷镰孢复合种、层出镰孢和芒孢腐霉4种主要病原菌的检出率均存在一定差异(表3)。拟轮枝镰孢在河北省的检出率为73.98%,明显高于在河南省和山东省的检出率;禾谷镰孢复合种在3个省的检出率相近;层出镰孢在山东省的检出率为35.78%,高于在其他两省的检出率;芒孢腐霉在山东省和河南省的检出率相近,分别为34.31%和30.00%,明显高于该菌在河北省的检出率。拟轮枝镰孢在各省内均处于优势地位,其次为禾谷镰孢复合种;层出镰孢在河北省的检出率略高于芒孢腐霉,河南省与之相反,山东省两种菌的检出率相近。
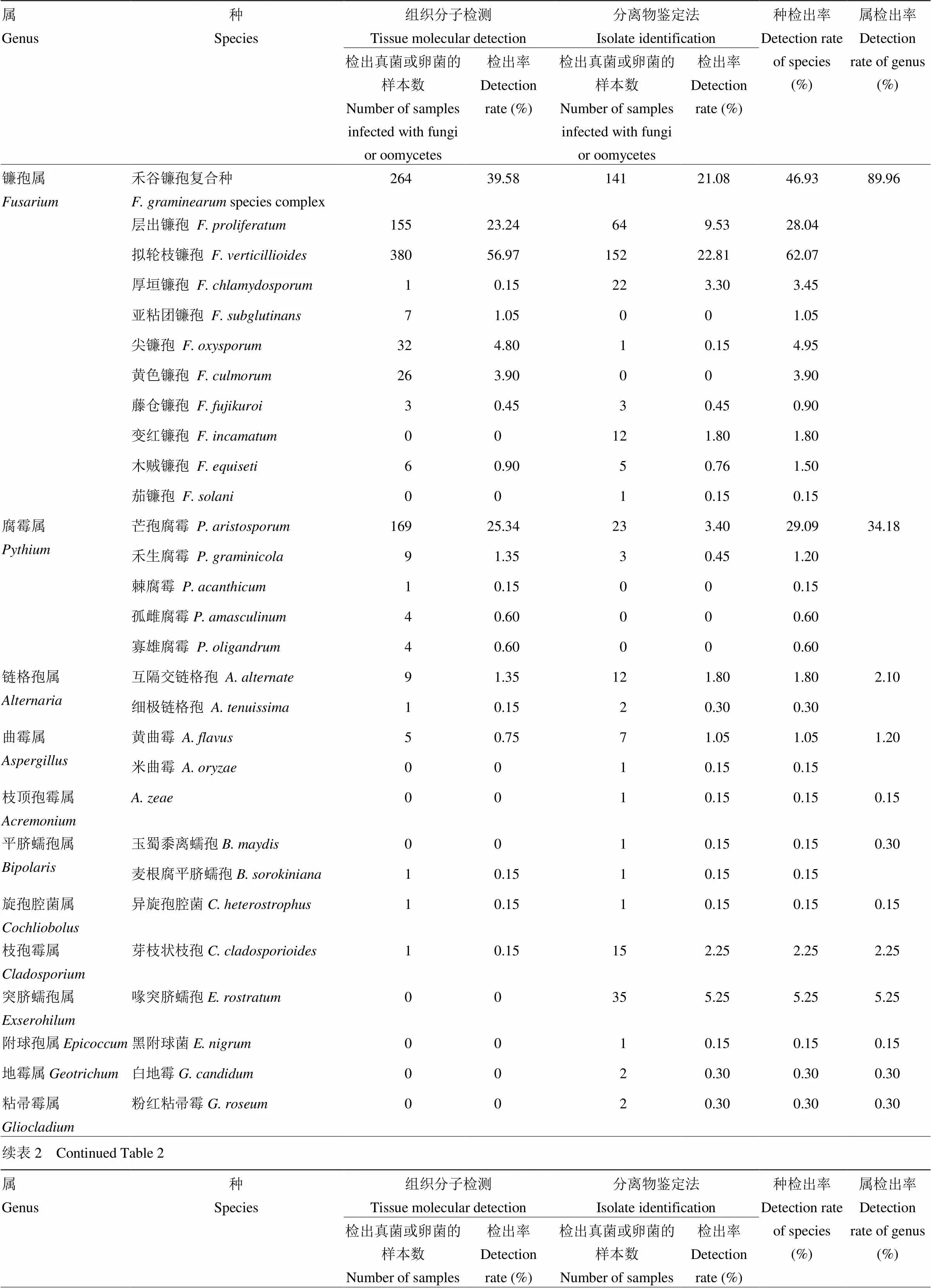
表2 样本中真菌或卵菌的检出率

表3 不同省份主要病原菌的检出率
同一省份不同年度上述4种主要病原菌的检出率存在较大差异(表4),其中任何一种均有可能上升为该省的优势种。河北省2014—2017年的优势病原菌均为拟轮枝镰孢,且检出率逐年上升,最高达到94.55%;2014年芒孢腐霉的检出率仅为4.17%,但2015年该菌的检出率大幅上升至44.44%,成为仅次于拟轮枝镰孢的病原菌。河南省2014年以芒孢腐霉为优势种,禾谷镰孢复合种次之,拟轮枝镰孢检出率较低,未检出层出镰孢;2015年禾谷镰孢复合种和拟轮枝镰孢检出率大幅上升,前者成为优势种,而芒孢腐霉的检出率则大幅下降;2016年和2017年拟轮枝镰孢的检出率高达73.08%和82.61%,成为该省的优势种,同时层出镰孢的检出率也大幅上升。山东省2014年芒孢腐霉为优势种,其次为拟轮枝镰孢,层出镰孢和禾谷镰孢复合种的检出率较低;2015年拟轮枝镰孢、禾谷镰孢复合种和层出镰孢的检出率均大幅升高,芒孢腐霉检出率则下降,禾谷镰孢复合种成为优势种;2016—2017年拟轮枝镰孢则上升为优势种。
2.3 单样本中多种菌共存模式
单样本中可以检测出一种至几种菌,最多的一个样本可检出7种菌(表5)。所有能检出菌的样本中,仅有38.38%的样本检出1种菌,检出2种和3种菌的样本分别占29.24%和19.04%,检出4种以上菌的样本比例均在10%以下。检出比例在年度间存在较大差异,2014年检出1种菌的样本占77.34%,其他年度比例明显降低(23.11%—36.21%);2015—2017年检出2种和3种菌的样本比例较2014年大幅上升,与检出1种菌的样本比例相当。
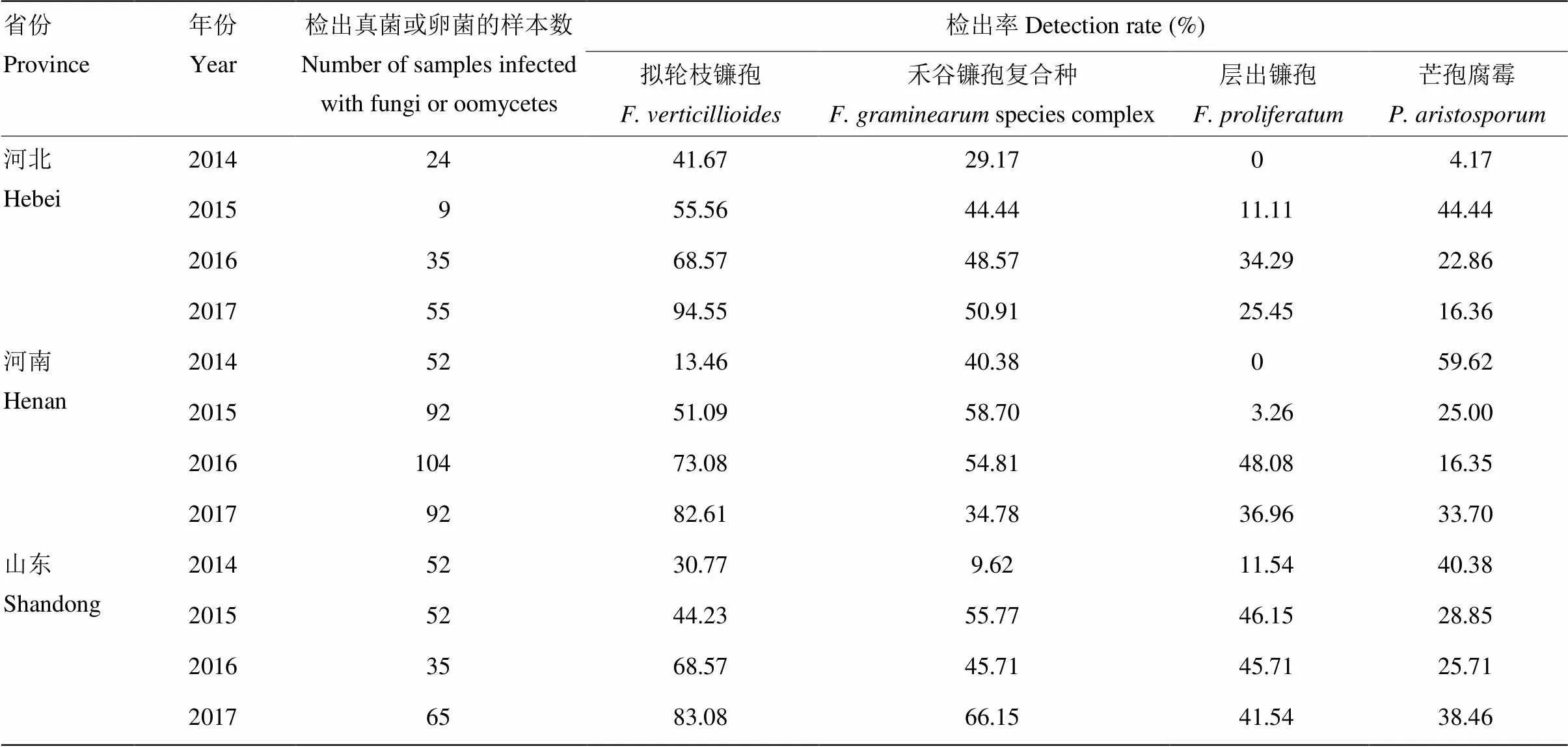
表4 不同年度主要病原菌的检出率
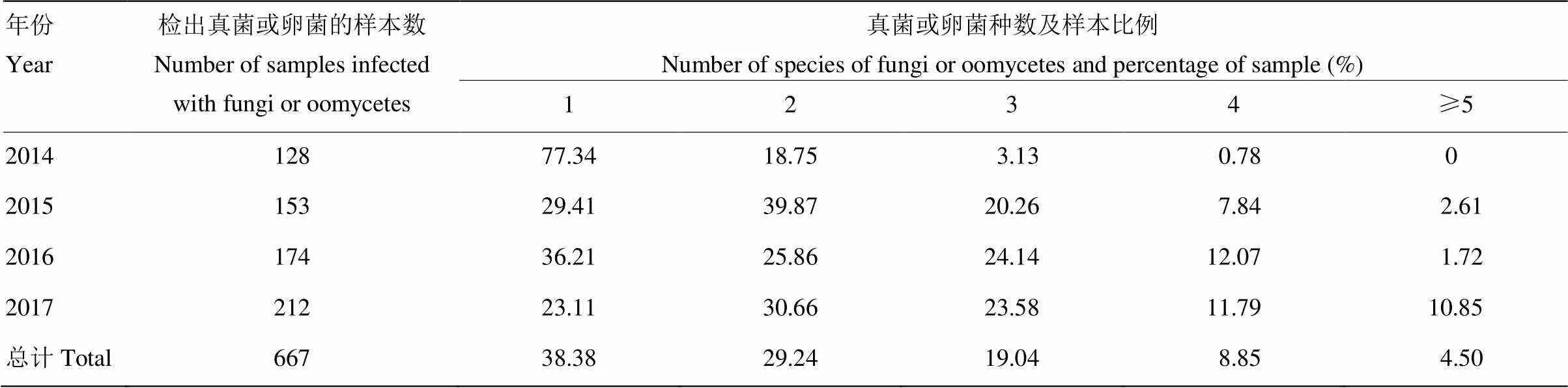
表5 检出不同种数真菌或卵菌的样本比例
进一步分析发现,仅检出一种镰孢菌的样本占26.99%,仅检出一种腐霉菌的样本占6%,其余样本均检出2种(含)以上真菌和(或)卵菌。多菌共存模式以镰孢菌和腐霉菌、镰孢菌和镰孢菌共存为主,样本比例分别为24.29%和23.39%;镰孢菌和其他菌、腐霉菌和其他菌共存的比例较低,未见2种以上腐霉菌共存的情况(表6)。表明在黄淮海夏玉米主产区茎腐病病株中2种以上病原菌共存的情况非常普遍,甚至在多数年份为主要模式。
3 讨论
玉米茎腐病作为一种以症状命名的病害,除由生物因素引起外,其他非生物因素如干旱、涝渍、早衰等也可以引起相同的症状。在本研究中,每年都有表现典型茎腐病症状的植株检测不出任何病原菌(包括细菌)。这些植株地上部呈灰绿色失水干枯状,根系可见水浸状坏死,刚枯死植株茎基部剖开未见明显坏死区域,这种现象在2014年尤为明显。有研究表明,连续的降雨会导致土壤缺氧,造成根系活力降低,甚至窒息死亡[37],而随后的暴晴会造成叶片快速失水,植株枯死,症状和病原菌引起的茎腐病基本相同。据资料记载,2014年黄淮海夏播玉米区大部分地区从9月7日至20日连续阴雨,局部暴雨,低温寡照,从9月18日开始陆续暴晴,随后出现大范围的植株枯死[38]。因此,笔者认为本研究中未检测到病原菌的、具有典型症状的植株是长时间涝渍形成的生理性病害。
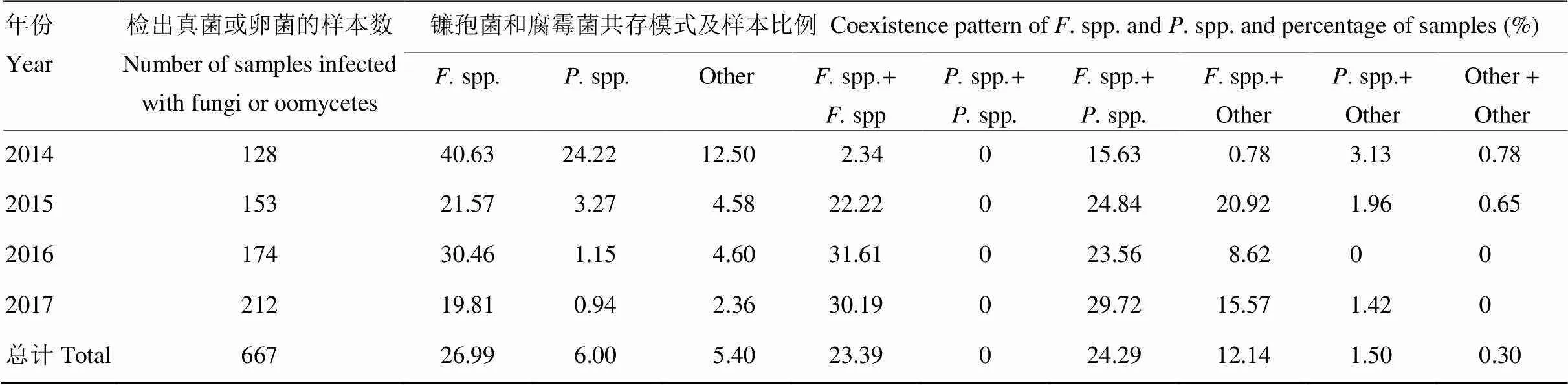
表6 单样本中镰孢菌和腐霉菌的共存模式
spp.:spp.;spp.:spp.; Other: fungi exceptspp. andspp.
本研究表明,在黄淮海夏播区近90%的病株中检测到镰孢菌,该菌是此区域的优势病原菌种群;在镰孢菌中,拟轮枝镰孢占据优势地位,其次为禾谷镰孢复合种和层出镰孢。大多数研究认为在我国茎腐病病原菌中,禾谷镰孢复合种比其他镰孢菌的致病力强[7,18,39-40],因此多年来针对禾谷镰孢复合种开展了侵染机制、发生规律、抗性基因挖掘、防治药剂的筛选、品种的抗性鉴定等大量研究工作,对拟轮枝镰孢和层出镰孢引起的茎腐病研究较少。拟轮枝镰孢和层出镰孢都属于藤仓赤霉复合种(species complex),种内成员形态特征相似,2004年前均认定为串珠镰孢(该种名已废弃)[19,41]。这两种病原菌也是玉米根腐病、穗腐病和鞘腐病的主要病原菌[33-34],目前这几种病害在黄淮海区域均有加重趋势。与禾谷镰孢复合种主要通过根部侵入途径引起茎腐病不同,拟轮枝镰孢和层出镰孢还可经种子带菌途径进入玉米植株,也可以通过叶鞘和茎节连接处侵入引起茎腐病[42],加大了侵染的机会,使茎腐病的防治更加困难。因此,应加强拟轮枝镰孢和层出镰孢茎腐病的致病机理、发生规律和防治技术等研究。本研究中,腐霉菌的检出率为34.18%,是仅次于镰孢菌的病原菌,在多雨潮湿的2014年甚至成为河南省和山东省的优势种。据报道,腐霉菌是北京、浙江[25]、江苏[43]、山西[44]、河北、山东、辽宁[45]、新疆[46]、四川[47]等地茎腐病的主要病原菌。但在腐霉菌的分离过程中样本采集时期、培养基类型、培养条件等多种因素常常影响最终的检测结果,本研究结合分离物鉴定法和组织分子检测法,在一定程度上提高了腐霉菌检测结果的可靠性。
进一步分析发现,有60%以上的病株可以检测出2种(含)以上的病原菌,表明单株中多种病原菌共存是茎腐病病原菌研究中不可回避的事实。孙秀华等研究表明,无论在培养基上还是植株体内,镰孢菌均对腐霉菌有较强的抑制作用[48-49]。本研究中,同时检出腐霉菌和镰孢菌的样本占24.29%,有必要对这种共存模式形成的机制及其在侵染致病中的作用做进一步研究。病原菌可以通过种子携带、根系侵染、茎秆侵染、伤口侵入、自然孔口(气孔、水孔等)等不同方式进入植株,在不同环境条件影响下,可能会通过竞争资源、代谢产物或诱导植物免疫反应产生相互作用来影响彼此生长,进而导致不同类型的茎腐病。因此,控制一种或一类病原菌,有可能导致植株体内的次要病原菌上升为主要病菌。
4 结论
黄淮海夏玉米主产区茎腐病的主要病原菌种群为镰孢菌和腐霉菌,优势种为拟轮枝镰孢,其次为禾谷镰孢复合种、层出镰孢和芒孢腐霉;各省主要病原菌在年度间的检出率呈现动态变化,任何一种病原菌均有可能上升为当地的优势种;单样本中可以同时检测出多种病原菌,以镰孢菌和腐霉菌、镰孢菌和镰孢菌的共存模式为主。镰孢菌和腐霉菌应作为防治茎腐病的主要靶标,在抗性育种中也要兼顾品种对拟轮枝镰孢、禾谷镰孢复合种、层出镰孢和腐霉菌的抗性,才有可能达到较好的防治效果。
[1] 付晋峰, 王璞. 播期和种植密度对玉米子粒灌浆的影响. 玉米科学, 2016, 24(3): 117-122, 130.
FU J F, WANG P. Effects of sowing date and planting density on maize filling., 2016, 24(3): 117-122, 130(in Chinese)
[2] 马传禹, 姚丽姗, 杜腓利, 徐明良. 玉米抗茎腐病研究进展. 玉米科学, 2018, 26(2): 131-137.
MA C Y, YAO L S, DU F L, XU M L. Advanced resistance and genetic research for maize stalk rot., 2018, 26(2): 131-137. (in Chinese)
[3] 徐书法, 陈捷, 高增贵, 邹庆道, 纪明山, 刘海南. 中国玉米茎基腐病和穗腐病研究进展. 植物病理学报, 2006, 36(3): 193-203.
XU S F, CHEN J, GAO Z G, ZOU Q D, JI M S, LIU H N. Maize stalk rot and ear rot in China., 2006, 36(3): 193-203. (in Chinese)
[4] 汤蒙蒙. 黄淮地区玉米茎基腐病病原菌鉴定及防治技术研究[D]. 郑州: 河南农业大学, 2016.
TANG M M. Identification of pathogens and the control technology of corn stalk rot in Huanghuai Area[D]. Zhengzhou: Henan Agricultural University, 2016. (in Chinese)
[5] 白金铠, 尹志, 胡吉成. 东北玉米茎腐病病原的研究. 植物保护学报, 1988, 15(2): 93-98.
BAI J K, YIN Z, HU J C. Studies on pathogenic fungus of stalk rot of corn in the northeastern China., 1988, 15(2): 93-98. (in Chinese)
[6] 张明智, 王守正, 王振跃, 周挺. 河南省玉米青枯病病原菌初步研究. 河南农业大学学报, 1988, 22(2): 135-148.
ZHANG M Z, WANG S Z, WANG Z Y, ZHOU T. Preliminary study on pathogenic fungi of thewilt (spp.) of corn in Henan province., 1988, 22(2): 135-148. (in Chinese)
[7] 贺娟, 何鹏飞, 赵正龙, 吴毅歆, 康志钰, 何月秋. 云南省玉米茎基腐病病原镰孢菌的种群结构研究. 玉米科学, 2017, 25(4): 135-143.
HE J, HE P F, ZHAO Z L, WU Y X, KANG Z Y, HE Y Q. Population structure ofpathogen of corn stalk rot in Yunnan Province., 2017, 25(4): 135-143. (in Chinese)
[8] 郭满库, 王晓鸣, 何苏琴, 刘永刚, 金社林, 曹世勤, 魏宏玉. 2009年甘肃省玉米穗腐病、茎基腐病的发生危害. 植物保护, 2011, 37(4): 134-137.
GUO M K, WANG X M, HE S Q, LIU Y G, JIN S L, CAO S Q, WEI H Y. Occurrence of maize kernel rot and corn stalk rot in Gansu in 2009., 2011, 37(4): 134-137. (in Chinese)
[9] GAI X T, YANG R X, PAN X J, YUAN Y, WANG S N, LIANG B B, GAO Z G. First report ofcausing stalk rot on maize in China., 2016, 100(5): 1010.
[10] 高卫东, 鲍金草, 赵晋荣. 山西玉米茎腐病病原种类及其复合侵染的研究. 山西农业大学学报, 1987, 7(2): 199-207.
GAO W D, BAO J C, ZHAO J R. Studies on pathogens and their complex infection of corn stalk rot in Shanxi Province., 1987, 7(2): 199-207. (in Chinese)
[11] 张超冲,贤振华, 韦继光, 陈超美, 周筱兰. 玉米青枯病菌的侵染及发病规律研究. 广西农学院学报, 1983(1): 53-62.
ZHANG C C, XIAN Z H, WEI J G, CHEN C M, ZHOU X L. Study on regularity of infection and occurrence of pathogenic fungi of corn stalk rot., 1983(1): 53-62. (in Chinese)
[12] 王晓鸣, 吴全安, 刘晓娟, 马国忠. 寄生玉米的6种腐霉及其致病性研究. 植物病理学报, 1994, 24(4): 343-346.
WANG X M, WU Q A, LIU X J, MA G Z. Identification and pathogenicity ofspp. isolated from maize., 1994, 24(4): 343-346. (in Chinese)
[13] 罗畔池, 张成和, 刘爱国, 王月恋, 张小青, 孔令晓, 霍志清, 刘庆义. 玉米茎腐病原及栽培与发病关系. 华北农学报, 1993, 8(增刊): 110-114.
LUO P C, ZHANG C H, LIU A G, WANG Y L, ZHANG X Q, KONG L X, HUO Z Q, LIU Q Y. Studies on the pathogen of maize stalk rot and the relationship between maize cultivation and development of the disease., 1993, 8(Suppl.): 110-114. (in Chinese)
[14] 王连生, 刘克明, 刘玉瑛, 苏海, 朱小阳, 吴全安. 河北省玉米青枯病病原菌的分离及致病性测定. 河北农业科学, 1992(1): 1-4.
WANG L S, LIU K M, LIU Y Y, SU H, ZHU X Y, WU Q A. Isolation and pathogenicity determination of pathogen for corn stalk rot in Hebei province., 1992(1): 1-4. (in Chinese)
[15] 石洁. 玉米镰刀菌型茎腐、穗腐、苗期根腐病的相互关系及防治[D]. 保定: 河北农业大学, 2002.
SHI J. Relationship and control ofstalk rot, ear rot and seedling root rot in maize[D]. Baoding: Hebei Agricultural University, 2002. (in Chinese)
[16] 徐作珽, 张传模. 山东玉米茎基腐病病原菌的初步研究. 植物病理学报, 1985, 15(2): 103-108.
XU Z T, ZHANG C M. Study on the causal organism of root and basal stalk rot of corn in Shandong province.,1985, 15(2): 103-108. (in Chinese)
[17] 张艺铭. 山东省玉米青枯病病原鉴定及生防菌株和化学药剂的筛选[D]. 泰安: 山东农业大学, 2016.
ZHANG Y M. Pathogen identification of corn stalk rot in Shandong and screening of antagonistic bacteria and effective agrochemicals[D]. Taian: Shandong Agricultural University, 2016. (in Chinese)
[18] 袁虹霞, 闵营辉, 张丹丹, 邢小萍, 李洪连, 雷彩艳. 河南省玉米茎腐病病原菌分离与致病性测定. 玉米科学, 2011, 19(6): 122-124, 128.
YUAN H X, MIN Y H, ZHANG D D, XING X P, LI H L, LEI C Y. Isolation and pathogenicity determination of pathogen for corn stalk rot in Henan Province.2011, 19(6): 122-124, 128. (in Chinese)
[19] 崔小伟. 河南省玉米茎腐病研究[D]. 杨凌: 西北农林科技大学, 2013.
CUI X W. Study on corn stalk rot in Henan province[D]. Yangling: Northwest A&F University, 2013. (in Chinese)
[20] 孙静, 谢淑娜, 刘佳中, 刘京宝, 郝俊杰, 邓士政. 河南省玉米茎基部镰刀菌的形态和分子鉴定. 植物病理学报, 2014, 44(1): 8-16.
SUN J, XIE S N, LIU J Z, LIU J B, HAO J J, DENG S Z. Morphological and molecular identification ofisolated from basal stalks of maize in Henan Province., 2014, 44(1): 8-16. (in Chinese)
[21] 范志业, 崔小伟, 施艳, 陈琦, 刘迪, 侯艳红, 李世民, 闫海霞, 袁刘正, 孙虎.河南省玉米茎基腐病主要病原菌鉴定及主栽玉米品种的抗性分析. 河南农业科学, 2014, 43(12): 87-90.
FAN Z Y, CUI X W, SHI Y, CHEN Q, LIU D, HOU Y H, LI S M, YAN H X, YUAN L Z, SUN H. Identification of pathogens causing corn stalk rot and resistance test of main cultivars in Henan province., 2014, 43(12): 87-90. (in Chinese)
[22] 何婧. 玉米茎腐病病原菌分离鉴定与镰孢菌群体遗传多样性研究[D]. 乌鲁木齐: 新疆农业大学, 2010.
HE J. Isolation, identification of causal agents of maize stalk rot and genetic diversity analysis ofspp.[D]. Urumqi: Xinjiang Agricultural University, 2010. (in Chinese)
[23] 马红霞, 张海剑, 孙华, 石洁, 陈丹, 郭宁. 玉米茎腐病病原菌检测方法研究. 植物保护, 2017, 43(3): 149-153.
MA H X, ZHANG H J, SUN H, SHI J, CHEN D, GUO N. Comparison of pathogen detection methods for corn stalk rot., 2017, 43(3): 149-153. (in Chinese)
[24] 马秉元, 李亚玲, 段双科. 陕西省关中地区玉米青枯病病原菌及其致病性的研究. 植物病理学报, 1985, 15(3): 150-152.
MA B Y, LI Y L, DUAN S K. Study on pathogen of corn stalk rot and its pathogenicity in middle Shaanxi., 1985, 15(3): 150-152. (in Chinese)
[25] 吴全安, 梁克恭, 朱小阳, 王晓鸣, 金加同, 王桂跃. 北京和浙江地区玉米青枯病病原菌的分离与鉴定. 中国农业科学, 1989, 22(5): 71-75.
WU Q A, LIANG K G, ZHU X Y,WANG X M, JING J T, WANG G Y. isolation and identification of the pathogen of maize stalk rot in Beijing and Zhejiang., 1989, 22(5): 71-75. (in Chinese)
[26] 魏景超. 真菌鉴定手册. 上海: 上海科学技术出版社, 1979.
WEI J C.. Shanghai: shanghai scientific and technical publishers, 1979. (in Chinese)
[27] 孔华忠. 中国真菌志 (第35卷): 青霉属及其相关有性型属. 北京: 科学出版社, 2007.
KONG H Z.:. Beijing: Science press, 2007.(in Chinese)
[28] 孙华, 郭宁, 石洁, 张海剑, 马红霞, 刘树森. 海南玉米穗腐病病原菌分离鉴定及优势种的遗传多样性分析. 植物病理学报, 2017, 47(5): 577-583.
SUN H, GUO N, SHI J, ZHANG H J, MA H X, LIU S S. Characterization of the maize ear rot pathogens and genetic diversity analysis of dominant species in Hainan., 2017, 47(5): 577-583. (in Chinese)
[29] NICHOLSON P, SIMPSON D R, WESTON G, REZANOOR H N, LEES A K, PARRY D W, JOYCED. Detection and quantification oandin cereals using PCR assays., 1998, 53(1): 17-37.
[30] MULÈ G, SUSCA A, STEA G, MORETTI A.A species-specific PCR assay based on the calmodulin partial gene for identification of,and., 2004, 110(5/6): 495-502.
[31] RAHJOO V, ZAD J, JAVAN-NIKKHAH M, GOHARI A M, OKHOVVAT S M, BIHAMTA M R, RAZZAGHIAN J, KLEMSDAL S S. Morphological and molecular identification ofisolated from maize ears in Iran., 2008, 90(3): 463-468.
[32] MISHRA P K, FOX R T, CULHAM A. Development of a PCR-based assay for rapid and reliable identification of pathogenic Fusaria., 2003, 218(2): 329-332.
[33] BONANTS P, WEERDT M H, VAN GENT-PELZER M, LACOURT I, COOKE D, DUNCAN J. Detection and identification ofHickman by the polymerase chain reaction., 1997, 103(4): 345-355.
[34] O’DONNELL K, KISTLER H C, CIGELNIK E, PLOETZ R C. Multiple evolutionary origins of the fungus causing Panama disease of banana: concordant evidence from nuclear and mitochondrial gene genealogies., 1998, 95(5): 2044-2049.
[35] WHITE T J, BRUNS T, LEE S, TAYLOR J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics//Innis M A, Gelfand D H, Sninsky J J, WHITE T J.. San Diego: Academic Press, 1990: 315-322.
[36] CARBONE I, KOHN L M. A method for designing primer sets for speciation studies in filamentous ascomycetes.553-556.
[37] 邱法展. 玉米单倍体育种及苗期耐渍性研究[D]. 武汉: 华中农业大学, 2007.
QIU F Z. Study on waterlogging tolerance during seedling stage and haploid breeding in maize[D]. Wuhan: Huazhong Agricultural University, 2007. (in Chinese)
[38] 全国农业技术推广服务中心. 中国玉米新品种动态2014年国家级玉米品种区试报告. 北京: 中国农业科学技术出版社, 2015: 106.
The National Agro-tech extension and Service Center.. Beijing: China Agricultural Science and Technology Press, 2015: 106. (in Chinese)
[39] 张瑞英, 张坪. 黑龙江省玉米茎基腐病病原菌研究初报. 植物保护学报, 1993, 20(3): 287-288.
ZHANG R Y, ZHANG P. The preliminary study on corn stalk base rot in Heilongjiang province., 1993, 20(3): 287-288. (in Chinese)
[40] 许明学, 冯芬芬, 柳迎春. 玉米抗茎腐病育种的研究. 玉米科学, 1993, 1(3): 67-70.
XU M X, FENG F F, LIU Y C. Research progress on maize breeding for resistance to stalk rot., 1993, 1(3): 67-70. (in Chinese)
[41] 吕国忠, 赵志慧, 孙晓东,姜子德, 杨红. 串珠镰孢菌种名的废弃及其与腾仓赤霉复合种的关系. 菌物学报, 2010, 29(1): 143-151.
Lü G Z, ZHAO Z H, SUN X D, JIANG Z D, YANG H. The abandonment of the nameand the concept ofspecies complex., 2010, 29(1): 143-151. (in Chinese)
[42] 任旭, 朱振东, 李洪杰, 段灿星, 王晓鸣. 轮枝镰孢SSR标记开发及在玉米分离群体遗传多样性分析中的应用. 中国农业科学, 2012, 45(1): 52-66.
REN X, ZHU Z D, LI H J, DUAN C X, WANG X M. SSR marker development and analysis of genetic diversity ofisolated from maize in china., 2012, 45(1): 52-66. (in Chinese)
[43] 朱华, 梁继农, 王彰明, 陈厚德, 奚京平, 仇宝华, 王全领.江苏省玉米茎腐病菌种类鉴定. 植物保护学报, 1997, 24(1): 49-54.
ZHU H, LIANG J N, WANG Z M, CHEN H D, XI J P, QIU B H, WANG Q L. Identification of pathogens causing maize stalk rot in Jiangsu province., 1997, 24(1): 49-54. (in Chinese)
[44] 王富荣, 傅玉红, 陈永欣. 山西省玉米茎腐病病原菌的分离及致病性测定. 山西农业科学, 1992(9): 20-21.
WANG F R, FU Y H, CHEN Y X. Isolation and pathogenicity determination of pathogen for corn stalk rot in Shanxi province, 1992(9): 20-21. (in Chinese)
[45] 宋佐衡, 梁景颐, 白金铠. 辽宁省玉米茎腐病病原菌的研究. 沈阳农业大学学报, 1990, 21(3): 214-218.
SONG Z H, LIANG J Y, BAI J K. Preliminary studies on the etiology of stalk rot of corn in Liaoning province., 1990, 21(3): 214-218. (in Chinese)
[46] 杨山山, 郝彦俊, 邱荣芳, 王晓鸣, 吴全安.新疆玉米青枯病病原菌分离和鉴定. 新疆农业大学学报, 1997, 20(2): 29-36.
YANG S S, HAO Y J, QIU R F, WANG X M, WU Q A. Etiology of corn stalk rot in Xinjiang., 1997, 20(2): 29-36. (in Chinese)
[47] 吴小龙. 玉米青枯病菌的鉴定、生物学特性及生物防治研究[D]. 雅安: 四川农业大学, 2010.
WU X L. Isolation and identification and biological characteristics of pathogen of corn stalk rot and primary study on diseases biological control[D]. Yaan: Sichuan Agricultural University, 2010. (in Chinese)
[48] 孙秀华, 孙亚杰, 张春山, 白金铠, 宋佐衡, 陈捷. 玉米茎腐病病原菌相互作用研究. 沈阳农业大学学报, 1992, 23(2): 93-96.
SUN X H, SUN Y J, ZHANG C S, BAI J K, SONG Z H, CHEN J. Studies on the relationship among pathogens of corn stalk rot.1992, 23(2): 93-96. (in Chinese)
[49] 陈绍江, 宋同明, 吴全安. 玉米青枯病病原腐霉对其伴生镰刀菌的影响. 植物病理学报, 1997, 27(3): 251-256.
CHEN S J, SONG T M, WU A Q. Effect ofon the growth ofin maize stalk rot., 1997, 27(3): 251-256. (in Chinese)
analysis of main pathogens and dominant species of Maize stalk rot in the main Summer Maize producing areas of Huang-Huai-Hai
LIU ShuSen, MA HongXia, GUO Ning, SHI Jie, ZHANG HaiJian, SUN Hua, JIN Ge
(Plant Protection Institute, Hebei Academy of Agricultural and Forestry Sciences/Key Laboratory of IPM on Crops in Northern Region of North China, Ministry of Agriculture/IPM Centre of Hebei Province, Baoding 071000, Hebei)
【Objective】The objective of this study is to determine the main pathogens and dominant species of maize stalk rot in the main summer maize producing areas of Huang-Huai-Hai, and to provide a basis for understanding the pathogenic mechanism, resistantbreeding, and ultimately maize stalk rot management.【Method】In 2014-2017, 850 samples of maize stalk rot were collected from three provinces (Hebei, Henan and Shandong) in the main summer maize producing areas of Huang-Huai-Hai. The isolated fungi or oomycetes were morphologically characterized and confirmed by using universal and specific primers, those primers were also used for detecting pathogens in diseased tissues. The combined results of isolate identification and tissue molecular detection were analyzed to determine the main pathogens and the dominant species. The detection rates of main pathogens in different provinces and different years of the same province were analyzed to reveal the population dynamics. The detection rates of pathogens in individual samples were also analyzed to determine the coexistence patterns of multiple pathogens.【Result】Fungi or oomycetes were detected in 667 samples, accounting for 78.47% of all samples. The detection rates were different among years, less than 50% in 2014 and more than 90% in 2015-2017.Detected fungi or oomycetes were classified to 46 species of 20 genera.spp. had the highest detection rate of 89.96%, includingspecies complex,,,,,,,,,and. In addition,spp. had the second highest detection rate of 34.18%, including,,,and. oligandrum. The detection rates of four main pathogens,species complex,and,were 62.07%, 46.93%, 29.09% and 28.04%, respectively. It indicated that the dominant species was. There were some differences in the detection rates of the four main pathogens among provinces. The detection rate ofin Hebei Province was 73.98%, which was significantly higher than that in Henan and Shandong Provinces, and the detection rates ofspecies complex in the three provinces were similar. The detection rates ofandin Shandong Province were 35.78% and 34.31%, respectively, which were higher than those in other two provinces. The detection rates of the four main pathogens from the same province were dynamic in different years, and any one of them can be the dominant species. Furthermore, several pathogens could be detected in a single sample. While 38.38% samples were colonized by only one pathogen, 29.24% and 19.04% samples were colonized by two and three pathogens. The patterns of two or multiple pathogens in single samples were mainly coexistence ofspp. andspp., or coexistence ofspp. andspp..【Conclusion】The main pathogens of maize stalk rot in the main summer maize producing areas of Huang-Huai-Hai are,species complex,and, and the dominant species is. The detection rate ofin Hebei Province and that ofandin Shandong Province are the highest, and the detection rate ofspecies complex in the three provinces is similar. There is a coexistence pattern of two or multiple pathogens in a single sample.
maize stalk rot; Huang-Huai-Hai region; pathogen detection; dominant species;spp.;spp.
10.3864/j.issn.0578-1752.2019.02.006
2018-09-04;
2018-11-23
国家现代农业产业技术体系(CARS-02)
刘树森,E-mail:shusenliu@163.com。通信作者石洁,E-mail:shij99@163.com
(责任编辑 岳梅)
