全氟己酸对罗非鱼肝脏NAGase的抑制动力学
2019-01-25陈晓佳张伟妮胡可慧孙林浩黄小红
陈晓佳, 张伟妮, 胡可慧, 孙林浩, 黄小红
(福建农林大学中西兽医结合与动物保健福建省高校重点实验室,福建 福州 350002)
随着全球海洋渔业捕捞资源的不断衰退,人们对养殖水产品的需求量日益增大[1],罗非鱼因其蛋白含量高、肉质肥美、生存能力强而深受全世界人民的喜爱.1976年联合国粮农组织(FAO)将罗非鱼作为优秀品种向全球推广.自2000年起,我国罗非鱼总产量以每年14.75%左右的速度递增[2],占世界总养殖量的50%[3],位居全球罗非鱼养殖产量第一.由于罗非鱼对环境的适应能力良好[1],且在水环境中对不少有机污染物有富集作用,成为生态毒理研究的重要模式鱼[4].
全氟化合物具有生物富集性,是一类持久、有污染性的有机物.全氟化合物由于其良好的热稳定性、抗氧化能力、疏水疏油、不易被代谢等特点,被广泛应用于纺织、化妆品、杀虫剂、合成洗涤剂等许多工业和生活领域.其中,在工业产业中有较多应用的是全氟辛酸和全氟辛烷磺酸[5-6].全氟化合物有优良的水溶特性,能通过大气进行长距离传输[7],导致了其广泛存在于海水、土壤、大气等环境介质中,甚至在生物体内也能检测到全氟化合物[8].全氟化合物进入生物体的方式繁多,且可以利用生物富集作用在生物体内不断蓄积,对环境、生物体甚至人类造成危害[9].据报道,全氟化合物具有很强的发育毒性、肝脏毒性、生殖毒性[10].研究发现,虽然全氟辛烷磺酸在水环境中的含量较少,但在鱼体中却能检测到相当高的含量,如比目鱼肝脏中的全氟辛烷磺酸含量为7 760 μg·kg-1,而野生银鲫体内的全氟辛烷磺酸含量更高达9 031 μg·kg-1[11].虽然全氟辛酸和全氟辛烷磺酸等长链全氟化合物危害大已逐渐减少使用,但有许多与其结构类似、功能相同的短链全氟化合物作为替代品投入使用,如全氟己酸、全氟丁烷磺酸盐等[10].
随着短链全氟化合物的不断投入使用,这类物质在环境中的含量也会随之不断地增加,而目前关于新型的短链全氟化合物在环境中对鱼类影响的研究较为少见.本试验以分离纯化于罗非鱼肝脏中的N-乙酰-β-D-氨基葡萄糖苷酶(β-N-acetyl-D-glucosaminidase, NAGase)为材料,研究全氟己酸对NAGase的抑制作用,探讨环境中有机污染物对罗非鱼的危害,旨在为罗非鱼的安全养殖提供参考.
1 材料与方法
1.1 材料
本试验使用的NAGase为分析纯,分离纯化于尼罗罗非鱼肝脏,比活力为2 988 U·mg-1;底物对硝基苯-N-乙酰-β-D-氨基葡萄糖苷(pNP-NAG)为上海医药工业研究院产品;全氟己酸购于阿拉丁公司;其他无机试剂(AR级国产分析纯)均为国药集团化学试剂有限公司产品;本试验所用水均为双蒸水.
1.2 方法
酶活力采用Chen et al[12]的方法测定;酶蛋白含量采用Lowry[13]的方法测定;采用Tsou[14]的方法测定全氟己酸对罗非鱼肝脏NAGase的抑制作用.2 mL含0.1 mol·L-1磷酸盐缓冲液(pH 5.7)的测酶活力体系,于37 ℃水浴5 min,加入10 μL酶液,实时监测不同底物浓度(0.20、0.25、0.30、0.40 mmol·L-1)与不同含量(0.15、0.30、0.45、0.60 mg·mL-1)全氟己酸反应体系的反应过程.分析底物反应动力学曲线,求得反应速度常数.
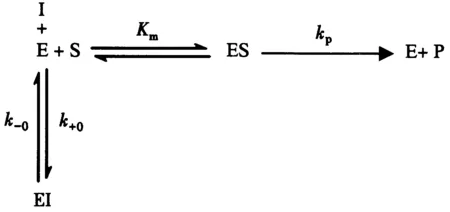
上式中:E、S、I、P分别表示罗非鱼肝脏NAGase、底物pNP-NAG、全氟己酸(抑制剂)、产物;ES、EI分别表示酶与底物的复合物、酶与抑制剂的复合物;Km表示米氏常数;kp表示反应微观速度常数;k+0、k-0分别表示失活反应的正向和逆向的微观速度常数.一般而言,底物浓度([S])>>NAGase初始浓度[E0]、全氟己酸含量([I])>>[E0],因此,产物生成量可以用以下方程表示:
(1)
(2)
B=k-0
(3)
公式(1~3)中:[P]t表示反应时间为t时的产物浓度,A、B分别表示酶受全氟己酸抑制过程中正向和逆向的表观速度常数;A[I]+B为表观抑制速度常数;v表示不存在抑制剂时的初始反应速度.根据v=(Vm×[S])/(Km+[S])(米氏方程),当t足够长时,产物生成曲线趋于直线,产物浓度写成[P]calc.
(4)
(5)
ln([P]calc-[P]t)=-(A[I]+B)×t+常数
(6)
公式(4~6)中,[P]t是t时实际获得的产物浓度.-(A[I]+B)为ln([P]calc-[P]t)对t在不同抑制剂含量下作图得到直线的斜率.-(A[I]+B)对抑制剂含量[I]作图得到斜率(A)、截距(B).B等于k-0.
通过公式(2)可得:
(7)
1/A对[S]作图得到的直线斜率为1/(k+0×Km),截距为1/k+0.因此,k+0可以获得.
结合公式(2)和米氏方程:
(8)
通过不含有抑制剂的不同底物浓度下的底物反应可以求得Km、Vm.因此,k+0也能够轻易求出.
2 结果与分析
2.1 全氟己酸含量对罗非鱼肝脏NAGase活力的影响
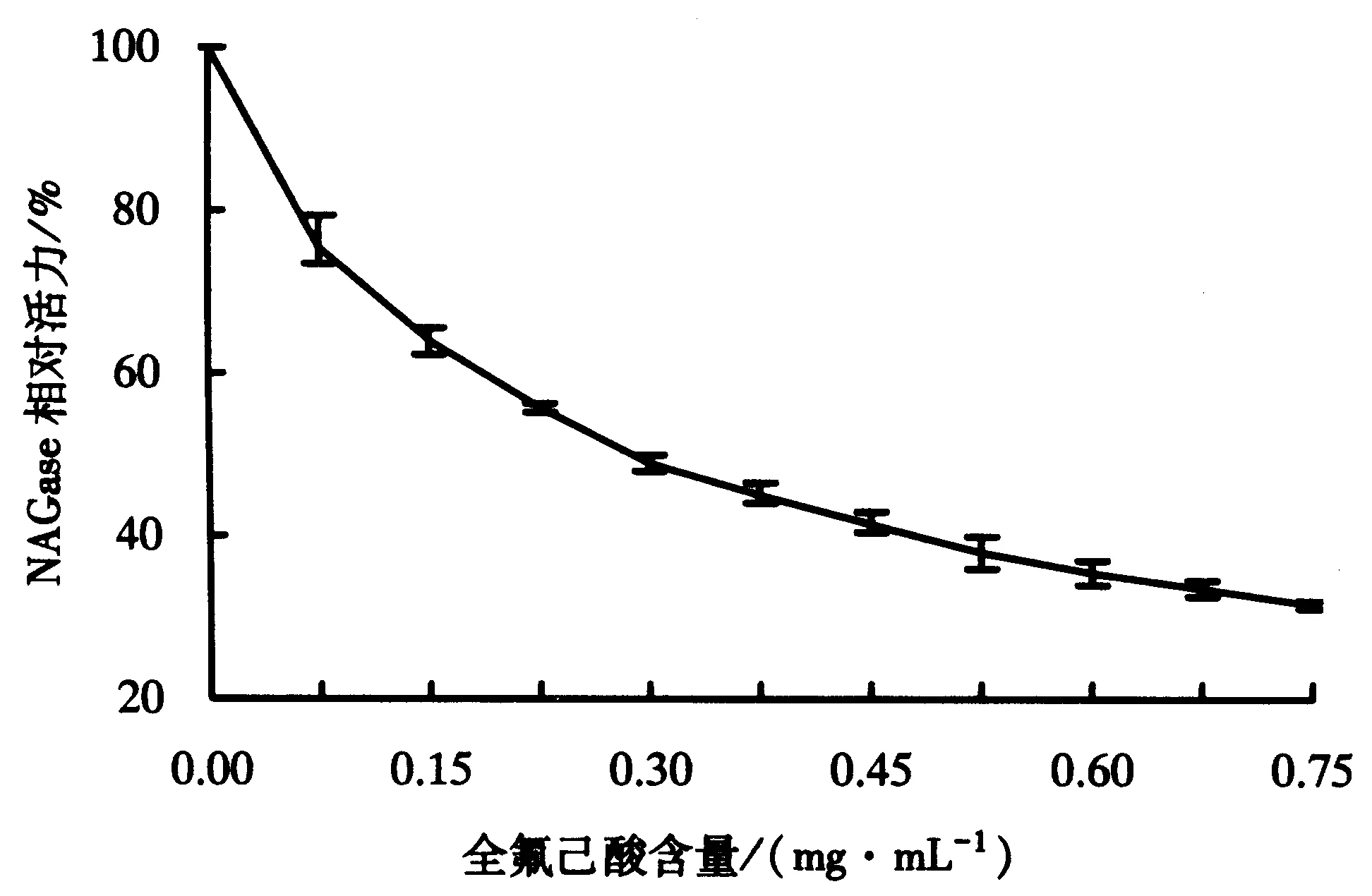
图1 全氟己酸含量对NAGase活力的影响Fig.1 Effect of perfluorohexic acid on the activity of NAGase
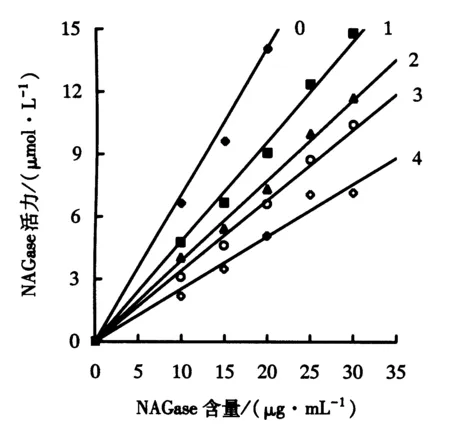
0~4:全氟己酸含量分别为0、0.15、0.30、0.45、0.60 mg·mL-1.图2 不同全氟己酸含量下NAGase活力与酶量的关系Fig.2 Effect of NAGase concentration on its activity with different concentrations of perfluorohexic acid
剩余酶活力与全氟己酸含量的关系如图1所示.图1显示,全氟己酸可以抑制罗非鱼肝脏NAGase的活力,且全氟己酸对酶的抑制为浓度依赖性.随着全氟己酸含量的增加,酶剩余活力快速降低.当全氟己酸含量为0.29 mg·mL-1时,酶的相对活力降低至50%.图2显示不同全氟己酸含量下酶活力与酶含量的关系.在不同全氟己酸含量下,以酶剩余活力对酶含量作图,可以得到一组过原点的直线.全氟己酸含量的增加导致了直线斜率的减小,说明全氟己酸对酶的抑制作用是可逆的.全氟己酸的存在并没有减少有效酶的量,只是抑制和减小了酶活力.
2.2 全氟己酸对罗非鱼肝脏NAGase的抑制类型
采用Lineweaver-Burk双倒数法研究在不同全氟己酸含量下改变底物浓度对NAGase活力的影响,结果如图3a所示.图3a为一组交于Y轴、斜率不同的直线,说明全氟己酸对NAGase的抑制作用类型为竞争性抑制,Km随着全氟己酸含量的变化而变化,而Vm则不会改变.这也表明了全氟己酸仅仅对自由酶造成抑制作用.由图3a中每条直线的表观Km对全氟己酸含量作图得到一条直线(图3b),可以求得全氟己酸与自由酶结合的抑制平衡常数(KI)为0.18 mg·mL-1.
2.3 全氟己酸对罗非鱼肝脏NAGase的底物反应
动力学
在不同含量全氟己酸的测活体系中,监测NAGase水解pNP-NAG反应产物量.结果如图4a所示.在不同含量全氟己酸的作用下,NAGase水解底物的反应速度都随着时间的增加不断减慢直到趋于一条直线,且斜率随着全氟己酸含量的增加而减小.用Tsou[14]的方法分析以上结果,发现酶在全氟己酸中水解底物的反应过程是一个慢可逆过程.根据公式(6),将ln([P]calc-[P]t)对t在不同全氟己酸含量下作图得到一组斜率为-(A[I]+B)的直线,结果如图4b所示.
2.4 不同底物浓度的抑制动力学
在0.45 mg·mL-1全氟己酸中,不同底物浓度的反应动力学过程如图5a所示.当时间足够长时,初始反应速度和虚线的斜率随着底物浓度的增加而增大.同时,ln([P]calc-[P]t)对t在不同底物浓度下作图,得到一组斜率为-(A[I]+B)的直线(图5b).A、B可以通过图5b计算获得.
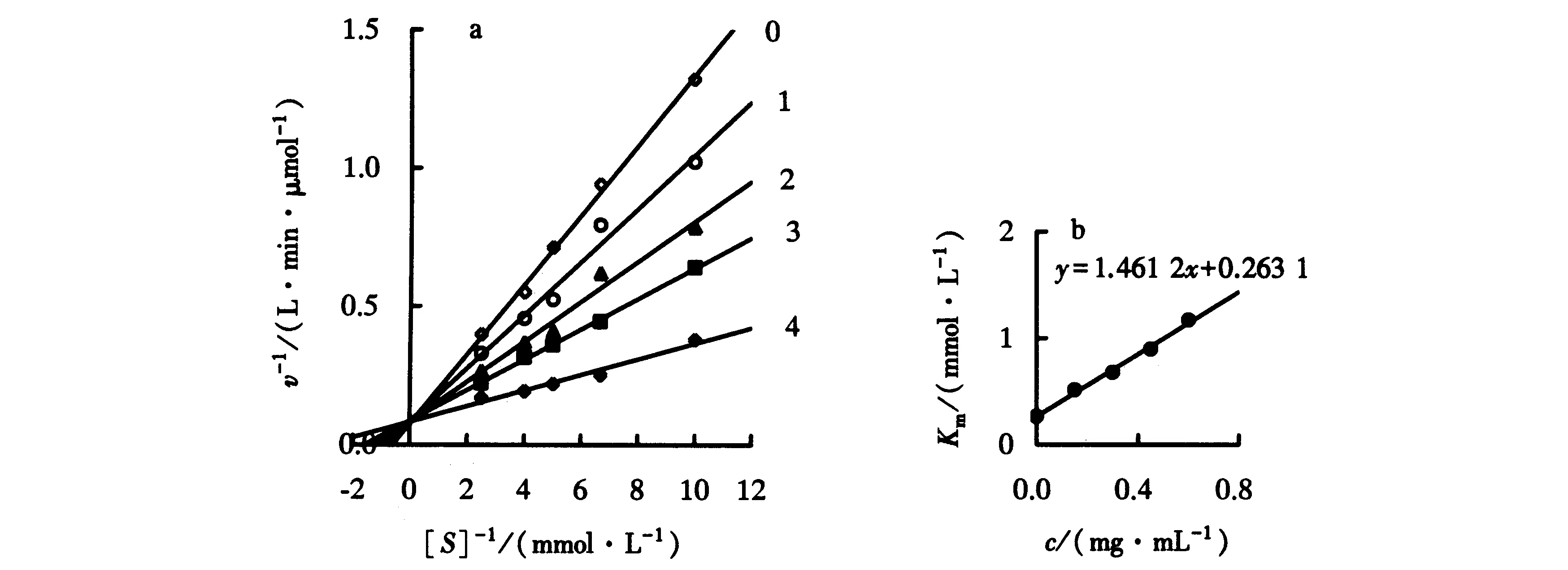
0~4:全氟己酸含量分别为0、 0.15、0.30、0.45、0.60 mg·mL-1.图3 NAGase在全氟己酸中的抑制类型Fig.3 Inhibitory type of NAGase in perfluorohexic acid
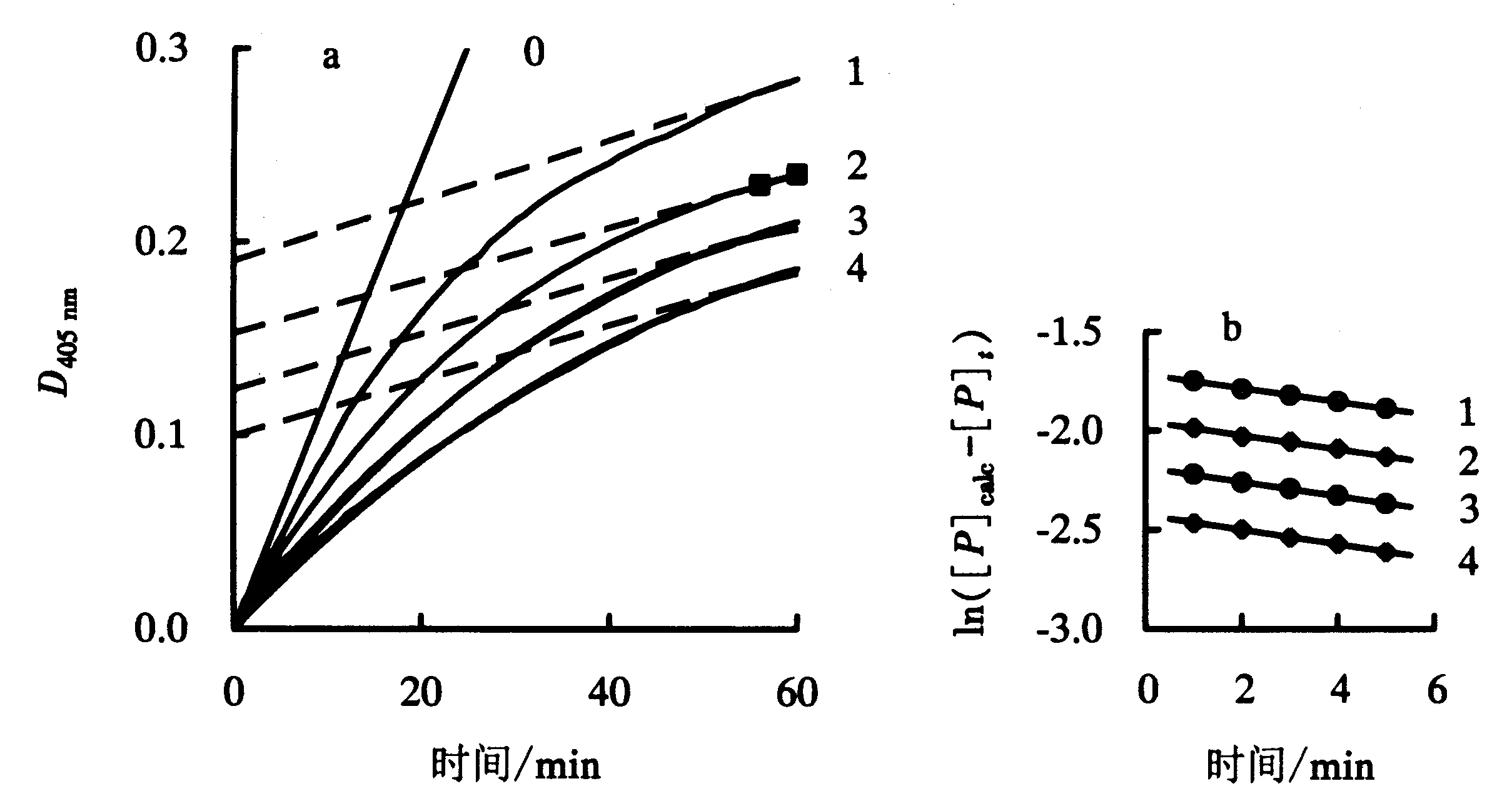
a:反应过程;b:ln([P]calc-[P]t)的半对数对t作图,数据来自图4a中的曲线1~4(0~4:全氟己酸含量分别为0、 0.15、0.30、0.45、0.60 mg·mL-1).图4 NAGase在不同含量的全氟己酸中水解底物的反应过程Fig.4 Course of substrate reaction for NAGase with different concentrations of perfluorohexic acid
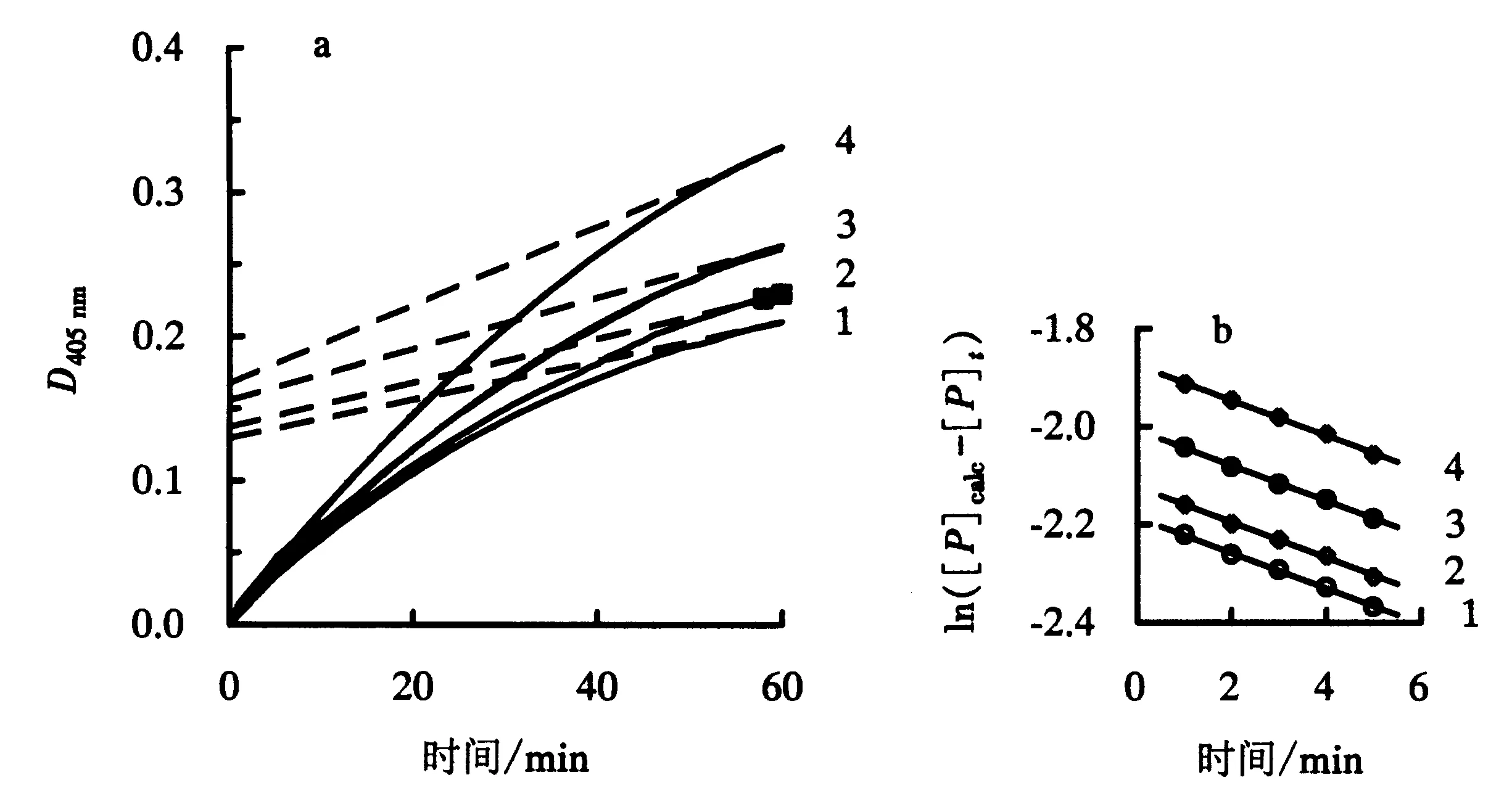
a:反应过程;b:ln([P]calc-[P]t)的半对数对t作图,数据来自图5a中的曲线1~4(1~4:底物浓度分别为0.20、0.25、0.30、0.40 mmol·L-1).图5 NAGase在0.45 mg·mL-1全氟己酸中的抑制反应Fig.5 Inhibition reaction of NAGase in 0.45 mg·mL-1 perfluorohexic acid
2.5 NAGase抑制微观速度常数的计算
图4b中的直线斜率对全氟己酸含量作图得到图6中的曲线1,同时收集其他底物浓度下的数据,得到图6的其他几条直线.图6中每条直线的纵截距相同,而B通过纵截距求得.B等于k-0(表1).1/A对[S]作图得到一条交叉于Y轴的直线(图7).根据公式(7),直线的截距等于1/k+0,故表1中的k+0可以求得.同时, 1/(k+0×Km)为直线的斜率.Km、Vm可以通过不含全氟己酸的底物反应计算得到,分别为0.229 mmol、9.314 μmol·min-1,故k+0也可以通过其斜率得到.A/v对1/[S]作图得到一条过原点的直线(图8).根据公式(8),图8中的直线斜率等于(Km×k+0)/Vmax.Km、Vm已知,故k+0可以再次从图8中的斜率得到.不同计算方法求得的k+0见表1.
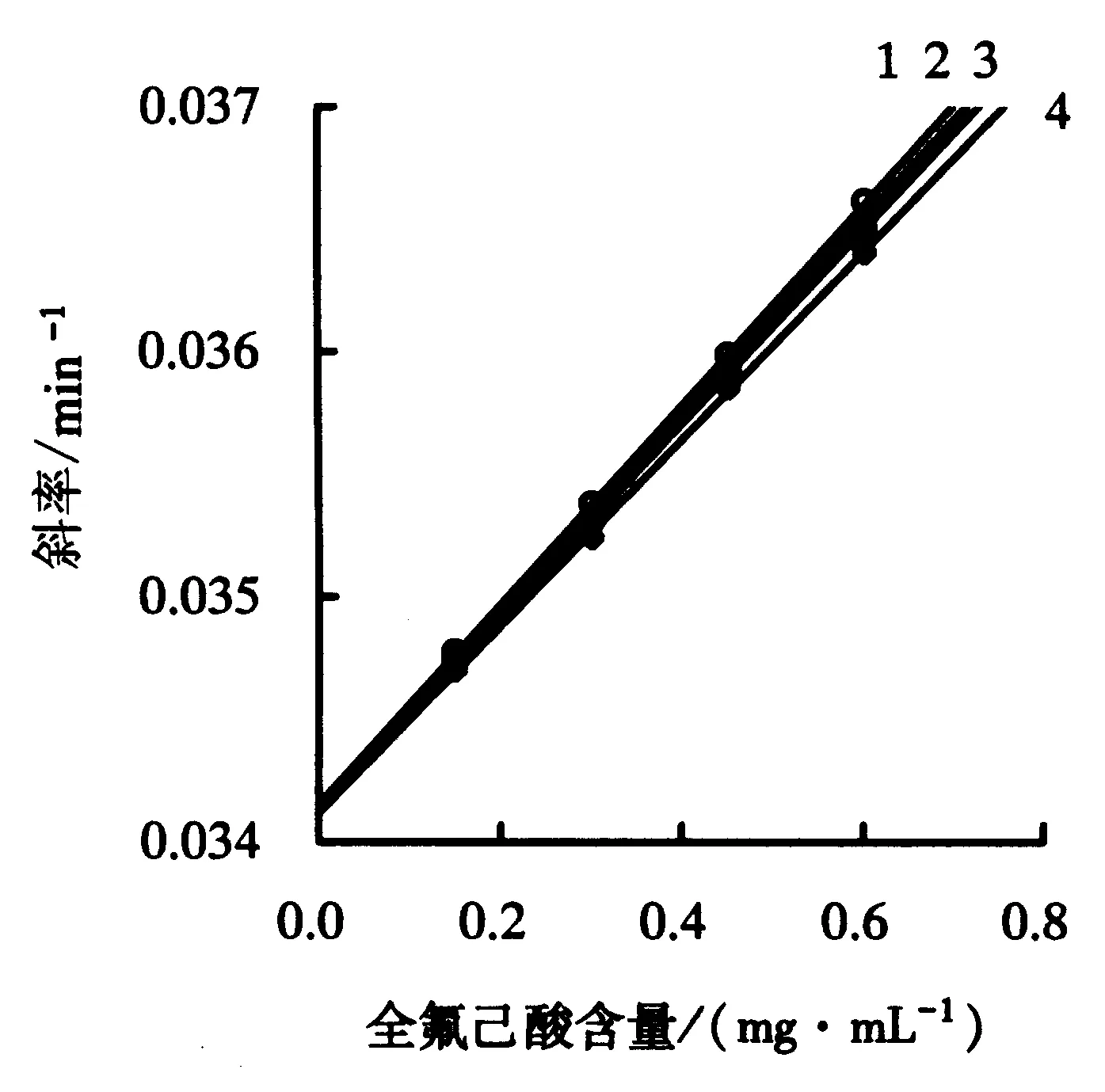
1~4:底物浓度分别为0.20、0.25、0.30、0.40 mmol·L-1.图6 直线图(ln([P]calc-[P]t)对t)的负斜率对[I]作图Fig.6 Second plots of the slopes versus the concentration of perfluorohexic acid [I]
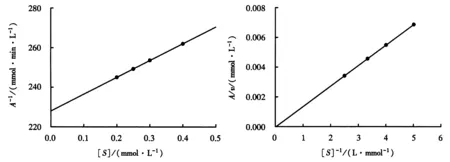
A来自图6中直线的斜率.图7 1/A对[S]作图Fig.7 Plot of 1/A versus substrate[S]concentration
3 讨论
据报道,全氟化合物对斑马鱼胚胎、锦鲤、稀有鮈鲫等生物有一定的毒性作用[15].全氟化合物的碳链长度不同,其毒性也不同,在一定范围内,随着碳链长度的增加,毒性增大[10].由于长碳链全氟化合物危害大而逐渐被禁止使用,因此一些短链型的全氟化合物投入生产.全氟己酸是新型全氟化合物的替代物,为短碳链型,具有生物富集性,不易降解[10],且可以在各种环境介质中被检测出来.而目前关于全氟己酸的研究并不多见,因此,本试验选择其作为抑制剂.本试验结果表明,全氟己酸能有效抑制罗非鱼肝脏NAGase的活力,其IC50为0.29 mg·mL-1.图2、图3显示,全氟己酸对罗非鱼肝脏NAGase的抑制作用为可逆的竞争性抑制,其KI为0.18 mg·mL-1.由于在不同含量的全氟己酸中产物生成速度最后都会趋于直线(图4a),因此,全氟己酸与自由酶分子结合为可逆反应.底物存在的情况下,使用方案1模型、竞争型抑制剂和自由酶作用的动力学模型.根据理论推导,A/v对1/[S]的作图应该为一条过原点的直线,本试验根据试验结果绘制的图8与理论推导结果一致,可以得出结论:全氟己酸为罗非鱼肝脏NAGase的竞争型抑制剂.全氟己酸与底物竞争自由酶,阻碍底物与酶的结合从而影响酶活力,导致其活力降低.表1中的k+0、k-0分别来自于图7中直线的斜率、其在纵坐标上的截距以及图8中直线的斜率,可以看到3个数值几乎相等,说明本试验建立的NAGase在全氟己酸中的反应模型是正确的.

表1 NAGase在全氟己酸中的KI和k+0、k-0Table 1 Inhibitory equilibrium constants and microscopic rate constants for NAGase in perfluorohexic acid solution
a来自于图7中直线的纵轴截距;b来自于图7中直线的斜率;c来自于图8中直线的斜率.
