菌根菌丝网络介导的番茄植株间机械损伤信号的传递
2019-01-25廉法卓林熠斌曾任森宋圆圆
廉法卓, 林熠斌, 胡 林, 王 杰, 曾任森,, 宋圆圆,
(1.福建农林大学生命科学学院;2.福建农林大学作物科学学院作物抗性与化学生态学研究所,福建 福州 350002)
自然界中,同种植物间和不同种植物间是否都存在 “通讯对话”一直是科学家感兴趣的科学问题.比如植物受到虫害诱导产生的挥发性有机物(volatile organic compounds, VOCs)可诱导邻近健康受体植物产生抗虫等防御反应,这些挥发性有机物中的某些成分如茉莉酸甲酯则是植物间进行地上部信息通讯的信号物质[1-3].除此之外,研究发现寄生植物菟丝子在不同寄主间可传递有生态学效应的抗虫系统性信号,通过诱导转录组和代谢物响应来提高抗虫性,并进一步证明菟丝子传导的抗虫系统性信号产生和传播速度非常快(约1 cm·min-1),且可以远距离传递(超过100 cm)[4].可见,植物间的“通讯对话”可以帮助受伤植物和邻近未受伤植物间建立起抗性防御联盟.
菌根(mycorrhiza)是土壤真菌与高等植物营养根系相互作用形成的种间互利共生联合体[5-6].在一个植物群落中,植物菌根菌丝能够在土壤中形成一个密集的地下网络系统——菌根菌丝网络(CMNs,又名菌丝桥),构成植物在地下进行物质交流的通道,进行无机营养物质和有机光合产物等的传递[6-7].本实验室先后发现CMNs可以介导番茄植物间抗病和抗虫防御信号的通讯[8-9],即当供体番茄植株受到病原菌侵染或者昆虫取食后,有CMNs连接的邻近健康受体番茄植株会“偷听”到这种防御信号,促使植物提前做好防御准备,进而提高植物的抗病和抗虫能力.苯丙氨酸解氨酶(PAL)、超氧化物歧化酶(SOD),过氧化物酶(POD)和多酚氧化酶(PPO)参与植物体内多种生理代谢过程,PAL和PPO参与植物酚酸、木质素、类黄酮和香豆酸酯类等抗性物质的合成,这些酶常被用作衡量植物体内抗性防御反应的重要指标[8-12].李朕等[13]研究表明,机械损伤刺槐后,有菌根侵染的植物以及与受伤植物有菌根菌丝桥连接的受体刺槐幼苗的PAL和POD酶活性更高.此外,机械损伤也可诱导玉米直接防御蛋白调控基因β-1,3-葡聚糖基因(PR2)等的表达[14].可见阐明菌根真菌与宿主植物间复杂的协同进化关系,认识菌根菌丝网络独特的生态学功能,可为今后农业生产上利用菌根菌丝网络调节种群个体间的关系以及提高农作物抗性提供理论基础.
关于菌根菌丝网络可介导植物间抗病和抗虫信号的传递已有报道[8-9],而本研究旨在补充阐述供体番茄叶片在机械损伤之后,邻近健康的受体植株可否通过CMNs感应到供体植株受到的损伤信号,并提前启动抗性防御反应.因此,本试验通过对供体番茄进行机械损伤,研究CMNs介导的受体番茄叶片中防御酶和抗氧化酶活性以及叶片和根系中防御相关基因苯丙氨酸解氨酶基因(PAL)和PR2基因的表达情况,对农业生产上利用CMNs介导的防御信号传递来增强作物的抗性具有重要的指导作用.
1 材料与方法
1.1 供试材料
番茄(LycopersiconesculentumMill)种子购于广东省农业科学院,品种为金宝.摩西管柄囊霉(Funneliformismosseae)由青岛农业大学菌根生物技术中心刘润进教授提供,经玉米作为宿主扩繁后使用[15],扩繁后为根系沙子混合物:包括摩西管柄囊霉侵染的根断、菌丝和孢子(每克根系沙子混合物有35个孢子).斜纹夜蛾(SpodopteralituraFabricius)由福建农林大学作物科学学院作物抗性与化学生态学实验室提供.供试土壤取自福建农林大学校内农场砂壤土,土壤过10 mm筛后,121 ℃湿热灭菌30 min,在干热180 ℃条件下灭菌2 h,以杀灭土壤中的真菌孢子.
1.2 试验设计

图1 试验装置示意图Fig.1 Sketch of experiment setup
试验装置如图1所示.
处理A:供体番茄幼苗接种Fm(100 g),供体与受体植株间用30 μm尼龙膜间隔,40 d后两植株间建立CMNs,此时对供体叶片进行机械损伤处理;
处理B:供体番茄幼苗未接种Fm,供体与受体植株间无CMNs,40 d后对供体叶片进行机械损伤处理;
处理C:供体与受体番茄苗均接种Fm(50 g),供体与受体植株间用塑料板隔开,供体与受体植株根系均有菌根真菌侵染,但植株间未形成CMNs,40 d后对供体叶片进行机械损伤处理;
处理D:供体番茄苗接种Fm(100 g),供体与受体植株间用30 μm尼龙膜间隔,两植株间有CMNs,供体植株不进行机械损伤处理.
为避免机械损伤处理供体番茄产生挥发物诱导邻近健康植株产生防御反应,供体番茄在进行机械损伤后用带有可循环通气导气管的塑料袋罩住,保证植物正常气体交换.其中处理B、C和D分别排除了番茄植物根系分泌物、挥发物和菌根本身的影响.从而来验证CMNs可介导番茄植株间机械损伤信号的传递(处理A).
1.3 试验方法
番茄种子经8% H2O2消毒10 min,蒸馏水冲洗3次后放在人工气候箱﹝温度为(25±1) ℃、湿度70%~75%、光照400 μmol·m-2·s-1﹞内催芽生长10 d,选取长势一致的幼苗种植在经0.1% KMnO4溶液消毒的规格为29 cm×13 cm×11 cm(长×宽×高)的塑料盆内(2株·盆-1).塑料盆内装有灭菌的砂壤土2.0 kg,Fm菌剂100 g或50 g,最后覆盖0.5 kg灭菌的砂壤土.对照则是加入等量经高压灭菌(121 ℃,30 min)的Fm菌剂.每个试验处理设置5个重复,随机摆放在玻璃温室中,光周期13 h/11 h (N/D),维持相对湿度在70%~75%,温度(25±1) ℃,每3 d浇1次Hoagland′s完全营养液.40 d后经乳酸酚台盼蓝染色液染色并镜检侵染率.随后对供体番茄机械损伤处理(自顶端向下选取第1、2和3侧枝上的叶片各1片,每侧枝选取第3片完全展开的复叶,滚轮处理3次·片-1,3片·株-1),对照是健康生长的番茄植株.
1.4 测定指标及方法
1.4.1 菌根侵染率 番茄生长40 d后用直径1 cm的打孔器随机取不同处理的番茄根系各100段清洗干净后分别放于2 mL塑料EP管内.首先,加1.5 mL 10% KOH溶液在95 ℃条件下加热10 min;其次,用ddH2O洗净残留的KOH溶液后加0.05%乳酸酚台盼蓝染色液在95 ℃条件下加热染色1 h;最后用ddH2O分色后制片于Olympus BX51显微镜下观察Fm侵染情况[16].菌根侵染率测定采用根段频率标准法[17].
1.4.2 防御酶和抗氧化物酶活性 在机械损伤后的第3、6、12、24、48 h对以上4种处理的番茄叶片取样0.1 g测定酶活性.其中,苯丙氨酸解氨酶(PAL)酶活性测定方法参照中国科学院上海植物生理研究所主编的《现代植物生理学实验指南》[18];过氧化物酶(POD)活性采用愈创木酚法测定[11];超氧化物歧化酶(SOD)活性的测定方法参照陈利锋等[12];多酚氧化酶(PPO)活性测定参照朱广廉[19]的方法.
1.4.3 总RNA提取和cDNA合成 在机械损伤后的第3、6、12、24、48 h,对以上4种处理的番茄叶片和根系取样,液氮研磨,用TrizolTMReagent试剂盒(Invitrogen, USA)提供的方法提取番茄植株总RNA,总RNA经DNaseI处理后,吸取1 μL用于cDNA的合成.cDNA合成体系为20 μL,所用试剂盒为Goscript系列Promega逆转录试剂盒,逆转录得到的cDNA于-80 ℃冰箱冻存备用.
1.4.4 荧光定量PCR分析 依据已报道基因PAL、PR2、番茄组成型表达基因(Ubi3,在此作为内参基因)的序列设计特异引物进行荧光定量PCR,扩增引物见表1.荧光定量PCR反应条件:94 ℃ 3 min,94 ℃ 45 s,退火温度(PAL:53.7 ℃;PR2:51.5 ℃;UBI3:51.5 ℃)30 s,72 ℃ 15 s,39个循环,82 ℃ 1 s.按照康为世纪的UltraSYBR二步法荧光定量PCR试剂盒的程序进行荧光定量PCR反应.引物合成由生工生物工程(上海)股份有限公司完成.

表1 荧光定量PCR所用的特异性引物Table 1 Specific primers for real-time quantification PCR
1.5 数据处理
采用SigmaPlot 10.0软件录入数据和作图,用SPSS 19软件对数据进行统计分析,同一时间点不同处理之间的差异显著性用Tukey′s进行多重比较.
2 结果与分析
2.1 供体和受体番茄根系间菌根菌丝网络的建立
乳酸台盼蓝染色结果表明,处理A和D供体接种Fm后,其供体和受体番茄根系根部都有被侵染,侵染率分别达到62.1%,40.1%和57.1%,35.1%,说明处理A和D成功建立CMNs.处理C供体和受体侵染率分别为45.6%和42.3%,但由于塑料板隔断,故不存在CMNs而处理B由于没有接种Fm,因此供体和受体均未检测到侵染,侵染率为0,说明本处理组未被污染(表2).

表2 接种摩西管柄囊霉40天后供体和受体番茄根系菌根侵染率1)Table 2 Mycorrhizal colonization in ‘donor’ and ‘receiver’ tomato roots inoculated with F.mosseae after 40 days
1)同列不同小写字母表示同一时间点各处理间差异显著(P<0.05).
2.2 供体叶片遭受机械损伤对CMNs连接的受体植株叶片防御相关酶活性的影响
由图2可知,机械损伤处理预先接种Fm的供体番茄叶片后,与供体有CMNs连接的邻近受体番茄叶片防御相关酶活性均有不同程度的提高(处理A).其中,PAL酶活性在3 h时开始升高,至12 h时达到最高,随后持续下降,至48 h时PAL酶活性降至与初始水平相当.其中在机械损伤处理12 h时,处理A的受体番茄叶片中PAL酶活性比对照处理B、C和D分别高出162.1%、97.8%和164.5%.SOD酶活性在6 h时被诱导升高达到最大值,随后处理A的SOD活性则一直高于处理B、C和D,在12 h时处理A的受体叶片中 SOD酶活性比处理B、C和D分别高出69.1%、41.0%和56.0%;处理A中的POD酶活性在检测的5个时间点都显著高于其他3个处理,并在3 h时POD活性达到最强,随后呈逐步下降趋势,其中在12 h时处理A的受体叶片中POD活性比处理B、C和D分别高出230.6%、86.3%和120.9%;而处理A中PPO酶活性在6 h时达到最大值,与处理B、C和D相比,分别提高了54.6%、36.7%和57.0%,至48 h时处理A、B、C和D之间的PPO酶活性无显著差异.此外,在12 h时,处理A中的PPO酶活性与处理C、D并无显著差异.可见,供体番茄受到机械损伤后可以通过CMNs的介导将受伤信号传递给邻近番茄植株,提高叶片防御相关酶活性,使其提前做好防御准备.
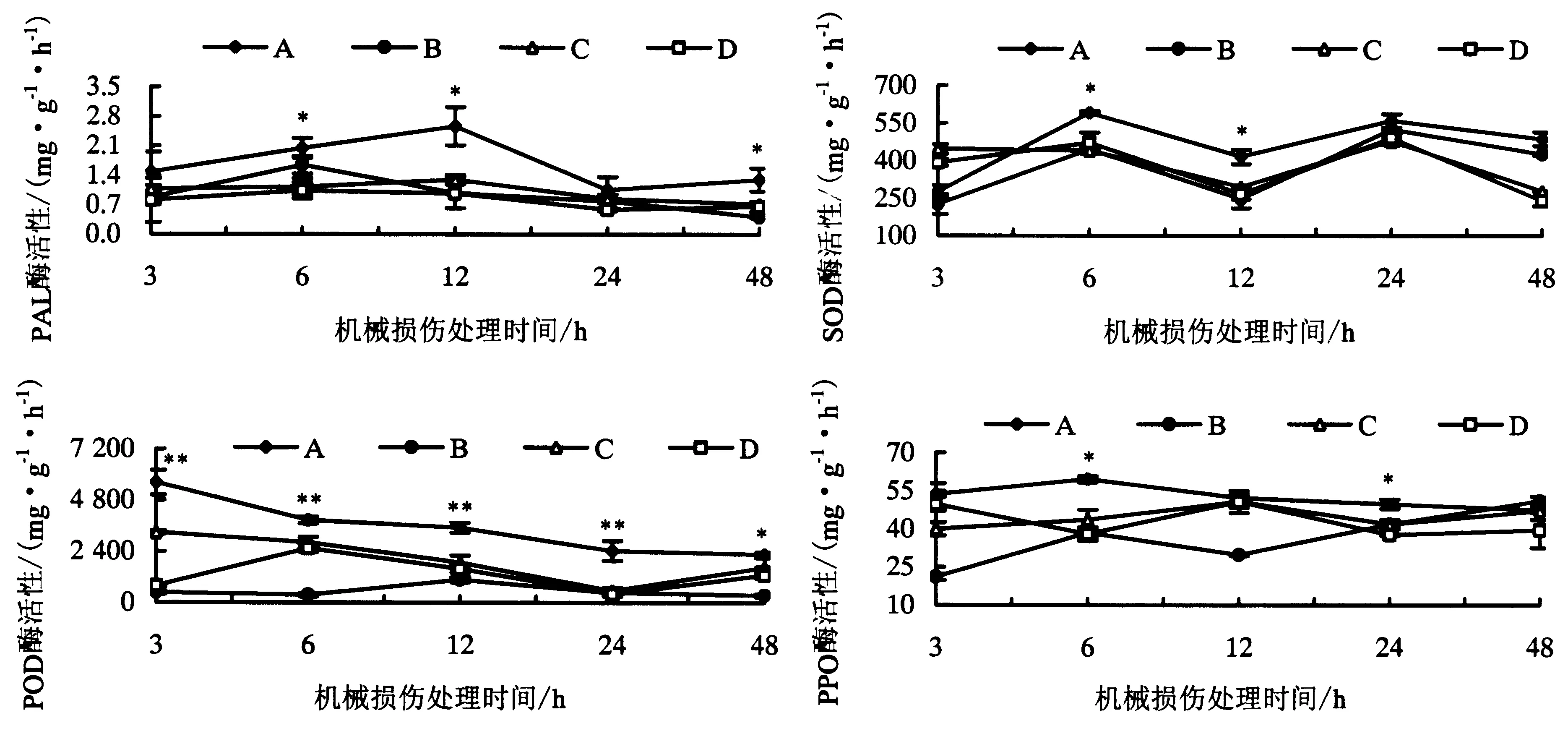
*表示同一时间点各处理间差异显著(P<0.05);**表示同一时间点各处理间差异极显著(P<0.01).图2 机械损伤处理供体番茄植株对有菌根菌丝网络连接的受体植株叶片PAL、SOD、POD和PPO活性的影响Fig.2 Enzyme activities of PAL, SOD, POD and PPO in the leaves of tomato ‘receiver’ plants in response to mechanical damaged CMNs connected ‘donor’ plants
2.3 供体叶片遭受机械损伤对CMNs连接的受体植株叶片和根系防御相关基因表达的影响
如图3所示,荧光定量PCR检测表明,与处理B、C和D相比,机械损伤处理供体番茄叶片后,与供体番茄有CMNs连接的邻近健康受体番茄叶片中(处理A)PAL基因在3、6、12、24和48 h时均被诱导表达,并在12 h时达到最高,PAL基因表达量分别是供体进行机械损伤但无CMNs连接的处理B的3.9倍,是供体进行机械损伤处理但CMNs连接被阻断的处理C的3.7倍,以及供体未进行机械损伤处理但有CMNs连接的处理D的6.6倍.同时,与进行机械损伤处理的供体番茄有CMNs连接的邻近健康受体番茄叶片中PR2在3、6、12、24和48 h时均被诱导表达,各时间段基因表达量分别是处理B的 4.7、2.1、17.3、2.3和3.1倍.无CMNs连接(处理B)、CMNs连接被阻断(处理C)以及有CMNs连接但供体番茄未进行机械损伤处理(处理D)的受体叶片中PR2基因的表达量在3、6、12和24 h时并无显著差异.在受体番茄根系中,与进行机械损伤处理的供体番茄有CMNs连接的受体番茄根系中PAL基因在6、12、24和48 h时均被诱导表达,分别是处理B的4.2、7.2、2.6和2.4倍.CMNs连接被阻断的受体番茄根系中(处理C)PAL基因在12 h时被诱导表达,是无CMNs连接处理B的3.4倍,说明Fm侵染可诱导宿主根系中PAL基因表达.然而,机械损伤处理的供体番茄有CMNs连接的受体植株(处理A)根系中PAL基因的诱导表达效果更显著,分别是处理B、C和D的7.2、2.1和1.2倍.PR2基因在处理A的受体番茄根系中被诱导表达,且随着机械损伤处理时间的延长,PR2基因的表达量呈现先升后降再上升的趋势,并在12 h时达到最高,PR2基因的表达量分别是处理B、C和D的9.0、5.3和12.5倍.由此可见,机械损伤供体番茄叶片后,通过番茄地下CMNs的建立和连接可介导防御信号的传递进而诱导受体番茄叶片和根系中PAL和PR2基因的表达,从而间接提高了邻近受体番茄植株的抗性.
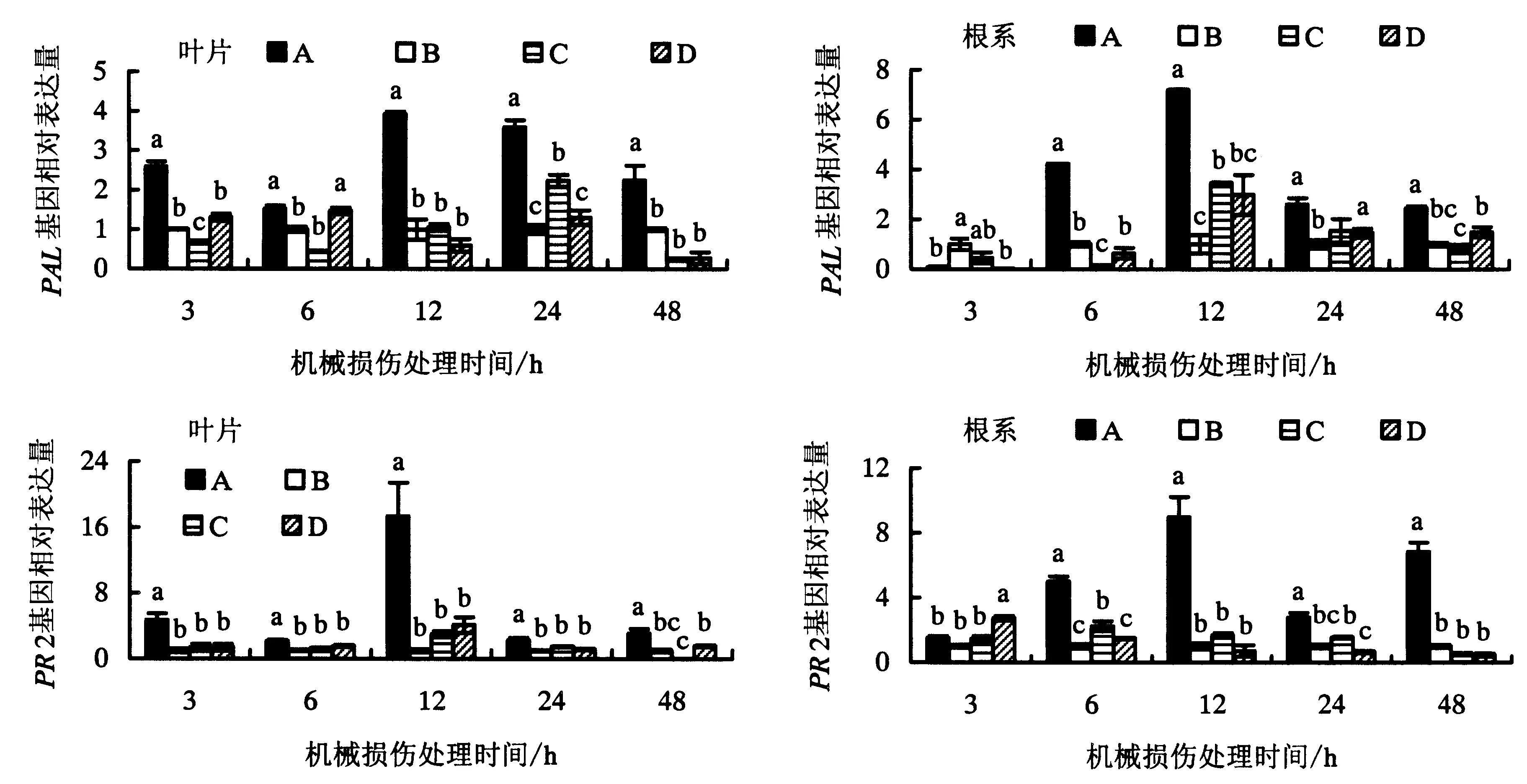
不同小写字母表示同一时间点各处理间差异显著性(P<0.05).图3 机械损伤处理供体番茄植株对有菌根菌丝网络连接的受体植株叶片和根系PAL和PR2基因的相对表达量的影响Fig.3 Relative expression levels of PAL and PR2 in the leaves and roots of tomato ‘receiver’ plants in response to mechanical damaged CMNs connected ‘donor’ plants
3 结论与讨论
近年来已有研究表明,菌根菌丝网络可以参与地下资源的调节.例如,通过放射性和稳定性同位素证明CMNs可以在植株间传递磷[20]和氮[21],并且这种传递是双向的[22].在植物群落中,CMNs会依据不同植物对养分的需求程度来进行分配[23-24].CMNs不仅可以对地下营养物质进行分配,还可以对水分[25-26]和化感物质[27]等进行传输.由此可见,AM真菌能够通过CMNs对土壤资源的重新分配,从而调节宿主植物之间的竞争[28],进而能够改变植物的群落动态,增加群落和生态系统的稳定性和多样性[29-30].此外,谢丽君等[31]研究发现对供体番茄接种早疫病茄链格孢菌(Alternariasolani)后,供体植株通过地下部早已建立的CMNs将抗病信号传递给受体番茄植株,诱导受体番茄产生防御反应.郭涛等[32]研究发现受病害胁迫的供体烟苗能够通过CMNs将胁迫信号传递给受体烟苗,进而增强受体烟苗的抗病性.还有研究表明CMNs还能够介导抗虫信号的传递,例如,Song et al[9]研究发现,对预先接种AM真菌并建立CMNs的番茄植株进行虫害处理后,邻近的未受虫害取食的番茄植株的防御途径被诱导激活,进而提高番茄抗虫性.Babikova et al[27]研究发现蚕豆在被蚜虫采食时,产生的化感物质会通过CMNs传递给周围的蚕豆植株,从而刺激周围的蚕豆植株改变口感使蚜虫不喜欢取食或者散发气味吸引蚜虫天敌到来,以杀灭蚜虫.此外,研究发现接种AM真菌后,机械损伤处理可提高刺槐幼苗POD和PAL活性,而且所形成的CMNs还可介导相应防御信号的传递,诱导邻近植株的POD和PAL活性提高[10].但目前关于CMNs介导的植物之间机械损伤信号传递的研究报道较少,本研究则分别从CMNs介导的受体番茄叶片和根系这两方面系统的证明机械损伤信号确实可以通过CMNs传递给邻居植物,从而使得周围健康植物提前做好防御准备.
植物遭受机械损伤后会产生酚类、萜类、黄酮类和生物碱等一系列次生代谢物质,这些次生代谢物质主要通过苯丙烷类代谢途径生成,PAL和PPO是催化这一途径的关键酶,直接调控酚酸形成量和增加细胞壁木质素抵抗机械压力[33-34].比如当植物遭受切割或伤害时,苯丙烷类代谢被激活,PAL和PPO活性迅速上升[33-34].SOD和POD是植物体内主要的抗氧化酶和活性氧清除剂,参与植物的防御反应过程中[34].刘萌萌等[34]研究发现随着机械损伤强度的增加,冷蒿植株内抗氧化酶活性逐渐增强.作为植物体内抗真菌病的重要物质之一的β-1,3-葡聚糖酶可被多种生物因子和非生物因子诱导表达[35].本研究中,供体番茄植株被机械损伤后,与供体有CMNs连接的邻近健康受体番茄(处理A)叶片中PAL、PPO、SOD和POD活性升高、PAL和PR2基因均在第3 h就被快速诱导表达.与此同时,受体番茄根系中PAL和PR2基因也在6 h被诱导表达.分别比供体进行机械损伤但无CMNs连接的处理B、供体进行机械损伤但CMNs连接被阻断的处理C以及有CMNs连接,但供体未进行机械损伤处理D表达水平要高.可见,在接种Fm建立CMNs后,当供体植物受到机械损伤,可将这种损伤信号通过CMNs传递给受体,并激活受体植株防御酶、抗氧化酶和防御相关基因的表达,来提高植物的防御反应.本试验中处理B、C和D分别排除了番茄根系分泌物的影响、番茄地上部挥发物的影响和Fm侵染本身的影响,如果是由这3种途径介导的植物间的通讯,那么处理B、C和D的受体番茄植物叶片和根系的防御反应应该与处理A相同.试验结果表明只有处理A的受体番茄植株的防御反应最强烈,证明了CMNs可介导番茄植物间机械损伤信号的通讯.
菌根是自然界中一种普遍存在的植物互惠共生现象,而CMNs把很多植物联系在一起.前人已发现CMNs是植物在地下进行物质能量交换、生物胁迫信号传递的通道[15,24-25,33].CMNs介导的通讯比挥发物要稳定得多,不容易受天气影响,可以传输更远的距离,并且菌根可以促进植物生长.因此,地下CMNs介导的植株间通讯比前人发现的挥发物介导的植株间通讯更具有优越性.本研究发现CMNs可以作为番茄植株间机械损伤信号传递的通道,丰富了我们对植物通过CMNs进行地下通讯的认知,但人们对CMNs如何介导各种生物胁迫信号传递的深入分子机制至今仍知之甚少,回答这些问题对菌根生物学的发展和农业生产实践都具有重大的意义.
