百合热激转录因子基因LlHsfC1的鉴定、表达与亚细胞定位
2019-01-25隋娟娟何俊娜于守超义鸣放
曹 兴, 易 瑾, 隋娟娟, 吴 泽, 何俊娜, 于守超, 赵 燕, 义鸣放
(1.聊城大学农学院,山东 聊城 252059;2.中国农业大学园艺学院花卉发育与品质调控北京市重点实验室,北京 100193;3.阜阳师范学院生物与食品工程学院,安徽 阜阳 236037;4.北京师范大学附属中学平谷第一分校,北京 101204)
百合(Liliumspp.)为百合科百合属球根花卉,具有重要的观赏、食药用价值.百合属的大多数种及品种性喜冷凉、湿润气候,耐热性较差.目前,国内主栽的百合品种生育的适温为16~24 ℃,30 ℃以上时,生育受到严重抑制[1].然而我国大部分地区夏季炎热,高温造成百合生长停滞、植株矮小、少花盲花、茎杆软、病虫害严重等现象,严重影响切花的产量和质量,并造成种球退化,制约着我国百合商品化周年生产[2].所以,提高百合耐热性是解决这一问题的关键.
高温胁迫下,植物体内迅速合成热激蛋白(heat shock protein, Hsp),Hsp的大量积累,可作为分子伴侣协助其他相关蛋白的重新折叠、稳定、运输和降解,维护细胞内环境的稳定,使细胞产生对高温的耐受力,从而提高植物的耐热性.热激蛋白的表达受热激转录因子(heat shock transcription factor, Hsf)的调控.热胁迫下,Hsf特异结合在Hsp基因的热激元件(heat shock element, HSE)上,并募集其他转录因子形成转录复合体,导致Hsp基因的转录和Hsp的积累[3].根据寡聚域(oligomerization domian, OD)结构的不同,Hsf可分为HsfA、HsfB 和HsfC三类,A类Hsf含有激活模序(aromatic, large hydrophobic and acidic amino residues, AHA)具有转录激活活性,而B类和C类则缺少AHA[4].目前,研究较多、功能较为明确的是A类Hsf[5-7],C类Hsf的研究较少.在前期研究中,从百合中分离得到了5个A类Hsf基因LlHsfA1[8]、LlHsfA2a[9]、LlHsfA2b[10]、LlHsfA3a和LlHsfA3b[11],研究表明它们参与了百合的热激反应(heat shock response, HSR).
在百合野生种中,麝香百合(LiliumlongiflorumThunb)的耐热性较强,它们的杂交品种也具有较强的耐热性.本研究从麝香百合杂种系‘白天堂’中鉴定了C类热激转录因子基因LlHsfC1,研究它与百合耐热性的关系,进一步丰富百合Hsf参与的热信号转导网络.通过解析耐热百合品种的高温逆境响应机制,鉴定调控耐热性的关键基因,对于采用分子育种手段来提高现有主栽百合品种的耐热性具有重要的理论和实践意义.
1 材料与方法
1.1 材料
试验材料为麝香百合(Liliumlongiflorum)品种‘白天堂’(‘White Heaven’)组培苗,保存于中国农业大学花卉发育与品质调控北京市重点实验室.亚细胞定位使用的材料为紫皮洋葱(Alliumcepa),购买于超市.

表1 PCR引物1)Table 1 Primers applied in PCR
1)下划线表示酶切位点.
试验所用的RNA提取试剂盒、大肠杆菌(Escherichiacoli)DH5α购自天根生化科技(北京)有限公司;DNA片段回收试剂盒、质粒提取试剂盒购自北京百泰克生物技术有限公司;M-MLV逆转录试剂盒、pMD18-T载体、T4连接酶、SalⅠ、SpeⅠ、SmaⅠ等购自TaKaRa公司;荧光定量试剂盒SYBR FAST qPCR Universal Kit购自KAPA公司;卡那霉素(Kan)、氨苄青霉素(Amp)购自Sigma公司;其他常规试剂均为进口或国产分析纯;扩增引物由生工生物工程(上海)股份有限公司合成(表1);DNA测序由北京六合华大基因科技有限公司完成.
1.2 百合HsfC1基因的鉴定及生物信息学分析
根据NCBI(http://www.ncbi.nlm.nih.gov/)GenBank数据库中的百合LlHsf1(AEU17861)的氨基酸序列,进行BLAST比对,选择相似度较高的同源蛋白,用DNAMAN 5软件进行多重比对分析.用EXPASY (https://www.expasy.org/tools/)中的ProtParam、SMART、PSORT、NetPhos等在线工具对蛋白质进行生物信息学分析;用MEGA 5软件构建系统进化树.
1.3 LlHsfC1蛋白亚细胞定位分析
利用DNAMAN 5分析LlHsfC1的ORF序列的酶切位点,结合pCAMBIA1300-GFP载体,选用SalⅠ和SpeⅠ作为融合表达载体构建的酶切位点,并设计上游特异引物SPF1和下游特异引物SPR1进行PCR扩增.双酶切pCAMBIA1300-GFP空载质粒和PCR扩增产物,纯化酶切产物并用T4连接酶连接,获得pCAMBIA1300-LlHsfC1-GFP瞬时表达载体,双酶切和测序验证连接是否成功.用基因枪轰击法[12]将构建好的重组瞬时表达载体轰击到在MS培养基上预培养24 h的洋葱表皮细胞中,空载作为对照.暗培养24 h后在激光共聚焦显微镜(Nikon Eclipse TE2000-E)下进行观察和拍照,并用EZ-C1软件对照片进行分析和处理.
1.4 LlHsfC1基因表达分析
选择生长良好、长势一致的‘白天堂’组培苗作为基因表达分析的材料.
LlHsfC1在热激处理下的表达:用37和42 ℃热激处理百合组培苗,分别在处理1、3、6、12 h取叶片,以22 ℃处理为对照.
LlHsfC1在Ca2+处理下的表达:分别在22和37 ℃下,分别用20 mmol·L-1CaCl2和10 mmmol·L-1EGTA溶液浸没百合组培苗的根部,用去离子水处理作对照,处理1 h后取叶片.
所取组织用液氮速冻并保存于-80 ℃的超低温冰箱中备用提取RNA,然后反转录成cDNA.采用实时荧光定量PCR(real-time fluorescence quantitative PCR, qPCR)的方法检测基因的表达,步骤参照KAPA SYBR FAST qPCR Universal Kit荧光定量试剂盒说明书,仪器为Applied Biosystems Step One System 荧光定量PCR仪.LlHsfC1的扩增引物为qF1和qR1,内参基因18S rRNA的扩增引物为18SqF和18SqR.PCR反应程序为:95 ℃ 3 min;95 ℃ 3 s,56 ℃ 30 s,72 ℃ 20 s,40个循环.每个样品设3个生物学重复,采用2-ΔΔCT法[13]分析基因的相对表达量.
1.5 植物过表达载体pCAMBIA1301-LlHsfC1的构建
利用DNAMAN 5分析LlHsfC1的ORF序列的酶切位点,结合pCAMBIA1301载体,选用SmaⅠ和SalⅠ作为融合表达载体构建的酶切位点.以测序正确的质粒为模板,设计上游特异引物SPF2和下游特异引物SPR2进行PCR扩增,然后连接到pMD18-T载体.双酶切pCAMBIA1301空载质粒和pMD18-T-LlHsfC1质粒,纯化酶切产物并用T4连接酶连接,获得pCAMBIA1301-LlHsfC1过表达载体,双酶切和测序验证连接是否成功.测序正确的质粒用于后续植物转基因研究.
2 结果与分析
2.1 百合LlHsfC1基因鉴定及生物信息学分析
LlHsf1(GenBank登录号JN792932)ORF区序列长为780 bp,编码259个氨基酸(图1).BLAST的结果显示,该基因与其他物种的HsfC1基因有较高的同源性,暂将其命名为LlHsfC1.

图1 百合LlHsfC1基因开放阅读框及编码的氨基酸序列Fig.1 Open reading frame of LlHsfC1 and the predicted amino acid sequences
ProtParam在线工具预测百合LlHsfC1蛋白包含259个氨基酸残基,分子式为C1350H2107N381O385S9,分子质量为30.1 ku.亲水性平均系数(GRAVY)为-0.536(<0),属于亲水性蛋白,不稳定系数为64.28(>40),属于不稳定蛋白,理论等电点(PI)为9.61,属于碱性蛋白.蛋白质磷酸化位点预测工具NetPhos预测LlHsfC1含有22个丝氨酸(Ser)和6个苏氨酸(Thr)潜在磷酸化位点.蛋白质亚细胞定位工具PSORT预测LlHsfC1定位于细胞核内.
将LlHsfC1及与其相似度较高的其他植物的HsfC1氨基酸序列进行同源比对,利用蛋白质结构域预测工具SMART进行分析,结果表明LlHsfC1蛋白具有C类Hsf的典型结构(图2A):在靠近N端18~109个氨基酸残基形成DNA结合结构域(DNA-binding domain, DBD);第124~167个氨基酸残基形成OD,该寡聚域主要由两段疏水性氨基酸残基(hydrophobic amino acid residues A/B, HR-A/B)组成;第178~191个氨基酸残基形成核定位信号(nuclear localization signal, NLS).与百合A类热激转录因子LlHsfA1、LlHsfA2a相比,LlHsfC1缺少AHA模序和核输出信号(nuclear export signal, NES)(图2B).
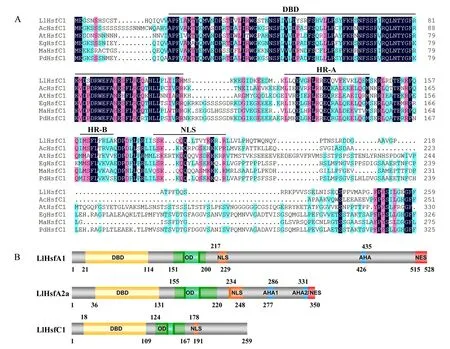
LlHsfC1:Lilium longiflorum百合AEU17861;AcHsfC1:Ananas comosus凤梨XP_020098172;AtHsfC1:Arabidopsis thaliana拟南芥At3g24520;EgHsfC1:Elaeis guineensis油棕XP_010911318;MaHsfC1:Musa acuminata小果野蕉XP_009415170;PdHsfC1:Phoenix dactylifera海枣XP_008810034.A.百合LlHsfC1与其他植物HsfC1氨基酸序列同源比对;B.百合LlHsfC1与LlHsfA1、LlHsfA2a基本结构比较.图2 百合LlHsfC1的基本结构Fig.2 Basic structure of LlHsfC1
将百合LlHsfC1及与其同源性较高的其他植物的HsfC1、拟南芥21个Hsf的氨基酸序列,用MEGA 5构建系统进化树,结果显示Hsf家族可分为A、B、C三类,百合LlHsfC1归属C类.LlHsfC1与同为单子叶植物的海枣(Phoenixdactylifera)HsfC1的亲缘关系最近(图3),相似度达60%.特征结构域和系统进化分析的结果进一步说明LlHsf1基因属于植物HsfC1的同源基因,将其命名为LlHsfC1.
2.2 百合LlHsfC1亚细胞定位
用基因枪将构建好的瞬时表达载体pCAMBIA1300-LlHsfC1-GFP转化洋葱表皮细胞,空载pCAMBIA1300-GFP为对照,通过共聚焦激光扫描显微镜观察绿色荧光蛋白的信号.结果(图4)显示,转pCAMBIA1300-GFP载体的洋葱表皮细胞内绿色荧光分布在细胞质和细胞核中,在细胞核中检测到了LlHsfC1-GFP融合蛋白的荧光信号,表明LlHsfC1主要在细胞核中表达,具备转录因子的基本特征,这与LlHsfC1蛋白含有NLS区域的特征相符.
2.3 百合LlHsfC1基因的表达分析
利用qPCR检测LlHsfC1的表达.结果表明,LlHsfC1的表达受37 ℃和42 ℃热激诱导,在1~12 h内百合叶片中LlHsfC1的相对表达量呈现先上升后下降的趋势;与42 ℃相比,37 ℃热胁迫处理更能显著促进LlHsfC1的持续表达,处理6 h的表达量约为对照的5.70倍(P<0.05)(图5,A).常温条件下,CaCl2或EGTA处理的LlHsfC1的相对表达量与对照差异不显著(P>0.05);37 ℃热胁迫下,CaCl2处理显著促进了LlHsfC1的表达(P<0.05),而EGTA处理则显著抑制了LlHsfC1的表达(P<0.05)(图5,B),表明LlHsfC1可以通过Ca2+信号途径参与百合的热胁迫反应.
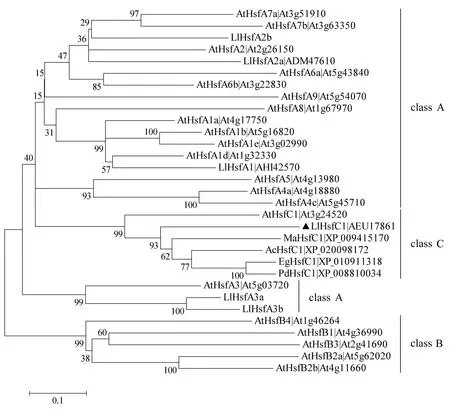
标尺表示进化距离.节点处数值表示bootstrap验证中基于1000次重复该节点可信度的百分比(%).At:Arabidopsis thaliana拟南芥;Ll:Lilium longiflorum百合;Ma:Musa acuminate小果野蕉;Ac:Ananas comosus凤梨;Eg:Elaeis guineensis油棕;Pd:Phoenix dactylifera海枣.图3 百合Hsf与其他植物Hsf系统进化树Fig.3 Phylogenetic tree of LlHsf with other plant Hsf
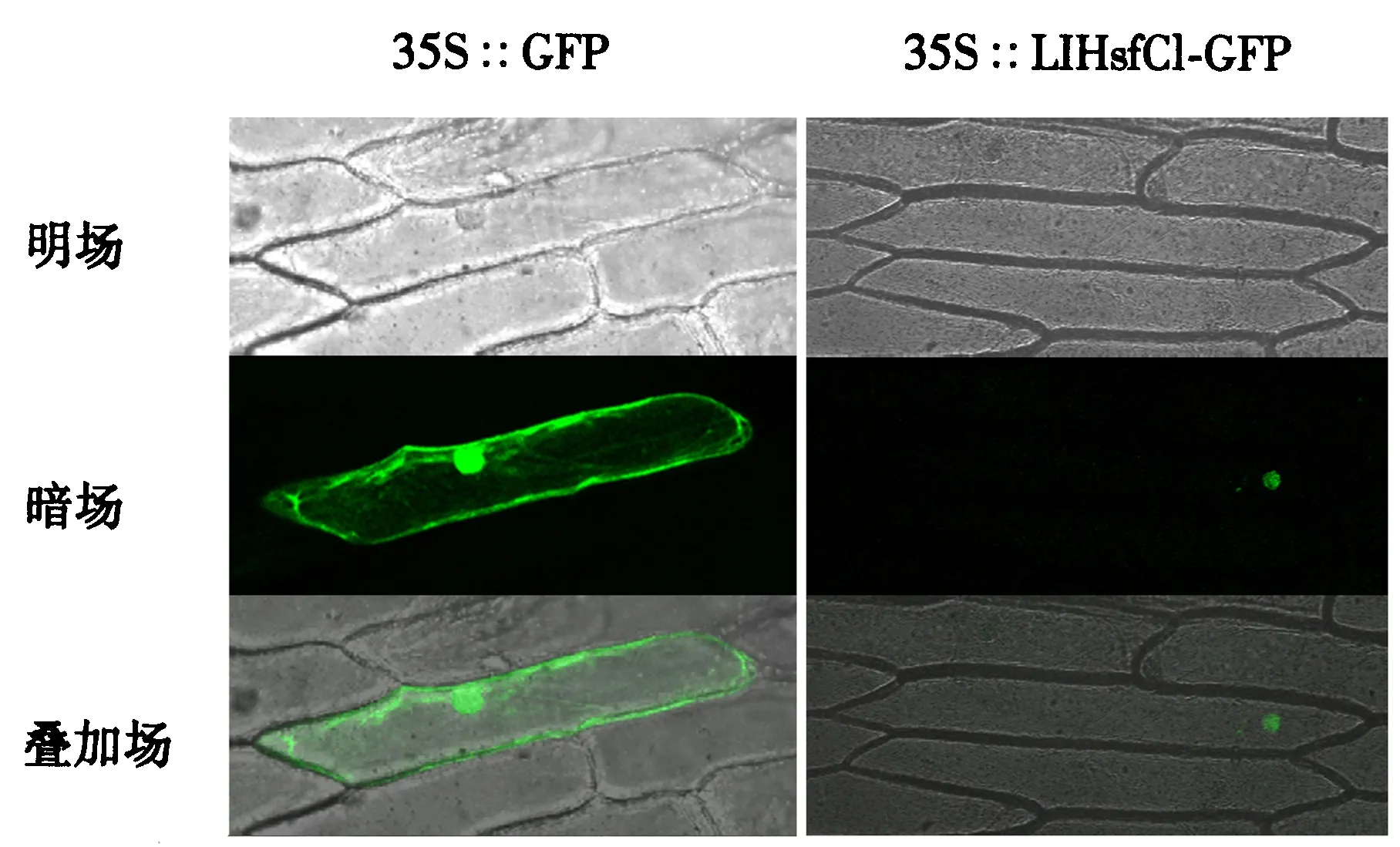
图4 LlHsfC1在洋葱表皮中的亚细胞定位Fig.4 Subcellular localization of LlHsfC1 in onion epidermal cells
2.4 pCAMBIA1301-LlHsfC1植物过表达载体的构建
利用双酶切方法构建了植物过表达载体pCAMBIA1301-LlHsfC1,利用限制性内切酶SmaⅠ和SalⅠ将载体切为2个片段,分别为13 246和786 bp,表明载体构建成功.
3 讨论
目前的研究表明,植物响应高温胁迫的调控途径主要有[14]:热激转录因子—热激蛋白(HSF-HSP)途径、钙离子—钙调蛋白(Ca2+-CaM)途径、活性氧(ROS)途径、激素调控途径和细胞未折叠蛋白响应(UPR)途径.其中,HSF-HSP途径是植物响应热胁迫的基本和主要途径.Hsf的功能与其特殊的蛋白结构密不可分,其主要包括以下几个重要的结构域[4]:DBD、OD、NLS、NES和激活域(activator domain, AD).N端的DBD负责识别并结合HSE;OD由HR-A/B组成,负责Hsf在逆境下形成有活性的同源三聚体,根据OD结构的特征,可将植物Hsfs分为A、B、C三类,A类在HR-A和HR-B之间存在21个氨基酸的插入,C类在此区域存在7个氨基酸的插入,而B类在此区域无氨基酸插入;NLS与OD的C端相邻,是蛋白输入核内所必需的;AD位于C端,它是Hsf中最不保守的部分,其中存在AHA模序,具有转录激活功能,B类与C类Hsf缺少此结构域;有些Hsf的C末端还具有富含亮氨酸的NES,与蛋白向核外输出密切相关.本研究的LlHsf1在HR-A和HR-B之间插入了7个氨基酸残基,不含AHA和NES模序,与HsfC1的同源性较高,因此将其命名为LlHsfC1.LlHsfC1在细胞核中表达,这与其只有NLS的结构和亚细胞定位预测的结果相符,可能行使转录激活或转录辅激活功能.但是与百合的5个A类Hsf相比[8-11],LlHsfC1缺少AHA模序,其是否具有转录激活功能,还需要进一步研究.
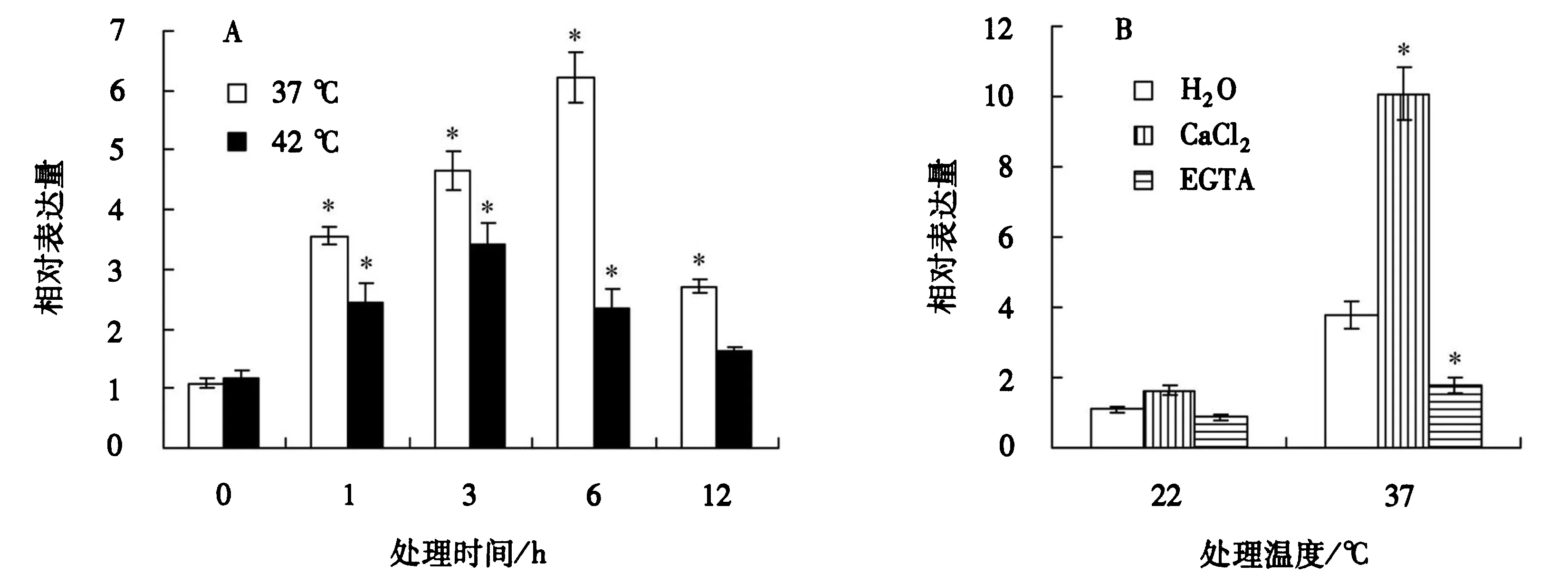
*表示各点与对照的表达量在P<0.05水平差异显著;A.叶片LlHsfC1在37 ℃和42 ℃热激处理下的表达;B.叶片LlHsfC1受Ca2+处理的表达.图5 LlHsfC1在百合中的表达模式分析Fig.5 Analysis of the expression pattern of LlHsfC1 in lily

M:1 kb DNA Ladder Marker;A:SmaⅠ/SalⅠ酶切片段.图6 pCAMBIA1301-LlHsfC1的酶切鉴定Fig.6 Restriction enzyme digestion of pCAMBIA1301-LlHsfC1
A类Hsf含有AHA模序而通常具有转录激活活性.因此,对于植物Hsfs的研究多集中在A类Hsf上:与野生型相比,拟南芥hsfa1a/b/d/e四突变体对高温更加敏感,相关热响应基因表达显著下调[5];番茄HsfA2严格受热激诱导,它在热胁迫和恢复循环中具有较高的激活潜力,并且能诱导Hsp的连续积累[6];大豆GmHsfA1转基因植株的耐热性明显高于野生型[7];拟南芥中过表达百合LlHsfA3a增强了植株的基础和获得耐热性,而过表达LlHsadfA3b提高了植株的获得耐热性[11].近年来,越来越多的证据表明植物B类和C类Hsfs在植物响应高温胁迫的过程中也发挥着重要作用.番茄HsfB1是HsfA1的共激活因子,具有辅助激活的功能[15],但拟南芥HsfB1却是A类Hsf的共抑制因子[16].小麦B2亚家族Hsf基因TaHsf3的表达受热激诱导,在拟南芥中过量表达TaHsf3可提高拟南芥Hsp70的表达水平并显著提高转基因植株的耐热性[17].双子叶植物中C类Hsfs一般由1~2个成员组成,如拟南芥、杨树、番茄均含有1个,而单子叶植物一般由3~5个成员组成,如水稻含有4个,玉米含有5个[18].单子叶植物中C类Hsfs更具复杂性,暗示C类Hsfs在单子叶植物中扮演更重要的角色.例如水稻OsHsfC1b[19]、大白菜C类Hsf基因BraHsf039[20]、小麦TaHsfC2a受热胁迫诱导表达,TaHsfC2a能够转录激活一些热响应基因的表达,提高转基因小麦的耐热性[21].本研究中,LlHsfC1的表达受热激诱导,但与42 ℃的胁迫温度相比,LlHsfC1对37 ℃的响应更加迅速、显著和持久,这与对LlHsfA3a和LlHsfA3b的研究结果类似[11].Zhou et al[22]提出了植物热激信号转导的Ca2+-CaM-HSF途径.在前期研究中表明,Ca2+/LlCaM3可能在HsfA1的上游调控百合耐热性[2].因此研究了CaCl2、钙离子螯合剂EGTA处理对LlHsfC1表达的影响,发现LlHsfC1的表达受热胁迫与Ca2+处理协同诱导,表明LlHsfC1也可能通过Ca2+信号途径参与百合的HSR.
亚细胞定位与基因表达的结果表明LlHsfC1可能与百合的HSR密切相关,但是还需要进一步在模式植物和百合上分析基因功能.本研究构建了植物过表达载体pCAMBIA1301-LlHsfC1,为后续通过转基因来研究LlHsfC1的功能奠定了基础.
