施磷方式对杉木幼苗光合能力及磷素分配的影响
2019-01-25陈智强王讷敏吴文景马祥庆吴鹏飞
杨 振, 陈智强, 王讷敏, 吴文景, 马祥庆, 吴鹏飞
(1.福建农林大学林学院;2.国家林业局杉木工程技术研究中心;3.人工林可持续经营福建省高校工程研究中心,福建 福州 350002)
杉木(Cunninghamialanceolata(Lamb.) Hook.)是我国重要造林树种,在生产生活中应用极为广泛[1],但其大面积分布的南方红壤区有效磷含量极低,难以维持杉木人工林长期生产力.由于磷是植物生长所必需的大量元素之一,是核酸、磷脂、辅酶等物质的重要组成部分,在光合活动中起重要作用[2],因此人工施加磷肥是杉木培育过程中的一种重要手段[3].根系施磷是目前最主要的施磷方式,但有研究表明,根系施磷极易造成磷素浪费且对环境存在一定负面影响,加上世界磷矿资源已相当匮乏[4],亟需探索一种更为合理的施磷方式.
叶面施肥作为一种新型施肥方式,已成为供给植物营养的重要途径[5].叶面施肥可加速植物对营养元素的吸收,无论吸收效率还是施肥效果均优于根系施磷[6-7].根系施磷配合叶面施磷能大大提高蓖麻(RicinuscommunisL.)生物量的积累,并提高了铅胁迫下蓖麻对重金属铅的转运能力,从而起到对土壤铅的修复作用[8].叶面施加磷钾肥能显著提高作物的抗旱耐寒能力[9].胡映全[10]研究发现,根外追肥显著影响银杏(GinkgobilobaL.)光合特性.目前,有关叶面施肥对作物生产力的研究较多,而对林木的影响研究较少,尤其是通过叶片光合能力研究叶面施磷对植株生长力影响的报道甚少.
因此,本试验选择杉木同一无性系幼苗为研究对象,通过设置叶面施磷、根系施磷和不施磷3种供磷方式,采用破坏性室内盆栽试验,利用光合仪及透射电镜等技术,分别于试验前期(幼苗培养60 d)和试验后期(幼苗培养120 d)测定分析不同施磷方式处理下杉木叶片光合特性、荧光参数和叶绿体形态等光合能力指标以及根、茎、叶磷素分配量的变化,探讨叶面施磷方式对杉木光合系统的影响机理,为林木合理叶面施磷提供科学理论依据.
1 材料与方法
1.1 试验材料
试验在福建农林大学林学院温室大棚内进行,选择福建省洋口林场国家杉木良种基地培育的“宽冠型”无性系(061)苗木为试验材料[11].参试材料为一年生苗木,生长健壮,试验初始的平均苗高为40.37 cm,平均地径为4.47 mm.选取口径40 cm、高32 cm的聚乙烯塑料花盆作为培养容器进行栽培试验,培养基质为洗净河沙,每盆装25 kg洗净河沙(过2 mm筛),其有效磷含量为痕量.
1.2 试验设计
于2016年4月20日将参试杉木幼苗栽植于栽培容器中,采取破坏性试验设计,以不施磷处理作为对照处理,设置根系施磷和叶面施磷2种处理,每种处理10个重复.采用1/8浓度的Hoagland营养液(表1)为杉木提供生长所需营养,根系施磷处理以KH2PO4为磷源,叶面施磷处理以NaH2PO4为磷源,并用KCl调节K含量,确保叶面施磷与不施磷处理中营养液K+浓度相同.根系施磷与叶面施磷处理中磷浓度均为3.875 mg·L-1,营养液pH值为5.5.在根部施磷处理中,每5 d浇1次1/8浓度的Hoagland营养液(含KH2PO4)[12],每3 d向叶面均匀喷施纯净水;叶面施磷处理中,每3 d向叶面均匀喷施NaH2PO4溶液,每5 d向根部浇一次1/8浓度的不含磷Hoagland营养液;不施磷对照处理中,每5 d向根部浇1次1/8浓度的不含磷Hoagland营养液,每3 d向叶面均匀喷施纯净水.本试验叶面施磷与根系施磷处理施加P总量一致,叶面喷施量均为每盆每次300 mL,共喷施20次;根部浇施量均为每盆每次500 mL,共浇灌12次.所有处理于每天午后向根部浇水200 mL,以保证苗木生长的正常需水,温室内温度为25~35 ℃,相对湿度>80%,每天光照14 h(光照强度约800 μmol·m-2·s-1).分别于2016年6月19日(参试幼苗培养60 d的试验前期)与8月19日(参试幼苗培养120 d的试验后期)进行不同处理条件下苗木的收获,每次每个处理随机收获5株进行室内指标测定.
1.3 试验方法
杉木光合能力指标分别于试验前期(参试苗木培养60 d)和试验后期(参试苗木培养120 d)上午9:00—11:00进行测定.采用Li-6400光合作用仪(Li-6400, Licor, USA)针状叶室测定不同施磷方式下杉木幼苗叶片的净光合速率(Pn)、蒸腾速率(Tr).测定条件为:叶室温度(23±0.5) ℃,光照强度为1200 μmol ·m-2·s-1,环境CO2浓度370 μmol ·m-2·s-1,叶室流速500 μmol·s-1.
采用便携式叶绿素荧光分析仪(OS-30P, Li-Cor),测定基础荧光参数(Fo)、最大荧光产量(Fm)和最大光化学荧光效率(Fv/Fm)等叶绿素荧光参数.每个试验阶段测定3次,测定时选取杉木幼苗顶端的向阳叶片,由于杉木叶面较窄,故将叶片进行汇聚后用暗适应夹夹住叶片中部,充分暗反应20 min后测得数据.
叶绿体形态测定:采集新鲜叶片迅速洗净后置于戊二醛固定液中固定,置于冰箱中4 ℃条件下过夜,然后取出样品,用锋利刀片将样品切成小块,磷酸缓冲液清洗3次,每次15 min,2%锇酸溶液4 ℃条件下固定2 h,PBS清洗3次,每次15 min,50%、70%、80%、90%、100%乙醇梯度逐级脱水,丙酮置换2次,依次在丙酮∶包埋剂为2∶1、1∶1、1∶2(体积比)的浸渍液及纯包埋剂中进行浸渍,于65 ℃条件下包埋剂中聚合48 h.修块后用Leica EM UC7进行超薄切片,切片厚度70 nm,醋酸双氧铀及醋酸铅双重染色,FEI Tecnai G2 Spirit透射电子显微镜观察、拍照.
苗木收获时将参试幼苗根、茎、叶分离,分别烘干、测定生物质干重、粉碎,采用HNO4-HCLO4消煮法[13]进行消煮,利用电感耦合等离子体发射光谱仪(ICP-OES, PekinElmer, USA)测定植物不同器官的磷含量,并计算不同器官的磷素分配量及全株磷素积累量[14-15].

表1 不同施磷方式1/8浓度Hoagland营养液配方Table 1 Formula of 1/8 concentration of Hoagland solution for different treatments
1.4 数据统计与分析
采用SPSS 16.0软件进行双因素方差分析,检验试验持续时间(前期和后期)与施磷方式(叶面施磷、根系施磷和不施磷)2个因素对所测得杉木幼苗各光合能力指标是否存在交互作用,并进行不同试验持续时间下各施磷方式处理之间的差异性分析(P=0.05).采用Origin 9.0作图,图中的值为平均值±标准差.采用PhotoShop CS6软件进行叶绿体图像的形态分析.
2 结果与分析
2.1 不同施磷方式对杉木幼苗光合特性的影响
从表2可以看出,试验持续时间与施磷方式对蒸腾速率(Tr)的影响存在极显著的交互作用(P<0.01),但对净光合作用速率(Pn)的交互作用未达显著水平(P>0.05),从单个因素来看,试验持续时间对Pn和Tr的影响均达极显著水平(P<0.01),施磷方式对Pn的影响未达显著水平,但对Tr的影响达显著水平(P<0.05).

表2 试验持续时间与施磷方式对杉木叶片光合特性的影响1)Table 2 Effects of application duration and method on the photosynthetic characteristics of Chinese fir needles
1)*,P<0.05;**,P<0.01;ns,P>0.05.
如图1所示,就试验持续时间而言,试验后期叶片的Pn和Tr均显著高于或高于试验前期.对施磷方式来说,无论试验前期还是试验后期,不同施磷方式对Pn的影响均不显著;在试验前期,不同施磷方式对Tr的影响不显著,在试验后期,不施磷处理的Tr显著低于其他两组处理.
2.2 不同施磷方式对杉木幼苗叶绿素荧光参数的影响
试验持续时间与施磷方式对基础荧光参数(Fo)、最大光学量子产量(Fv/Fm)的交互作用均达极显著水平,但对最大荧光参数(Fm)的交互作用未达显著水平.从单个因素看,随着试验持续时间的延长,不同施磷方式对Fm的影响均未达显著水平(P>0.05)(表3).
试验前期,不施磷处理的Fo显著高于叶面施磷与根系施磷处理,Fv/Fm显著小于叶面施磷与根系施磷处理;试验后期,根系施磷处理的Fo显著低于叶面施磷与不施磷处理,Fv/Fm显著高于叶面施磷与不施磷处理(图2).

不同小写字母表示不同试验时期不同施磷方式处理间差异显著(P<0.05).图1 不同试验时期不同施磷方式对杉木叶片Pn和Tr的影响Fig.1 Effect of P application methods on Pn and Tr in the earlier and later stages of the trial

因素自由度F值FmFoFv/Fm试验持续时间(a)12.365ns44.275**89.369**施磷方式(b)23.093ns30.148**61.130**a×b20.114ns13.013**40.579**
1)*,P<0.05;**,P<0.01;ns,P>0.05.
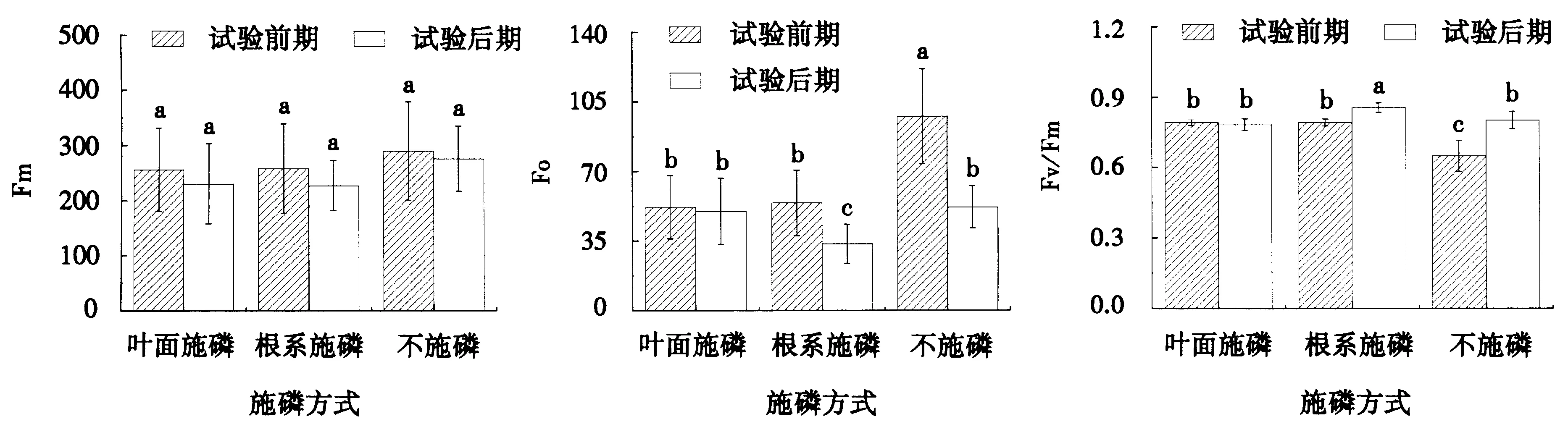
不同小写字母表示不同试验时期不同施磷方式处理间差异显著(P<0.05).图2 不同试验时期不同施磷方式对杉木叶片Fm、Fo和Fv/Fm的影响Fig.2 Effect of P application method and duration on Fm, Fo and Fv/Fm of Chinese fir in the earlier and later stages of the trial
2.3 不同施磷方式对杉木幼苗叶绿体形态的影响
杉木培养60 d(试验前期),不同处理叶绿体结构相对完整,片层结构清晰,叶绿体外膜平滑清晰,呈现出较完整的膜系统.但叶面施磷处理下,叶绿体背向细胞壁拱起,叶绿体狭长消瘦,排列稀疏(图3A);根系施磷中,叶绿体大而饱满,呈规则的椭圆状,紧贴于细胞壁,排列紧密(图3B);不施磷处理中,叶绿体肿胀,由梭形或椭圆形变为近半圆形,紧贴细胞壁,排列紧密(图3C).
试验持续至120 d,从杉木针叶的叶绿体亚细胞结构来看,叶面施磷与根系施磷处理膜结构变得模糊,片层结构扭曲模糊且叶面施磷方式出现大而多的嗜锇颗粒,分布密集(图3D、3E);不施磷处理叶绿体膜结构与片层结构均较为清晰,出现较多小而稀疏的嗜锇颗粒(图3F).从叶绿体的分布及数量来看,不施磷处理叶绿体结构较为饱满,但其与细胞壁分离,向细胞中心移动,数量较少(图3I),叶面施磷与根系施磷处理叶绿体紧贴细胞壁分布,与不施磷处理相比,其叶绿体数量更多,但出现不同程度的溶解现象,叶面施磷比根系施磷溶解更为严重(图3G、3H).

A:叶面施磷后60 d;B:根系施磷后60 d;C:不施磷后60 d;D、G:叶面施磷后120 d;E、H:根系施磷后120 d;F、I:不施磷后120 d.图3 不同试验时间不同施磷方式对叶绿体超微结构的影响Fig.3 Effect of P application methods on the ultrastructure of chloroplast in different experiment stages
2.4 不同施磷方式对杉木幼苗磷素分配的影响
双因素方差分析结果(表4)表明,试验持续时间对杉木根部磷素分配量的影响达到极显著水平(P<0.01),施磷方式对杉木根、叶及全株的磷素分配量的影响达极显著水平(P<0.01),而两因素对叶、茎、叶部及全株磷素分配量的交互影响均未达到显著水平(P>0.05).如图4所示,试验前期各处理对杉木各器官磷积累量的影响差异性均不显著;在试验后期,根系施磷处理的根部、茎部磷分配量及整株磷累积量显著高于不施磷处理,叶面施磷处理的叶部磷分配量显著高于不施磷处理.

表4 试验持续时间和施磷方式对杉木磷素分配量的影响1)Table 4 Effect of P application time and method on P distribution pattern of Chinese fir
1)*,P<0.05;**,P<0.01;ns,P>0.05.
3 讨论
叶片是植物进行光合作用的主要场所,光合速率是反映光合作用强弱的重要指标.陈智裕等[16]研究发现,在低磷或不供磷处理中,杉木幼苗的光合效率、蒸腾速率等指标明显降低.根系增施磷肥能显著提高水稻(Oryzasativa)的叶片净光合速率与根茎叶部磷含量[17].与根系施肥相比,叶面施肥更高效,吕晓飞等[18]研究发现,叶面喷施磷酸二氢钾能提高谷子(Setariaitalica)的净光合速率.在本研究的试验前期(苗木培养60 d),叶面施磷、根系施磷、不施磷3种施磷方式对杉木幼苗的净光合速率及蒸腾速率影响不大,而在试验后期(苗木培养120 d),叶面施磷与根系施磷净光合速率、蒸腾速率显著高于不施磷处理,这表明长期施磷处理对植物的净光合速率及蒸腾速率具有促进作用[19].

不同小写字母表示不同试验时期不同施磷方式处理间差异显著(P<0.05).图4 不同试验时期不同施磷方式对杉木磷素分配量的影响Fig.4 Effect of P application method on P distribution pattern of Chinese fir in the earlier and later stages of the trial
PSⅡ最大光学量子产量(Fv/Fm)是反应中心光能转换效率的指标,表示植物受到逆境影响的程度[20],本研究的试验前期,不施磷处理的PSⅡ最大光学量子产量显著低于叶面施磷与根系施磷处理,这说明施磷能提高植物的光能转换效率,而在试验后期,不施磷与叶面施磷处理的PSⅡ最大光学量子产量均显著低于根系施磷处理,这表明长时间的叶面施磷与不施磷处理的PSⅡ反应中心均明显遭受到损伤[21].从叶绿体形态结构的完整性来分析,本研究发现,在叶面施磷处理下,杉木幼苗培养前期叶绿体结构相对完整,但在试验后期,由于磷素直接进入叶片,在叶肉细胞中逐渐富集,以致对叶绿体形成高磷胁迫,叶绿体出现了十分严重的溶解现象,造成叶绿体结构破坏.这是由于叶绿体在进行正常代谢活动的同时,也会产生活性氧,正常情况下,叶绿体会调动自身酶系统对活性氧进行清除[22],但在胁迫条件下会造成活性氧短时间内大量增加,对叶绿体膜系统造成损伤[23-24].
研究表明,叶片是杉木重要的养分储存库[25],叶面施磷能显著提高植物叶部的磷分配量[26].当根系供磷时,由根系吸收的磷素营养依次满足根、茎、叶的需求,运输到叶时,磷的含量以大大减少,但若根部供应磷素过多,植物也会过量吸收,造成叶绿体的损伤[27].本试验中,根系施磷显著提高了植物各部位的磷吸收积累量[28],但在试验后期,叶绿体超微结构也遭到轻微破坏,这与前人研究结果具有一致性[27].有趣的是,在不施磷处理中,叶绿体结构相对完整,但叶绿体会脱离细胞壁,向细胞中心移动,这可能是叶绿体对低磷胁迫的一种响应机制[29].由于本研究中为保证不同处理中供K含量的一致性,在叶面施磷处理中采用喷施NaH2PO4溶液进行试验,而其中Na+对植物的光合作用具有一定的刺激作用[30],也有可能对叶绿体对低磷胁迫的形态生理学响应变化产生影响,这在今后研究中,应综合分析各元素对植物光合生理的影响,以明确磷素在植物光合作用中扮演的角色,为供磷丰缺情况对叶片光合机理的影响机制提供更为科学的理论支撑.
4 结论
不同的施磷方式会对杉木幼苗光合系统造成不同的影响,叶面施磷与根系施磷方式均能促进叶部磷积累量,提高杉木幼苗的净光合速率、蒸腾速率及最大光化学荧光效率,但过量的叶面施磷会造成叶绿体膜结构受损,导致叶绿体溶解,叶绿体超微结构破坏;低磷胁迫下叶绿体从细胞壁向细胞中心运动.今后应进一步研究叶面施磷浓度对植物光合作用的影响,以充分发掘叶绿体适应磷胁迫的响应机制,这对于指导林业生产实践中合理施肥具重要意义.
致谢:福建农林大学林学院何宗明研究员对本试验数据的统计与分析给予了指导帮助;福建农林大学林学院2017届本科生吴其恒、林杉杉、向硕等同学参加盆栽及室内分析工作,特此致谢!
