极限pH对羊肉宰后成熟过程中肌原纤维蛋白特型的影响
2019-01-25张社奇张德权
王 颖,李 欣,李 铮,朱 杰,张社奇,张德权,*
(1.中国农业科学院农产品加工研究所,农业部农产品加工重点实验室,北京 100193;2.西北农林科技大学理学院生物物理研究所,生物力学与工程研究室,陕西杨凌 712100)
评价肉类品质的指标主要有嫩度、多汁性、风味、色泽和系水力等,嫩度是评价肉品质的最重要的指标之一[1-2]。影响嫩度的因素国内外报道很多。研究表明,宰后嫩度和肌肉极限pH有关。Silva等[3]研究发现,肌肉极限pH和嫩度呈线性正相关(r=0.83),然而Purchas等[4]研究发现肉嫩度和极限pH呈曲线相关。在2008年,Jeleníková等[5]和Pulford等[6]发现,高极限pH组和低极限pH组中的肉嫩度比中极限pH组的嫩度高。2014年,Wu等[7]和Lomiwes等[8]研究也得到相同结论。
宰后肉成熟过程中,嫩度逐渐发生变化。其主要是由肌原纤维蛋白降解引起的[9]。在肌原纤维蛋白中,肌联蛋白是骨骼肌蛋白中分子量最大的蛋白,约为3000 kDa,约占肌原纤维蛋白的10%,且起始于M线,终止于Z线,维系着整个肌小节完整性和稳定性;伴肌动蛋白,起始于Z线至细肌丝蛋白末端,联结着Z线[9-10],肌间线蛋白是联结Z线的中细丝的重要组成部分。以上这些蛋白受肌肉pH影响,且在宰后肌肉成熟过程起着重要的作用[11]。另外,肌钙蛋白-T为肌细丝蛋白,主要结合原肌球蛋白,其降解会破坏肌细丝的完整性,改变肌动蛋白和肌球蛋白之间的相互作用,导致肌原纤维的片段化[12]。另外肌原纤维小片化指数是表征宰后肉嫩度的一个快速指标[13-14]。研究表明,高极限pH促进肌联蛋白和肌间线蛋白降解[7-8],本研究旨在研究极限pH如何影响其他肌原纤维蛋白降解,进而影响肌原纤维小片化指数变化。选取50只羊右侧背最长肌为研究对象,按照宰后2 d的pH将肉样分成三组:高极限pH组(5.72±0.03)、中极限pH组(5.54±0.01)和低极限pH组(5.40±0.02)。不仅研究极限pH对肌联蛋白、伴肌动蛋白、肌间线蛋白和肌钙蛋白-T降解的影响,且分析了以上肌原纤维蛋白和宰后成熟过程中肌原纤维小片化指数变化的关系,为宰后肌肉成熟过程中嫩化机理提供理论基础。
1 材料与方法
1.1 材料与仪器
大尾寒羊 选取大尾寒羊50只,按照清真屠宰方式屠宰;SYPRO Ruby染色液 美国Invitrogen公司;蛋白酶抑制剂 德国Roch公司;蛋白浓度测定试剂盒 美国Pierce Chemical公司;鼠抗-肌间线蛋白抗体(D1033)、羊抗鼠IgG抗体(A9044) 美国Sigma公司;鼠抗-肌钙蛋白-T抗体(ab130003) 英国Abcam公司;ECL显色剂、乙二胺四乙酸(EDTA)、三羟甲基氨基甲烷(Tris Base)、十二烷基硫酸钠(SDS)、丙烯酰胺(Acrylamide)、甲叉双丙烯酰胺(Methylene diacrylamide)、过硫酸铵(APS)和四甲基乙二胺(TEMED) 美国Sigma公司;酒石酸钾钠、氢氧化钠、氯化钠、硫酸铜、乙醇、乙酸和吐温-20等 分析纯,国药基团化学试剂有限公司。
FCR1000-UF-E超纯水机 青岛富勒姆科技有限公司;ML204/02电子天平 上海梅特勒-托利多有限公司;磁力搅拌器 天津欧诺仪器仪表有限公司;Ultra Turrax Dispersen S25匀浆机 德国IKA公司;Himac CR 22 GII高效冷冻离心机 日本HITACHI公司;SpectraMax 190全波长酶标仪 美国Molecular Devices公司;D37520小型离心机 德国Sigma公司;TS-2型水平脱色摇床 海门市其林贝尔仪器制造有限公司;电泳设备(Criterion Cell system)、ChemiDocTMMP凝胶成像系统、聚偏二氟乙烯(PVDF)膜和湿法转膜设备 美国Bio-Rad公司。
1.2 实验方法
1.2.1 样品分组 本实验选取50只饲养方式相同8月龄的大尾寒羊,公羊。平均羊胴体重约为(18±1) kg,放置4 ℃,7 d。在宰后1 h、1、2、3、5、7 d时,测定胴体右侧背最长肌pH,随后留取样品使用液氮速冻,放置-80 ℃保存。将宰后2 d的pH作为极限pH,按照pH将肉样分成3组,每组6只羊,即低极限pH组(5.40±0.02),中极限pH组(5.54±0.01)和高极限pH组(5.72±0.03)。
1.2.2 pH测定 使用便携式自动温度补偿pH计测定每个时间点时宰后肉中的pH。测定pH时,每个样品在不同地方测定三次。
1.2.3 蛋白提取 肌原纤维蛋白的提取参照高星等[15]的方法:将1 g肌肉组织加入6 mL预冷的蛋白提取液(100 mmol/L Tris Base,10 mmol/L DTT,pH8.3,蛋白酶抑制剂(50 mL/片))中,用匀浆机进行匀浆(2次,每次30 s),然后离心(10000×g,4 ℃,30 min),得到沉淀(肌原纤维蛋白)。沉淀溶解于5% SDS溶液(60 ℃)后匀浆30 s,80 ℃加热20 min,即得到肌原纤维蛋白溶液。蛋白浓度使用BCA试剂盒测定。
1.2.4 聚丙烯酰胺凝胶电泳(SDS-PAGE)和荧光染色 分离肌联蛋白和伴肌动蛋白条带的聚丙烯酰胺凝胶电泳参考Wang等[16]的实验方法。肌原纤维蛋白和还原性上样缓冲液(100 mmol/L)Tris-HCl(pH6.8)、10 mmol/L 二硫苏糖醇(DTT)、40 g/L SDS、1 g/L溴酚蓝、250 g/L甘油)等体积混合后,沸水浴加热3 min。混合液在10160×g,离心1 min。上清液(上样量为30 μg)加入5%的凝胶(甲叉丙烯酰胺∶双甲叉丙烯酰胺=37.5∶1)进行电泳,(5%分离胶,4%浓缩胶)。电泳时的条件为恒定电流10 mA,约4 h。
电泳后,首先使用固定液(50%(v/v)甲醇,10%(v/v)乙酸)固定两次,之后水洗三次,使用SYPRO Ruby染液染色避光过夜,两次脱色(10%乙醇,7%乙酸),每次30 min。水洗三次,每次5 min。使用ChemiDocTMMP凝胶成像仪扫描凝胶。
1.2.5 肌间线蛋白和肌钙蛋白-T的免疫印迹 肌间线蛋白和肌钙蛋白-T在宰后过程中的降解情况使用免疫印迹测定,其中方法参考Li等[17]的方法测定。首先,进行SDS-PAGE电泳,肌间线蛋白分离胶为12%,而肌钙蛋白-T的分离胶为15%,两者皆为4%的浓缩胶。其中的电泳条件为:浓缩胶70 V,分离胶110 V。电泳后,使用湿法转膜装置将蛋白转移到PVDF膜上。使用TBS(10 mmol/L Tris Base,150 mmol/L NaCl,pH7.5)漂洗膜三次后,用含有3%牛血清白蛋白、0.05%Tween-20的封闭液封闭2 h。之后将使用封闭液稀释的抗体孵育4 ℃过夜。随后使用TBST1(含0.1% Tween-20的TBS溶液)漂洗三次后与羊抗鼠IgG抗体(用封闭液1∶2500稀释)室温孵育2 h。然后使用TBST2溶液(0.05 mol/L Tris Base,0.15 mol/L NaCl,0.1% Tween-20,pH7.5)漂洗3次,最后使用ECL显色剂显色,并使用ChemiDocTMMP凝胶成像仪拍照。
采用Quantity One软件分析蛋白免疫印迹条带灰度值。其中肌间线蛋白的抗体为1∶1000的鼠抗-肌间线蛋白抗体和肌钙蛋白-T的抗体为1∶1000的鼠抗-肌钙蛋白T抗体。另外电泳过程中的标准样品为高极限pH组宰后1 h的肌原纤维蛋白样品。
1.2.6 肌原纤维小片化指数(MFI) 参考Rajagopal等[18]的方法测定羊肉宰后成熟过程中肌原纤维小片化指数,其中操作过程稍作修改。约0.5 g的肌肉加入5 mL的预冷的缓冲液(100 mmol/L KCl,20 mmol/L K2HPO4,1 mmol/L EDTA,1 mmol/L MgCl2,pH7.1),匀浆30 s,两次,中间间隔1 min。匀浆液离心3000×g,15 min。倒去上清,重悬,离心两次。之后再使用缓冲液将沉淀重悬,使用双缩脲法测定蛋白浓度。将蛋白浓度调成0.5 mg/mL,使用分光度计在540 nm下测度体系的吸光值。肌原纤维小片化指数为该吸光值乘以200。
1.2.7 数据分析 pH、肌原纤维小片化指数数据和肌间线蛋白相对灰度值均采用SPSS 19.0统计软件处理。其中pH和肌原纤维小片化指数使用非饱和模型进行多因素方差分析。肌间线蛋白相对灰度值使用单因素方差分析。且两种分析方法均选择多重比较检验方法,通过最小显著差异法(Least significant difference,LSD)进行差异显著性分析。显著水平为p<0.05,极显著水平为p<0.01。线性拟合分析使用Excel 2010。数据表示为平均值±标准误差。
2 结果与分析
2.1 羊宰后成熟过程中肌肉pH的变化
宰后成熟过程中三组肌肉pH变化如图1所示。所有样品的pH在宰后1 d内均极显著下降(p<0.01)。在高极限pH组和中极限pH组中,肌肉pH在宰后1 d后无显著变化(p>0.05)。而在低极限pH组中,pH一直下降至宰后5 d。这可能是由于在低极限pH组中的糖原含量较高,糖酵解进程使得乳酸在宰后1 d仍在积累,使宰后pH持续下降。而低极限pH组宰后7 d的pH显著高于宰后5 d的pH(p<0.05),这是由于在宰后后期,蛋白质被蛋白酶作用会产生多肽、小肽,这些物质和脱羧基产生胺类物质、脱氨基产生NH3等物质。这些分解产物多数为两性分子或显碱性的物质,对肌肉内的pH具有缓冲作用,所以肌肉的pH又能够有所回升[19]。在宰后2、3、5 d和7 d时,高极限pH组的pH显著高于中极限pH组的pH,且中极限pH组中的pH显著高于低极限pH组的pH(p<0.05)。
图1所示,结果表明三组肌肉中pH在宰后2 d已达到极限pH,因为宰后2 d的pH与之后的pH相比没有显著差异(p>0.05)。该结果和Bouton等的研究[20]结果是不一致的。Bouton等发现羊肉在1~2 ℃保存时,宰后3 d到达极限pH。这是由于本实验贮存的温度稍高,糖酵解速率较快,达到极限pH时间较早。另外,高极限pH组的极限pH显著高于中极限pH中的极限pH,同时中极限pH组的极限pH也显著高于低极限pH组的极限pH(p<0.05),宰后肌肉成熟过程中,糖酵解产生的乳酸是引起肌肉中pH变化的主要因素,且宰后肌肉的糖原含量决定了肌肉极限pH[20]。在高极限pH组和中极限pH组中的糖原含量也许较低,产生的乳酸含量也相应较低,故两组肌肉中的极限pH较高。
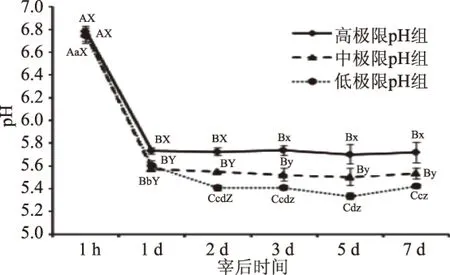
图1 羊宰后成熟过程中肌肉pH的变化Fig.1 Change of pH in postmortem ovine muscle注:X-Y-Z表示同一时间点不同组的pH差异极显著(p<0.01);x-y-z表示同一时间点不同组的pH差异显著(p<0.05);A-B-C表示同一组不同时间点pH差异极显著(p<0.01);a-b-c表示同一组不同时间点pH差异显著(p<0.05)。
2.2 极限pH对肌联蛋白和伴肌动蛋白降解的影响
在宰后过程中肌原纤维蛋白进行SDS-PAGE电泳,肌联蛋白和伴肌动蛋白的蛋白条带如图2所示。肌联蛋白的降解过程由T1降解为T2。另外宰后7 d内,高极限pH组、中极限pH组和低极限pH组中肌联蛋白降解过程如图3所示。高极限pH组中的肌联蛋白降解较快,即宰后1 d时出现降解条带T2。而在宰后1 d时,中极限pH组和低极限pH组中并没有出现降解条带T2。在中极限pH组中,降解条带T2 在宰后2 d时出现。而在低极限pH组出现降解条带的时间点为宰后5 d。这表明肌联蛋白在高极限pH组中降解较快,该结果与Wu等[7]的结果是一致的。这是由于在高极限pH组中的μ-钙蛋白酶的活性较高引起的。μ-钙蛋白酶是钙蛋白酶体系中的一种酶,它能够降解大多肌原纤维蛋白,是嫩化肉品、提高肉品嫩度重要的内源性蛋白酶[21]。其最适pH接近中性[22-23]。在高极限pH组中,pH接近中性,使得μ-钙蛋白酶发生很快自溶,降解为78 kDa的条带,该降解条带具有较高的活性,从而加快肌联蛋白降解。

图2 高极限pH组中肌原纤维蛋白宰后7 d内SDS-PAGE凝胶电泳分析Fig.2 SDS-PAGE analysis of myofibrillar proteins degradation within 7 d postmortem from the high pHu group
伴肌动蛋白在宰后7 d内的降解情况如图3所示。中极限pH组中伴肌动蛋白在宰后1 d时开始出现降解条带,但在高极限pH组和低极限pH组中并没有出现降解直至宰后2 d伴肌动蛋白开始出现降解现象。该结果说明伴肌动蛋白在中极限pH组中降解较快。在宰后肉嫩化过程中促进蛋白降解的蛋白酶并非仅仅是钙蛋白酶系统,这也许是由溶酶体中释放出的组织蛋白酶引起的。牲畜在宰杀后,由于糖原的分解作用使肌肉内产生乳酸,pH会随之下降。当胴体内的pH降至5.5时,不仅能减缓钙激活因子的活性,而且随着乳酸的增多,还能引起细胞内溶酶体破坏。这一变化会导致溶酶体释放出相当数量的酶,其中有许多组织蛋白酶[24]。该酶可以水解肌原纤维蛋白,且该酶最适pH是偏于酸性[25],接近中极限pH组的pH。这些水解酶在宰后成熟后期中的作用需要进一步的研究。
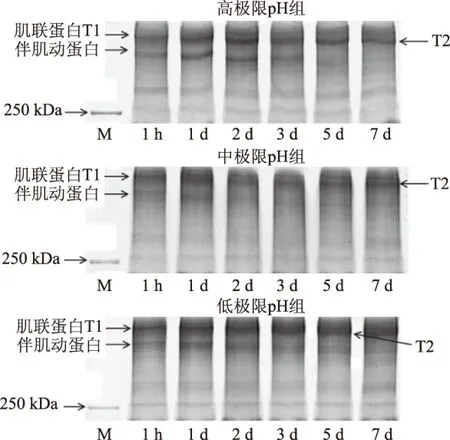
图3 高、中和低极限pH组中肌联蛋白和伴肌动蛋白宰后7 d的降解情况Fig.3 Titin and nebulin degradation within 7 d postmortem from three groups
2.3 极限pH对肌间线蛋白降解的影响
肌间线蛋白的亚基的分子量约54 kDa,是一种围绕Z盘分布并延伸到Z盘内部,位于Z线以及Z线和肌细胞膜之间的重要的骨架蛋白。其在成熟的肌细胞中,该蛋白在稳定肌纤维的横向结构中起着非常重要的作用[12]。高极限pH组、中极限pH组和低极限pH组中的肌间线蛋白宰后7 d内的降解情况如图4A所示。在图4A中,高极限pH组中原肌间线蛋白条带降解较快。在图4B中,肌间线蛋白相对灰度值在高极限pH组持续显著下降至宰后2 d(p<0.05),在中极限pH组中明显下降至宰后5 d,而在低极限pH组中宰后7 d内一直持续显著下降(p<0.05)。在宰后1、2、3 d时,高极限pH组中的肌间线蛋白的相对灰度值明显低于中极限pH组的相对灰度值,且低极限pH中的肌间线蛋白的灰度值最高(p<0.05,图4B)。这是由于肌间线蛋白是μ-钙蛋白酶分解的底物[17],在低极限pH组中,μ-钙蛋白酶活性较低,原肌间线蛋白降解速率较慢,使肌间线蛋白的相对灰度值明显较高。

图4 高极限pH组、中极限pH组和低极限pH组中肌间线蛋白在宰后7 d内免疫印迹Fig.4 Immunoblot of desmin within 7 dpostmortem from three groups注:肌间线蛋白降解条带分别是38 kDa和35 kDa;ST为标准样品,即高极限pH组宰后1 h的肌原纤维蛋白样品;x-y-z表示同一时间点不同组的肌间线蛋白相对灰度值差异显著(p<0.05),a-b-c表示同一组不同时间点肌间线蛋白相对灰度值差异显著(p<0.05)。
2.4 极限pH对肌钙蛋白-T降解的影响
肌钙蛋白-T是一种分子量约35 kDa的重要调节蛋白,该蛋白降解成分子量为28~30 kDa小分子。大量实验表明该蛋白和肉的嫩度密切相关[26],可作为肉嫩度改善的一个标志[12]。高极限pH组、中极限pH组和低极限pH组中的肌钙蛋白-T在宰后过程中的降解过程如图5所示。在宰后1 d时,高极限pH组已明显出现降解条带。中极限pH组的肌钙蛋白在宰后1 d时也开始出现降解条带,但降解条带模糊。低极限pH组中,在宰后1 d时没有出现降解条带,在宰后2 d才开始发生降解。免疫印迹结果表明,肌钙蛋白-T在高极限pH组中降解较快。分析原因为肌钙蛋白-T属于肌原纤维蛋白,是μ-钙蛋白酶降解的底物,当μ-钙蛋白酶活性受到抑制时,该蛋白降解速率减慢[27-28]。而在Lomiwes等[11]研究中高极限pH组中的μ-钙蛋白酶活性较高,肌钙蛋白-T在高极限pH组降解较快。
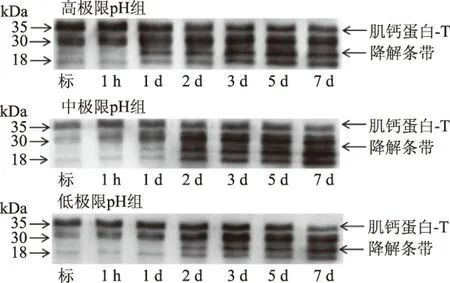
图5 高极限pH组、中极限pH组和低极限pH组中肌钙蛋白-T在宰后7 d内的降解情况Fig.5 Immunoblot of troponin-T within 7 d postmortem from three groups注:标准样品为高极限pH组宰后1 h的样品。
2.5 肌原纤维小片化指数(MFI)
高极限pH组、中极限pH组和低极限pH组中肌原纤维小片化指数在宰后7 d内的变化情况如图6A所示。在宰后1 d内,高极限pH组中的肌原纤维小片化指数迅速显著增高(p<0.05),之后没有显著变化(p>0.05)。在中极限pH组中,宰后3 d内肌原纤维小片化指数一直处于上升的趋势,之后没有发生显著变化(p>0.05)。在低极限pH组中,肌原纤维小片化指数在宰后7 d内缓慢上升。在宰后1、2、3、5、7 d时,高极限pH组和中极限pH组的肌原纤维小片化指数显著高于低极限pH组中的肌原纤维小片化指数(p<0.05)。肌原纤维小片化指数是表征宰后嫩度的一个快速指标[13],本研究结果表明高极限pH组和中极限pH组的肌肉嫩度高于低极限pH组的嫩度。
另外,对三组中肌原纤维小片化指数进行线性拟合,如图6B所示。高极限pH组中肌原纤维小片化指数的变化速率(k=6.5057)高于中极限pH组的变化速率(k=5.5598),且中极限pH的变化速率高于低极限pH组的变化率(k=4.3381)。这主要是由高极限pH组和中极限pH组中的肌原纤维蛋白降解较快引起的[29]。高极限pH组中的肌联蛋白、肌间线蛋白和肌钙蛋白-T皆为肌原纤维蛋白中的关键蛋白,且为μ-钙蛋白酶的降解底物。当μ-钙蛋白酶活性较高时,则这些蛋白降解迅速。另外,中极限pH组中的伴肌动蛋白降解较快,故高极限pH组中和中极限pH组中的MFI明显高于低极限pH组的MFI,且变化速率较快。

图6 高极限pH组、中极限pH组和低极限pH组中肌原纤维小片化指数宰后7 d的变化情况Fig.6 Change of myofibril fragmentation index(MFI) within 7 d postmortem from three groups注:x-y-z表示同一时间点不同组的肌原纤维小片化指数差异极显著(p<0.05),a-b-c表示同一组不同时间点肌原纤维小片化指数差异显著(p<0.05);A:肌原纤维小片化指数;B:肌原纤维小片化指数线性拟合图。
3 结论
在宰后肌肉成熟过程中,肌联蛋白、肌间线蛋白、肌钙蛋白-T在高极限pH组中降解较快,而伴肌动蛋白在中极限pH组中降解较快。此结果表明,μ-钙蛋白酶对肌联蛋白、肌间线蛋白和肌钙蛋白-T的降解引起肌原纤维的片段化,促进宰后前期肌肉嫩化进程。而伴肌动蛋白或许是由于剩余的μ-钙蛋白酶和组织蛋白酶降解来促进了宰后后期的嫩化进程的。本研究不仅为高极限pH组嫩度较高提供了依据,而且为宰后肉嫩度形成机理提供理论基础。另外本研究对有关组织蛋白酶的研究欠缺,需进一步研究组织蛋白酶对肌原纤维蛋白降解机理,进而揭示该酶在宰后成熟过程中的重要作用。
