端粒重复序列结合因子1在子宫内膜癌的表达及与临床病理特征的相关性研究
2019-01-25郭静于宵张军
郭 静 于 宵 张 军
子宫内膜癌(carcinoma of endometrium)在女性生殖系统恶性肿瘤前三位,占女性生殖道恶性肿瘤的1/3左右,占女性癌症总数的8%左右[1-2]。子宫内膜癌的具体发病机制还不明确,病因包括遗传、长期雌激素刺激、体质因素等[3-4]。人类的端粒是端粒DNA和端粒蛋白的复合物,其组成是染色体末端的几千个双链TTAGGG重复序列,有利于维护染色体末端稳定性。端粒功能异常将导致细胞衰老和染色体不稳定,也可导致机体肿瘤发生[5-6]。端粒酶是1种能将端粒DNA加以延长的酶,其功能是合成染色体端粒的重复序列,以维持端粒长度的稳定性[7]。基础研究表明,端粒长度和结构的维持及端粒酶活性受到端粒结合蛋白的调控,正常体细胞不表达或仅低表达端粒酶活性,人类肿瘤细胞和永生化细胞系端粒酶活性表达增高[8-9]。人端粒重复序列结合因子(telomeric repeat binding factor 1,TRF1)是端粒长度的负调控因子,是最重要的端粒结合蛋白之一,其也通过干扰端粒酶与染色体末端的结合,从而对端粒长度进行调控[10]。TRF1表达的相关性研究有助于丰富子宫内膜癌的发病机制与临床特征,从而指导治疗[11]。本试验采用免疫组织化学技术检测TRF1在子宫内膜癌组织与癌旁组织中的表达,探讨其与子宫内膜癌患者临床病理特征参数的相关性,现报告如下。
1 材料与方法
1.1 标本来源
采用回顾性、总结研究方法,2013年9月到2017年6月选择在我院妇产科进行手术诊治的子宫内膜癌患者120例的癌组织标本与癌旁组织标本作为研究对象,纳入标准:术前未接受放疗、化疗及激素治疗;有完整的临床病理资料;病理检查诊断为子宫内膜癌;癌旁组织与离癌组织距离≥3 cm;手术方式为子宫内膜癌分期手术(广泛子宫切除术、双附件切除及盆腔淋巴结清扫术);医院伦理委员会批准了此次研究。排除标准:妇科内分泌疾病及生殖道炎症;妊娠与哺乳期妇女标本。
在120例患者的组织标本中,年龄45~78岁,平均年龄(65.33±4.21)岁,年龄≥60岁60例;分化程度:高分化80例,中分化20例,低分化20例;临床分期:Ⅰ期60例,Ⅱ期40例,Ⅲ期20例;病理类型:子宫内膜腺癌70例,浆液性乳头状腺癌30例,透明细胞癌20例;淋巴结转移30例;肌层浸润50例;形态:局灶型50例,弥漫型70例。
1.2 免疫组化方法
兔抗人TRF1多克隆抗体(ab1423)来自北京中杉金桥生物技术有限公司,DAB酶底物显色剂来自广州深达生物制品技术有限公司,Tris-EDTA抗原修复液购自北京博士德公司,EnvisionTM+加强型免疫组化试剂盒(兔/鼠双标)购自DACO公司。
所有患者的癌组织标本与癌旁组织标本取材后,甲醛固定、石蜡包埋,制成石蜡切片(4 μm厚)。将切片组织37 ℃烤24 h,3 % H2O2封闭内源性过氧化物酶10 min,抗原修复后加入一抗,湿盒内4 ℃过夜,二抗37 ℃孵育30 min。DAB显色,脱水封片后在光学显微镜观察。取已知阳性组织切片作为阳性对照,以PBS代替一抗作为阴性对照。
1.3 观察指标
TRF1蛋白表达阳性为胞质内出现棕黄色细颗粒,染色强度阴性为0分、染色强为3分、染色清晰为2分、染色弱但强于阴性对照为1分。阳性细胞数<10%为0分,>60%为3分,31%~60%为2分,10%~30%为1分。上述二种评分相加0~1分为(-),2分为(+),3~4分为(++),5~6分为(+++)。镜下顺序放大200倍,每张切片随机选取10 个视野,(++)例数+(+++)例数/组内例数×100.0%=阳性率,都由病理科医院进行判定。
1.4 统计学处理
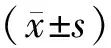
2 结果
2.1 TRF1表达阳性率对比
子宫内膜癌组织中TRF1表达阳性率分别为90.8%,癌旁组织为28.3%,对比有统计学意义(P<0.05),见表1。

表1 不同组织中TRF1表达阳性情况
2.2 TRF1表达与临床病理特征参数的相关性
在子宫内膜癌组织中,TRF1的表达阳性率随着分化程度的降低、临床分期的增加、肌层浸润深度的加深、淋巴结的转移而显著增高(P<0.05);TRF1表达阳性率与患者年龄、大体类型、组织类型无关(P>0.05),见表2。
2.3 相关性分析
在子宫内膜癌组织中,Spearman等级相关分析显示:TRF1表达与临床分期、肌层浸润、淋巴结转移呈显著正相关性(P<0.05),与分化程度呈显著负相关性(P<0.05),见表3。
3 讨论
子宫内膜癌是严重危害女性健康的疾病,当前在我国的发病率有上升趋势,已对女性的生命和健康造成了严重的威胁[12]。已有研究发现,在子宫内膜癌患者存在血糖异常,多伴随有肥胖、高血压、糖尿病等基础疾病[13]。子宫内膜癌的发生发展的确切的分子生物学机制还不明确,细胞增殖与凋亡的失衡是宫内膜癌发生的重要机制[14]。
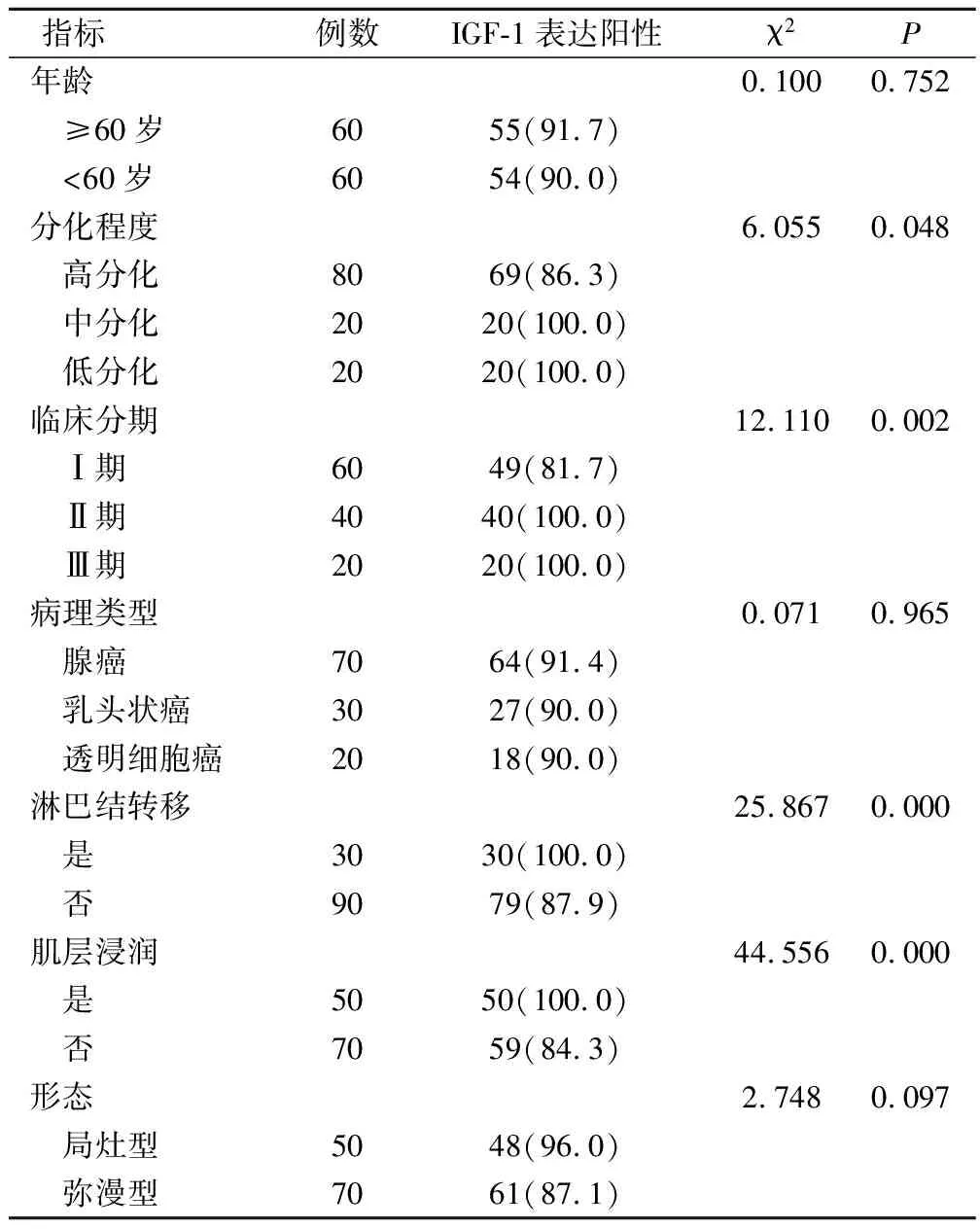
表2 TRF1表达与临床病理特征参数的相关性(例,%)
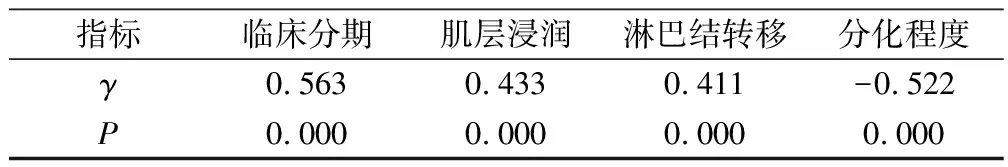
表3 子宫内膜癌组织TRF1表达的相关性分析
端粒是调节细胞增殖与凋亡的重要分子结构之一,端粒、端粒酶及端粒调节系统在肿瘤发生中起重要作用。有研究显示接近90 %的恶性肿瘤的端粒酶活性高于正常组织,且增高的程度可能与患者的病情与预后有关端粒是存在于真核生物线性染色体末端,端粒的主要作用在于维持染色体的稳定与完整,其功能的发挥主要是依靠端粒长度和端粒结构的保持[15]。端粒酶、端粒结合蛋白和核糖基转移酶等共同调控细胞端粒长度,其中端粒酶是RNA依赖的1种特殊的DNA多聚酶,能以自身RNA为模板逆转录合成端粒DNA序列并添加至染色体末端,从而延长端粒[16]。端粒调控除端粒酶的作用外,TRF1是另外的1个端粒结合蛋白。TRF1分子量约60 kD,由439个氨基酸组成,过表达TRF1可导致端粒逐渐和持续性缩短。基础研究表明当TRF1高表达时,可保护端粒末端;而当TRF1下降时,从而降低了对端粒末端的保护,导致细胞具有了永生性[17]。本研究显示,子宫内膜癌组织中TRF1表达阳性率分别为90.8%,癌旁组织为28.3%,对比有统计学意义(P<0.05)。有学者通过免疫组化研究发现TRF1蛋白的表达在慢性肝炎、肝硬化、肝癌患者逐渐增强,特别是在肝癌患者中的TRF1蛋白表现为强阳性[18]。不过也有学者对颅脑肿瘤进行免疫组织化学染色发现TRF1的表达阳性率明显低于正常组织、炎症及良性肿瘤[19]。
子宫内膜癌的发生是1个相对复杂的过程,也是多种因素综合作用导致的病变。端粒酶是维持端粒长度的主要途径,端粒酶活性又受到端粒结合蛋白的调控[20]。TRF1是第1个被发现的哺乳动物的端粒结合蛋白,它与端粒双链DNA结合,可阻止端粒酶与端粒的结合,改变端粒的结构,从而阻止端粒的延长。基础研究表明TRF1是端粒延长的1个抑制因子,呈负反馈调节端粒的长度,TRF1变异或缺失会造成端粒延长并延长细胞寿命[21]。不同肿瘤组织中的TRF1表达水平结果不尽一致,但是均以表达在细胞浆为主。本研究显示,在子宫内膜癌组织中,TRF1的表达阳性率随着分化程度的降低、临床分期的增加、肌层浸润深度的加深、淋巴结的转移而显著增高(P<0.05)。Spearman等级相关分析分析显示TRF1表达与临床分期、肌层浸润、淋巴结转移呈显著正相关性(P<0.05),与分化程度呈显著负相关性(P<0.05)。从机制上分析,如果癌细胞的端粒比较长,表明具有比较高的端粒酶活性和高TRF1表达;如果癌细胞的端粒比较短,表明具有比较低的的端粒酶活性和低TRF1表达[22]。特别是在细胞有丝分裂过程中,端粒的长度逐渐缩短,如果细胞内的某些抑癌基因如P53、Rb突变,细胞周期就会发生变化,导致端粒继续缩短,最终导致细胞死亡[23]。但有如果有部分细胞在此阶段激活端粒酶,染色体形态得到稳定,端粒酶功能恢复,可导致正常细胞发展成为肿瘤细胞[24]。不过对于TRF1与子宫内膜癌关系的研究还很有限,具体的机制还有待进一步分析。
综上所述,TRF1在子宫内膜癌组织中呈现高表达状况,与临床病理特征有很好的相关性,可用于指导进行临床诊断与治疗。
