间充质细胞外泌体促进小鼠胰岛内皮细胞血管生成的研究
2019-01-23陈俊秋陈津黄梁浒赵红州付云烽林娜朱凌峰程远航王水良谭建明
陈俊秋 陈津 黄梁浒 赵红州 付云烽 林娜 朱凌峰 程远航 王水良谭建明
胰岛移植是治疗糖尿病的有效方法[1]。2000年Shapiro等[2]首次报道临床同种异体胰岛移植,使1 型糖尿病患者完全脱离胰岛素。根据国际胰岛移植随访结果显示,胰岛移植可以改善血糖水平,1年后57%的患者摆脱胰岛素依赖[3]。然而胰岛移植效果在一定程度上受到移植胰岛血管生成障碍所限制[4]。胰岛属内分泌组织,分泌的激素直接释放入血,因此是一个高度血管化的组织细胞团,其周围的毛细血管网比外分泌组织的密度大5倍。丰富的毛细血管网络为胰岛提供信号、营养物质和氧气等,维持胰岛存活和胰岛功能[5-6]。异体胰岛移植后,由于新血管尚未生成,无血管期的胰岛因缺血、缺氧等引起胰岛细胞大量凋亡[7]。此外高浓度的免疫抑制药物的使用也影响胰岛新血管的生成[4]。因此,提高移植胰岛血管生成能力对提高胰岛移植效果具有重要的意义。
间 充 质 细 胞(mesenchymal stem cells,MSC)在体内外均能延长胰岛的存活时间,起到保护胰岛的作用,但是机制尚未明确[8]。MSC外泌 体(Exosomes) 是 由MSC分 泌 的 直 径 为30 ~ 100 nm的微小膜泡,具有脂质双层结构,可以携带MSC的膜蛋白、胞内蛋白、mRNAs和miRNAs,影响靶细胞的许多病理生理功能,如抑制免疫细胞增殖和活性,促进血管生成等[9-10]。MSC外泌体是否能促进胰岛血管生成,进而提高移植胰岛存活率,还尚未见到相关报道。本研究以小鼠胰岛内皮细胞MS-1为模型,探讨低氧条件下,MSC外泌体对小鼠胰岛血管生成的影响。
材料与方法
一、材料
DMEM高糖、低糖培养基、0.25%胰酶-EDTA、胎牛血清(美国Hyclone公司);超滤离心管(3 kDa,美国Millipore公司);Matrigel胶(美国BD公司);BCA蛋白定量试剂盒(美国Thermo公司),磷酸酶抑制剂(美国ROCH公司),蛋白酶抑制剂(美国Millipore Calbiochem 公 司);鼠 抗 β-actin、CD63、CD81,兔抗血管内皮生长因子(vascular endothelial growth factor,VEGF)、HIF1-α、CD9、Flotilin 1 抗体(美国Abcam公司);兔抗p-mTOR、mTOR抗体(美国CST公司);辣根过氧化物酶标记的山羊抗鼠和山羊抗兔二抗(美国Thermo公司);ECL显色液(美国Thermo公司);碳膜支持铜网、磷钨酸染液(中佳科镜公司)。
二、方法
1.细胞培养:人脐带MSC由福建省干细胞应用工程技术研究中心提供,采用含胎牛血清10%的低糖DMEM培养基,按照本实验室的培养方法进行培养[11]。胰岛内皮细胞MS-1购自中国科学院上海细胞库,细胞培养在含5%胎牛血清的高糖DMEM培养基中,隔天换液。
2. MSC条件培养基制备及外泌体的提取:取生长至80%~ 90%的第4代MSC细胞,弃去培养基,PBS洗涤2遍,加10 ml无血清培养基,放入培养箱中,37 ℃、2 % O2、5%CO2低氧培养48 h, 1 200×g离心10 min去除细胞碎片。上清液用0.22 μm的抽滤器过滤后加入超滤管上柱中,4 000×g离心60 min,吸取超滤管内富集的外泌体,用BCA蛋白定量试剂盒进行定量。
3.外泌体鉴定:吸取 10 ~ 15 μl外泌体吸附于碳膜支持铜网上,磷钨酸染液负染1 ~ 2 min,PBS洗涤后晾干,透射电镜下观察外泌体形态大小。取30 μg外泌体高温变性后加样电泳并转至PVDF膜,Western Blot方法检测外泌体标志物CD9, CD81,CD63,Flotilin1的表达。
4.体外血管形成试验:Matrigel胶4 ℃冰箱融化后加入到预冷的96孔板中,每孔分别加入MS-1细胞2×104个。低氧+外泌体组(HYP+EXO)每孔加入 10 μg/ml外泌体,常氧对照组(NOR)和低氧组(HYP)分别加入等体积PBS。NOR组放入37 ℃、5 % CO2、21%O2的常氧培养箱培养,HYP和 HYP+EXO 组放入 37 ℃、2 % O2、5 % CO2的低氧培养箱培养;培养24 h后,观察血管网形成情况,并用Image J软件进行分析。
5.细胞mRNA提取及PCR分析:按照本实验室常用的方法[12],提取各组MS-1细胞总RNA,经RNA定量后,反转录成cDNA,分别用Q-PCR和常规PCR方法检测VEGF等血管形成相关基因的表达情况。PCR引物序列如下:VEGF(上游:5'-CACGACAGAAGGAGAGCAGA-3';下 游:5'-CAGGGCTTCATCGTTACAGC-3')。 常 规 PCR结果通过1%琼脂糖凝胶电泳观察结果;Q-PCR结果以各自β-actin为内参,以常氧组为对照,计算2-△△ct值为基因相对表达倍数。
6. Western Blot检测VEGF及相关信号分子的表达:MS-细胞分为NOR组、HYP组和HYP+EXO组,平行培养24 h后,用100 μl裂解液刮下细胞,冰上裂解 10 min,4 ℃、12 000×g离心 30 min,取上清液作为蛋白样本,用BCA蛋白定量试剂盒进行定量。取30 μg蛋白高温变性后加样电泳并转至PVDF膜,4 % BSA封闭1 h,加入兔抗鼠VEGF、p-mTOR、mTOR、HIF1-α一 抗(1 : 2 000稀释)或β-actin内参一抗(1 : 5 000稀释),4 ℃孵育过夜;TBST洗涤3次后,加对应的二抗孵育1 h, TBST洗涤3次后加入ECL发光液暗室曝光成像。
三、统计学分析方法
采用Graphpad Prism 6.0软件进行统计分析。多组间比较采用单因素方差分析,均数间两两比较采用SNK-q检验。以P< 0.05为差异有统计学意义。
结 果
一、MSC外泌体分离鉴定结果
收集MSC低氧条件培养基,经超滤离心法富集后,获得MSC培养上清液中的外泌体。经磷钨酸负染,透射电镜检测,获得的外泌体直径大小为30 ~ 100 nm 的微粒(图 1)。经 Western Blot检测,所获得的外泌体表达CD9,CD63,CD81等外泌体标志物(图 2)。

图1 电镜下观察外泌体的形态大小(磷钨酸负染,×50K)
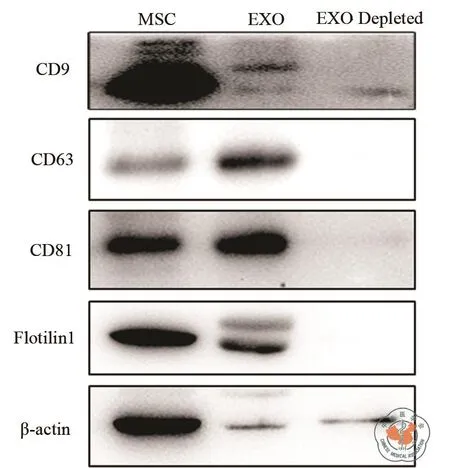
图 2 外泌体标志物Western Blot检测鉴定
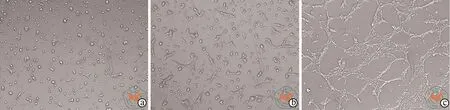
图 3 倒置相差显微镜下观察MSC外泌体促进胰岛内皮细胞MS-1血管形成(×100)
二、MSC外泌体对小鼠胰岛内皮细胞血管形成的影响
体外血管形成试验结果显示,常氧条件下,胰岛内皮细胞MS-1未见明显的血管网形成;低氧条件下,低氧对照组可见少量网状形成;而加入外泌体组可见大量血管网形成(图3)。经Image J分析,常氧组、低氧组、低氧加外泌体组的血管形成相对长度分别为(393.30±174.20,1467.00±230.00,2386.00±137.70)像素。低氧条件下,胰岛内皮细胞MS-1较常氧对照组相比,血管形成能力增加(t=4.874,P= 0.0396),而低氧加外泌体组与常氧对照组和低氧组相比,血管形成能力均提高(t= 12.30,P= 0.0065;t= 15.74,P= 0.0040,表 1)。
三、MSC外泌体上调胰岛内皮细胞VEGF表达
常规PCR结果显示,低氧条件下,MS-1细胞VEGF表达上调,MSC外泌体明显提高低氧条件下MS-1细胞VEGF基因的表达(图4a,表1)。Q-PCR定量结果显示,与常氧对照组(VEGF相对表达量为1.000)相比,低氧组VEGF相对表达量增高(6.52±3.50),差异有统计学意义(t= 4.461,P= 0.0029);低氧加外泌体组VEGF相对表达量为(20.26±9.972),较常氧对照组和低氧组相比VEGF的表达量均明显提高(t= 5.462,P= 0.0009;t= 4.238,P= 0.0038)。Western Blot结果也证实,在蛋白水平,MSC外泌体组VEGF表达也明显增高(图 4b)。
四、MSC外泌体上调HIF1-α和促进mTOR发生磷酸化
在含氧量正常的条件下,HIF1-α被蛋白酶迅速降解;在低氧条件下,HIF1-α可稳定表达。加入MSC外泌体后,HIF1-α表达显著上调。同时还发现,mTOR信号通路在低氧时发生磷酸化,MSC外泌体可显著增强mTOR信号通路的磷酸化。(图5)

表1 Image J血管形成长度分析和VEGF相对表达量

图 4 MSC外泌体上调血管内皮生长因子基因表达

图5 MSC外泌体上调HIF1-α表达和促进mTOR发生磷酸化
讨 论
外泌体是直径30 ~ 100 nm的脂质双分子层包裹有蛋白质和核酸的小囊泡[9],是细胞外膜微囊结构重要组成部分[13]。外泌体可以在培养细胞的上清液中,以及许多类型体液中分离得到。MSC可以释放外泌体,尤其是在低氧环境下MSC能释放出大量的外泌体[14]。本研究中通过低氧条件培养MSC,通过超滤离心法,成功的富集MSC条件培养上清液中的外泌体。经鉴定大小为30 ~ 100 nm,表达CD9,CD63,CD81等外泌体标志物[15]。
MSC来源的外泌体具有多种MSC的生物活性。MSC外泌体具有免疫抑制的作用,可以抑制T 细胞增殖和诱导CD4+CD25+FOXP3+调节性T细胞增殖,增强异体皮肤移植存活[16];可以促进异体移植物存活和诱导供体特异的异体移植物免疫耐受[17]。近年来研究发现,MSC及其来源的外泌体可以介导调节血管生成[18-19]。MSC来源的外泌体含有丰富的促血管生成作用的效应分子,如血小板衍生生长因子,表皮细胞生长因子,成纤维细胞生长因子等,可通过激活NFκB信号通路调节血管生成[20]。一些研究者也在肾缺血再灌注和心肌损伤修复中证实了MSC膜微囊具有促进血管再生的作用[21-22]。本研究证实了MSC外泌体在低氧条件下,能够促进胰岛内皮细胞MS-1分化形成血管。进一步研究发现,MSC外泌体能够上调MS-1细胞HIF1-α和VEGF的表达水平,并激活mTOR信号通路。
HIF1-α可调节多种血管生成因子的表达如促红细胞生成素,表皮细胞生长因子,基质金属蛋白酶和血管生成素2等。在含氧量正常的条件下,HIF1-α被蛋白酶迅速降解;而在低氧条件下,可通过限制脯氨酰羟化酶的活性从而抑制HIF的羟基化,稳定HIF1-α的表达[23]。VEGF是在内皮细胞中分离和鉴定出来的特异性有丝分裂原,具有诱发血管再生的能力。在血管再生过程中发挥重要作用。它可以刺激血管内皮细胞增殖和迁移,增加血管的通透性[24]。VEGF与VEGFR结合后,可以通过激活PLCr-mTORC1信号通路,调节ATF6和PERK表达,促进内皮细胞存活和血管生成[25]。
本研究结果表明,在体外细胞实验中,MSC外泌体可促进低氧条件下的小鼠胰岛内皮细胞血管生成。MSC外泌体有可能通过上调HIF1-α,调节VEGF表达,激活mTOR信号通路,促进胰岛内皮细胞血管生成。
