α-乳白蛋白的功能特性及其在婴儿配方乳粉中的应用
2019-01-23陈文亮苏米亚贾宏信齐晓彦
陈文亮,苏米亚,贾宏信,齐晓彦
(光明乳业股份有限公司,乳业生物技术国家重点实验室,上海 200436)
α-乳白蛋白是乳清蛋白中的一种,主要存在于哺乳动物的乳汁中,在牛乳中占总蛋白质的2%~3%,在母乳中占总蛋白质的20%~25%[1],是母乳中一种非常重要的营养物质,对婴儿的生长发育极为重要。母乳是婴儿天然的理想食品,0~6 个月婴儿应采用纯母乳喂养。在母乳不足或无母乳时可食用婴儿配方乳粉,以满足婴儿生长发育所需的能量和营养需求。不当的喂养方式将会导致婴儿营养不良和发育障碍,合理的膳食能够预防营养不良和早期发育迟滞[2]。近年来的许多研究发现,α-乳白蛋白具有极高的营养价值和多种多样的生物学功能。将α-乳白蛋白有效、合理地应用于婴儿配方乳粉中,可以模拟母乳的蛋白质组成,更好地满足婴儿对蛋白质的需求。本文论述了α-乳白蛋白的结构特点、α-乳白蛋白的各种功能特性及其在婴幼儿配方乳粉中的应用,为婴儿配方乳粉研究提供参考。
1 α-乳白蛋白的结构
1.1 α-乳白蛋白的氨基酸组成
α-乳白蛋白是一种结构紧密的钙结合球蛋白,分子质量约为14 200 Da,等电点在4.0~5.0之间[3]。大多数哺乳动物乳中的α-乳白蛋白都是由123 个氨基酸残基和4 个二硫键组成的单链氨基酸,其中包括人、牛、猪、羊等,只有少数例外,例如,兔α-乳白蛋白只有122 个氨基酸残基,小鼠α-乳白蛋白有144 个氨基酸残基。
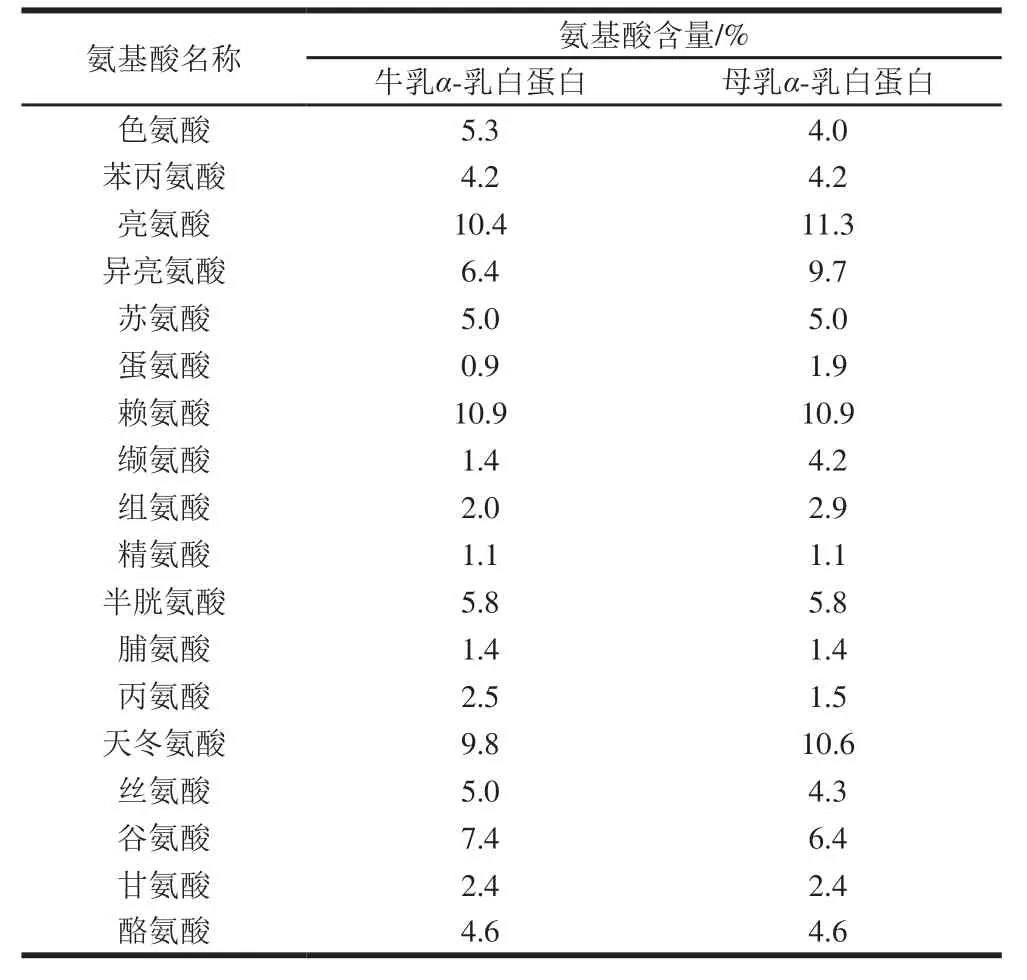
表 1 牛乳与母乳α-乳白蛋白的氨基酸组成Table 1 Amino acid composition of α-LA in in cow’s milk and breast milk
α-乳白蛋白富含人体必需氨基酸[4]。由表1可知,牛乳与母乳α-乳白蛋白的氨基酸组成中,苯丙氨酸、苏氨酸、赖氨酸、精氨酸、半胱氨酸、脯氨酸、甘氨酸及酪氨酸8 种氨基酸的含量相同,而异亮氨酸、蛋氨酸、缬氨酸及丙氨酸4 种氨基酸的含量差异较大。
不同哺乳动物α-乳白蛋白的氨基酸序列差异随物种亲缘性降低而增加,例如,牛乳α-乳白蛋白与羊乳α-乳白蛋白有94%一致性,牛乳α-乳白蛋白与母乳α-乳白蛋白的氨基酸序列有76%一致性(相同序列),还有6%的序列是相似的。因此,牛乳α-乳白蛋白与母乳α-乳白蛋白的组成非常接近。牛乳与母乳α-乳白蛋白的氨基酸序列对比如图1所示。
Acharya[6]、Qasba[7]等研究发现,对α-乳白蛋白基因序列进行比较,显示出其与溶菌酶具有高度相似性,特别是与Ca2+结合后的C-溶菌酶。因此,α-乳白蛋白很有可能是由C-溶菌酶发生基因突变而进化形成的。溶菌酶是抗菌酶,能够使细胞壁不溶性黏多糖分解成可溶性糖肽,导致细胞壁破裂而使细菌溶解,但α-乳白蛋白的溶菌酶活性却很低,仅为鸡卵清溶菌酶活性的10-6[8]。因此,溶菌酶与α-乳白蛋白功能性的高度差异与二者的氨基酸序列高度相似性形成明显反差。
1.2 α-乳白蛋白的立体结构
蛋白质的生物活性不仅与其分子组成有关,还与其分子结构和分子内迁移率有关。蛋白质的三维立体结构可以提供准确的立体化学信息,并阐述其功能及机理。蛋白质能够通过与底物、配体结合,或者与其他蛋白质相互作用改变其结构。蛋白质结构本身也不是一成不变的,呈现出较大的结构流动性,并已在α-乳白蛋白的X射线结构中得到验证[9]。
α-乳白蛋白的三维结构也与溶菌酶很相似[8]。天然状态的α-乳白蛋白结构主要依靠4 个二硫键和1 个Ca2+来维持,其整个三维结构可以分为2 个结构域:其中一个结构域富含α-螺旋,是不连续的,由N端和C端的部分氨基酸片段构成,2 个二硫键将其连接在一起;另一个结构域中β-折叠含量较高,含有2 个β-折叠、1 个短的α-螺旋、1 个Ca2+结合位点以及一些连续的环形区域,该结构域有2 个连续的二硫键。Kraulis[10]研究发现,母乳α-乳白蛋白分子含有5 个螺旋区域,分别是氨基酸残基4~16、22~33、76~80、85~98和100~104。N端附近的螺旋在氨基酸残基12处弯曲,并使氨基酸残基12~16处的螺旋扭曲变形。氨基酸残基1~3和36~38分别形成短的β-折叠结构。3 个β股(β-strand)残基区域(40~43、47~51和54~58)形成片状结构。母乳α-乳白蛋白分子存在3 种类型的转向结构:Ⅰ型为氨基酸残基51~54、66~69和71~74;Ⅱ型为氨基酸残基15~18和17~20;Ⅲ型为氨基酸残基18~21、34~37和105~108。Ca2+被束缚在环形区域内,这个环形区域连接着2 个氨基酸残基螺旋(76~80和85~98)(图2)。
母乳中α-乳白蛋白的低温形态是一种含2 个H2O的结晶结构[11]。Lys79和Asp84上的2 个肽氧原子、Asp82、Asp87和Asp88上的3 个羧基氧原子和2 个水分子与Ca2+结合,形成五角双锥结构(图3),2 个肽基氧原子位于双锥结构的顶端。Ca2+与α-乳白蛋白的高亲和力结合有利于蛋白质天然结构的稳定,并且这种结合是蛋白质从还原变性状态有效地生成具有正确二硫键的天然蛋白质所必需的。
2 α-乳白蛋白的功能特性
2.1 营养作用
α-乳白蛋白富含人体必需的各种氨基酸,尤其是色氨酸、赖氨酸和半胱氨酸的相对含量较高。色氨酸是普通乳粉的限制性氨基酸,参与调节蛋白质的合成,有促进骨髓T淋巴细胞前体分化为成熟T淋巴细胞的作用,因此色氨酸缺乏会导致体液免疫功能降低。同时色氨酸也是合成神经介质5-羟色胺的前体物质,它能代谢成为褪黑激素。5-羟色胺和褪黑激素能引起许多神经性效应,有调节食欲和情绪的作用。5-羟色胺还有中和肾上腺素及去甲肾上腺素的作用,有促进睡眠、抗抑郁、镇痛、抗高血压等功能,均与其中枢安定效应有关。当色氨酸代谢失调时,可引起神经系统的功能障碍[12]。Markus等[13]研究发现,婴儿的睡眠潜伏期也与色氨酸有关,增加色氨酸的摄入后,婴儿的安静睡眠期和睡眠潜伏期的时间都得到明显改善。
赖氨酸是谷类食物的限制性氨基酸,不能在人体内合成,需从食物中补充。赖氨酸不仅参与机体蛋白质的合成,而且还是肉碱合成的前体物质,参与脂肪在体内的β-氧化过程。赖氨酸摄入不足时,会使体内蛋白质合成不足、甘油三酯在内脏器官沉积过多,从而导致生长发育迟缓、免疫力下降、脂肪肝等健康问题[14]。半胱氨酸是谷胱甘肽的组成成分,而谷胱甘肽则是新生儿机体抗氧化系统的重要部分,具有抗炎症作用。新生婴儿不能合成足够量的半胱氨酸,虽然可以从蛋氨酸中产生半胱氨酸,但同时会产生对中枢神经有害的胱氨酸。半胱氨酸还是合成牛磺酸的前体物质,在婴幼儿神经系统的生长发育过程中起重要作用。当婴儿能够获得充足的α-乳白蛋白时,就可以保证足够的半胱氨酸摄入,同时蛋氨酸的水平又能保持最低[15]。
2.2 调节乳糖合成及乳汁分泌
α-乳白蛋白是一种调节乳糖合成的蛋白质,存在于几乎所有哺乳动物的乳汁中[7]。在泌乳过程中,乳糖的合成涉及乳糖合成酶系的活性。β-1,4-半乳糖基转移酶虽然能单独催化乳糖合成,但是效力极差,这是由于其结合葡萄糖的能力很弱。α-乳白蛋白可以增加β-1,4-半乳糖基转移酶结合葡萄糖的特异性及亲和力,α-乳白蛋白与β-1,4-半乳糖基转移酶结合后形成酶复合体,α-乳白蛋白形成酶复合体的调节亚基异质二聚体,而β-1,4-半乳糖基转移酶则形成催化组分。在乳腺细胞内,酶复合体使乳糖合成酶将半乳糖从尿嘧啶核苷二磷酸-半乳糖转移到葡萄糖,从而产生乳糖。同时,母体血液循环中的体液在乳糖形成后的渗透压作用下得以进入乳腺,从而形成乳汁中的含水组分。乳糖合成过程完成之后,α-乳白蛋白将从酶复合体中游离出来,进入乳汁,成为乳汁中的一种生物活性蛋白成分。
2.3 金属离子结合作用
α-乳白蛋白是唯一能与Ca2+结合的乳清蛋白成分,是一种钙载体,但母乳中只有非常少量的Ca2+是与α-乳白蛋白结合的,α-乳白蛋白可能通过产生多肽促进二价阳离子的吸收[16]。与Ca2+结合对α-乳白蛋白的稳定性和结构具有非常大的影响,能够改变α-乳白蛋白的构象、抗体结合能力以及消化特性等[17],结合了Ca2+的α-乳白蛋白热变性温度升高。可以通过螯合剂长时间处理或低pH值条件等方法除去Ca2+,但会破坏α-乳白蛋白的结构并导致其稳定性大幅降低。在低pH值条件下,H+可以和Ca2+竞争,与羧基氧结合,Ca2+被除去后,α-乳白蛋白的结构处于典型的熔球状态,这种熔球构象是介于天然构象与无规则卷曲之间的一种致密的三级结构。因此,α-乳白蛋白是研究蛋白质折叠问题的良好素材[6]。
α-乳白蛋白能与Zn2+结合。Permyakov等[18]以婴幼猴为研究对象,发现α-乳白蛋白能改善锌元素的吸收,α-乳白蛋白的结构中存在几个Zn2+结合位点[19]。α-乳白蛋白结构中的Ca2+结合位点被Zn2+结合后会使α-乳白蛋白结构的稳定性降低。α-乳白蛋白充足时,血液中锌元素的水平与放射性同位素的吸收水平均有所增加。由于锌元素能增强体液及细胞的免疫功能以及吞噬细胞的吞噬能力,当锌元素缺乏时,会使免疫功能受损,易患各种感染性疾病,如腹泻、呼吸道感染、哮喘等[20]。因此,α-乳白蛋白也与锌元素相关的免疫调节功能有关。
除了能与Ca2+和Zn2+结合外,α-乳白蛋白还可以结合一些其他的金属阳离子,例如Mg2+、Mn2+、Cu2+、Hg2+、Pb2+、Na+及K+等[21-23],其中Mn2+与α-乳白蛋白的结合在调控乳糖合成的过程中起到重要作用。上述金属离子与α-乳白蛋白的结合能力不如Ca2+,它们的结合位点虽然与Ca2+结合位点不一致,但也与Ca2+存在一定的竞争关系。大多数金属离子与α-乳白蛋白结合后,其稳定性提高。但是结合了Ca2+的α-乳白蛋白如果再与Zn2+结合,则会导致蛋白质的积聚及对蛋白水解酶敏感性的增加,使其稳定性降低,而在高浓度Zn2+条件下,结合了Ca2+的α-乳白蛋白在室温时就会发生变性[24]。α-乳白蛋白与金属离子结合后,与膜、蛋白质、多肽以及低分子质量底物和产物的相互作用会产生一些新的功能特性,并且受到金属离子结合的调控[19]。
2.4 抗菌、抗肿瘤及益生元作用
多项研究表明,α-乳白蛋白在一些特定条件下具有杀菌、抗菌以及调节肠道菌群的益生元作用等活性。Cawthern等[25]的研究证明,天然状态的α-乳白蛋白在C18:1脂肪酸存在的条件下具有杀菌活性。Pelligrini等[26]研究发现,α-乳白蛋白在经过胰蛋白酶和糜蛋白酶水解后,产生3 种具有杀菌特性的多肽片段,并且它们属于广谱杀菌剂,对绝大多数革兰氏阳性菌起作用。Hakansson等[27]研究发现,α-乳白蛋白的一种异构体对肺炎链球菌具有杀菌作用。这些研究表明,α-乳白蛋白具有一定的抗菌作用。
Swenson等[28]研究发现,α-乳白蛋白的一些折叠异构体不仅具有杀菌活性,而且还有诱导肿瘤细胞凋亡的作用。α-乳白蛋白在参与诱导细胞凋亡的过程中,会形成一种由α-乳白蛋白和油酸组成的复合体结构HAMLET(humanα-lactalbumin made lethal to tumor cells)[29]。HAMLET对正常的健康细胞没有杀伤作用,但可以通过类似凋亡的机制杀死肿瘤细胞。HAMLET与肿瘤细胞表面结合后陷入细胞质中,并穿过细胞质到达细胞核,引起染色体断裂及DNA片段化,并最终导致肿瘤细胞死亡[30]。在这个过程中,油酸参与其中并起到重要作用。目前,α-乳白蛋白在抗癌方面的研究已经成为关注焦点。
Brück等[31]以6 周的健康足月婴儿为对象,研究添加α-乳白蛋白的配方乳粉、标准配方乳粉及母乳对肠道菌群的影响差异。结果表明,富含α-乳白蛋白的婴儿配方乳粉与母乳喂养类似,均对婴儿的肠道双歧杆菌具有增殖作用,因此α-乳白蛋白发挥了类似双歧杆菌益生元的作用。
3 α-乳白蛋白在婴儿配方乳粉中的应用
母乳是婴儿配方乳粉进行配方设计时的唯一标准,这是医学界和营养界的广泛共识,不同国家的婴儿配方乳粉会按照当地母乳的营养结构为基础进行研发。蛋白质的母乳化是婴儿配方乳粉模拟母乳研究的重要组成部分。α-乳白蛋白作为母乳蛋白质中的重要组分,在婴儿配方乳粉的蛋白质母乳化方面发挥着重要作用。提高婴儿配方乳粉中的α-乳白蛋白比例可以使其蛋白质组成及氨基酸比例均接近母乳水平。
多项研究表明,富含α-乳白蛋白的婴儿配方乳粉提高了蛋白质的利用率,减少了婴儿胃肠道不适的发生率,可以有效降低婴儿的肾脏负担。Jean-Christophe等[32]进行高α-乳白蛋白、低总蛋白含量的婴儿配方乳粉(α-乳白蛋白含量3.0 g/L、总蛋白含量14.0 g/L)喂养实验,结果表明,喂养6 个月时,高α-乳白蛋白、低总蛋白含量配方乳粉实验组与对照组(α-乳白蛋白含量0.0 g/L、总蛋白含量15.0 g/L)喂养婴儿的体格发育指标无差异,且与对照组相比,实验组喂养婴儿出现哭泣、烦躁的情况较少,安静时间更长。Davis等[33]进行了类似的喂养实验,对照组喂养标准配方乳粉(α-乳白蛋白含量1.3 g/L、总蛋白含量15.0 g/L),在初始阶段至实验结束时的整个阶段里,对照组喂养婴儿的胃肠道不适发生率均较高,而与对照组喂养相比,实验组配方乳粉(α-乳白蛋白含量2.2 g/L、总蛋白含量14.0 g/L)喂养婴儿的胃肠道不适发生率较低,且更接近母乳喂养组。Trabulsi等[34]也进行了一项高α-乳白蛋白、低总蛋白含量的婴儿配方乳粉临床喂养实验,结果表明,接受高α-乳白蛋白、低总蛋白含量配方乳粉喂养后,婴儿的血清色氨酸水平不低于母乳喂养婴儿。Lien等[35]进行了一项以134 名初生、人工喂养婴儿为实验对象的随机对照临床研究,结果表明,高α-乳白蛋白、低总蛋白含量的婴儿配方乳粉(α-乳白蛋白含量2.2 g/L、总蛋白含量14.0 g/L)喂养婴儿的血尿素氮和血肌酐指标均低于标准配方(α-乳白蛋白含量0.0 g/L、总蛋白含量15.0 g/L)组喂养婴儿。血尿素氮和血肌酐指标反映了肾脏的负担大小。婴儿的肾脏器官发育还不成熟,蛋白质分解代谢能力还较低,因此超量的蛋白质会增加婴儿的肾脏负担。
上述研究结果说明,通过提高α-乳白蛋白的含量可以将传统婴儿配方乳粉中的总蛋白含量降低,改善婴儿配方乳粉的胃肠道耐受性,能更好地满足婴儿对蛋白质的需求,喂养效果更接近母乳喂养。这为婴儿配方乳粉的蛋白质母乳化研究提供了方向。国家法规的修订也反映了降低婴儿配方乳粉中的蛋白质含量这一变化,在GB 10765—2010《食品安全国家标准 婴儿配方食品》[36]中,蛋白质指标范围为0.45~0.70 g/100 kJ,而在最新发布的《食品安全国家标准 婴儿配方食品(征求意见稿)》中,拟将蛋白质指标范围降低。
目前,婴儿配方乳粉中α-乳白蛋白的母乳化仅将牛乳α-乳白蛋白强化至母乳水平,其结构及功能与母乳α-乳白蛋白还存在差异。同时,α-乳白蛋白在一定的热处理条件下会发生不同程度的热聚合,影响其生物活性[37]。因此。α-乳白蛋白的母乳化还需进一步深入研究。值得注意的是,α-乳白蛋白不能作为婴儿配方乳粉唯一的蛋白质来源,α-乳白蛋白中也有部分氨基酸(如精氨酸)含量较低,在对蛋白质组分进行配方设计时应注意各氨基酸的合理平衡。因此,α-乳白蛋白的母乳化只是婴儿配方乳粉蛋白质母乳化的一个方面,除此之外,还应该同时进行其他蛋白质组分的母乳化。随着人们对母乳中各种蛋白质组分的进一步认识以及乳品加工技术的发展,未来婴儿配方乳粉的蛋白质组成也将更接近母乳,更能够满足婴儿生长发育的需要。
