LAMP在临床微生物检测中的应用及进展
2019-01-19综述杨甦庆审校
郭 绮 综述,杨甦庆 审校
(1.重庆市药品技术审评认证中心,重庆 401120;2.重庆医疗器械质量检验中心,重庆 401147)
环介导等温扩增技术(LAMP)的关键是链置换型合成酶、引物及终点检测方法[1]。与一般的DNA聚合酶不同,链置换型合成酶能催化引物以双链DNA的一条链为模板延伸,合成一条与之互补的链,替换另一条链。为保证核酸扩增的特异度与灵敏度,LAMP的引物至少需设计4条,用于识别DNA模板的6个不同区域。在产物检测方法方面,LAMP主要通过监测颜色变化评价反应。近20年来,研究者们开发出了引物设计软件,发现了新型链置换型合成酶,优化了产物检测方法,还设计出了多重LAMP及逆转录LAMP,每一次技术的突破,均推动了LAMP在临床微生物检测领域的应用。
1 LAMP技术原理及检测方法发展
1.1LAMP扩增原理 LAMP反应开始后内引物上游引物(FIP,由F2和F1c组成)的F2区与靶DNA的F2c区杂交,在链置换DNA聚合酶(Bst)聚合酶作用下,合成1条FIP连接的与靶DNA互补的DNA单链,然后外引物F3与靶DNA的F3c区杂交并延伸,取代FIP连接的互补链。互补DNA单链被置换脱离后F1c和F1区互补配对形成茎环,然后作为内引物下游引物(BIP,由B2和B1c组成)的模板。BIP的B2区与模板DNA的B1c区杂交,合成1条BIP连接的与模板DNA互补的DNA单链,并打开模板DNA 的茎环结构。随后B3与模板DNA B3c区域杂交并延伸,取代BIP连接的互补链。此BIP连接的互补链脱落,分别在两端形成茎环,得到一个哑铃状的DNA链,其过程见图1。这种结构作为LAMP扩增循环阶段的模板,最终得到的产物是具有不同个数茎环结构、不同长度DNA的混合物(靶DNA的交替反向重复序列)。
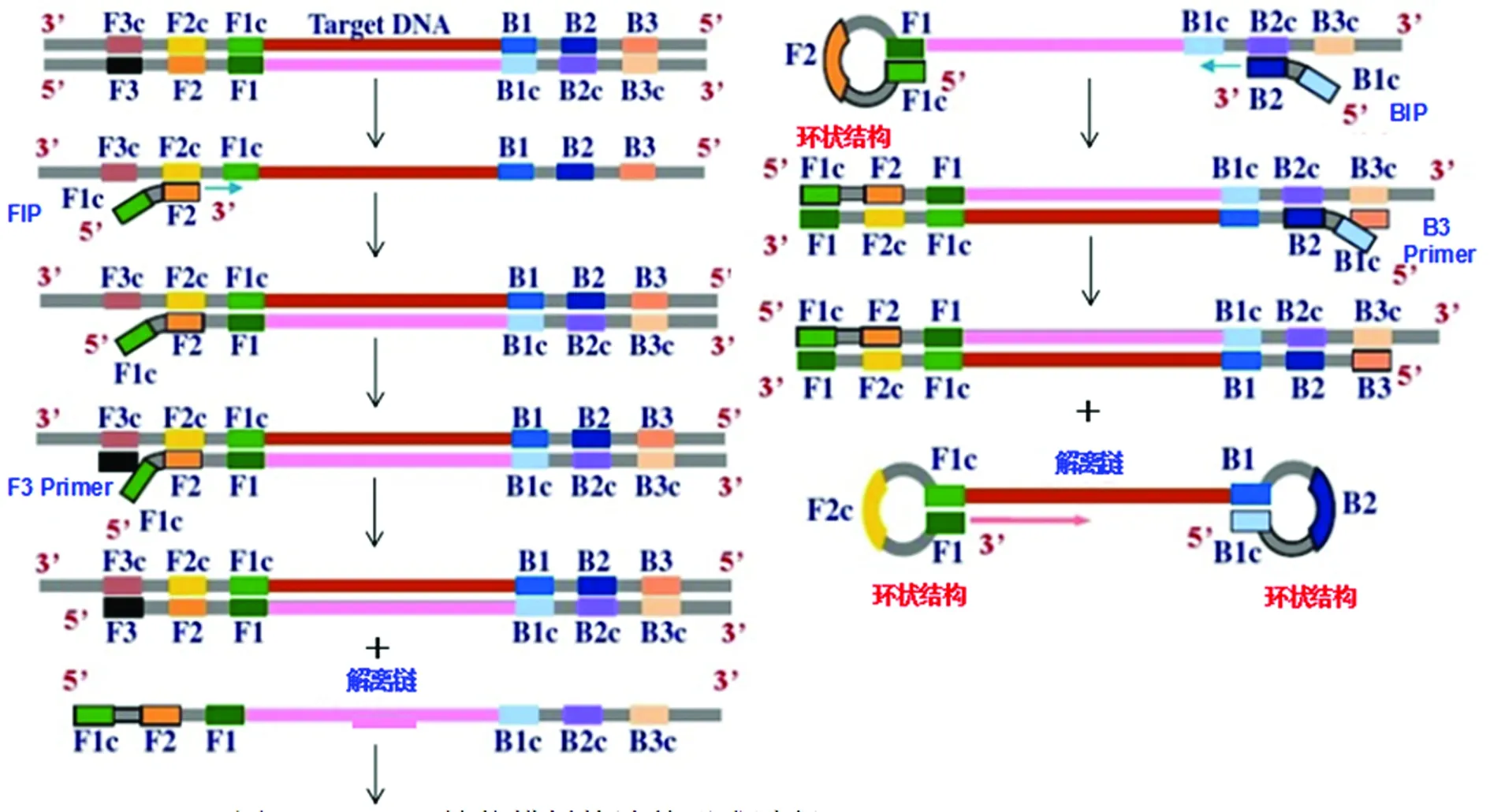
图1 LAMP哑铃状模板构造的形成过程
1.2LAMP的终点检测方法 LAMP应用在临床微生物检测中的一大优势是结果观察方便、简单。LAMP在临床微生物检测中用的终点检测方法有浊度法、琼脂糖凝胶电泳法、显色法及横向流动试纸条法(LFD)、对扩增产物进行探针分析等,各方法具备相应的优缺点,在选取检测方法时要根据实际情况考量。
1.2.1琼脂糖凝胶电泳法 琼脂糖凝胶电泳是LAMP设计初期采用的方法。因为检测过程中需打开反应管,易导致气溶胶溢出,增加携带污染的风险,且琼脂糖凝胶制备过程中用到的荧光染色剂——溴化乙锭是一种对人体有致癌作用的高危险化学物质,因此,其应用受到一定的限制。
1.2.2显色法 用于LAMP显色的染色剂有钙黄绿素、羟基萘酚蓝(HNB)、荧光染料(SYBR Green Ⅰ)等。SYBR Green Ⅰ在恒温孵育前加入,抑制反应,在恒温孵育后加入易引起气溶胶污染[2]。HNB染料可在恒温孵育前加入,但HNB不能发射荧光,仅能用肉眼观察颜色变化。钙黄绿素是最常用的LAMP染色剂,已被用于克氏锥虫、丙型肝炎病毒、人乳头瘤病毒、人冠状病毒[3-4]等病原微生物的检测。其不仅可在恒温孵育前加入,且结果通过紫外线、自然光均能观察到[5-6]。
1.2.3浊度法 浊度法可对反应产物进行定性和定量检测,原理为反应产生的副产物与反应溶液中的Mg2+反应,生成白色沉淀,既可通过目视法检查浑浊,也可通过在特定波长下监测沉淀的生成定量检测扩增产物。目前,市面有实时检测LAMP反应的浊度仪,如LA-200、LA-320和LA-500。采用浊度法检测的临床微生物有肺炎支原体、人乳头瘤病毒及艰难梭菌等[7-8]。
1.2.4LFD LFD由于成本低、使用方便、简单、快速、轻便等优点而成为目前最受青睐的技术之一。只需将待测样本滴加于结合有LAMP缓冲液和生物素的试纸条一端(样品垫)就能进行检测。其原理为利用异硫氰酸荧光素(FITC)标记的DNA探针与生物素标记的LAMP扩增产物杂交后[9]与胶体金标记的抗FITC抗体结合形成复合物,被横向流动试纸条上具有生物素抗体的检测线捕获并显示结果[10]。
1.2.5对扩增产物进行探针分析 纳米金作为光学探针及电化学传感器正广泛用于DNA检测领域[11]。DRAZ等[12]应用纳米金探针对肠炎沙门菌扩增产物进行标记,然后用莱卡显微镜采集表面增强拉曼光谱进行分析。结果显示,该方法的灵敏度(66 CFU/mL)比传统的PCR法提高了100倍,具有较高的特异性,可将其与密切相关的细菌或非特异性污染的DNA区分开来。
2 LAMP在临床微生物检测中应用及进展
2.1LAMP在细菌检测中的应用及进展 LAMP被成功用于检测人体感染的细菌,如结核分枝杆菌、肺炎链球菌、脑膜炎奈瑟菌、铜绿假单胞菌等,且不断有新的细菌反应体系的构建。某些用传统方法检测有困难的细菌,在建立了特异性LAMP反应体系后可成功检测并快速得到结果。肺炎链球菌的传统诊断方式为染色镜检,但在样品采集和处理过程中肺炎链球菌的自溶酶系统易使其快速死亡,导致检测难以进行。XIA等[13]建立了一个对肺炎链球菌进行实时诊断的LAMP反应体系,利用实时荧光检测装置,对肺炎链球菌ATCC49619的DNA进行检测,结果显示,该反应能在20 min扩增得到结果,荧光峰通常持续10 min,检测限为300 pg/μL,且能有效区分肺炎链球菌和其他15株非肺炎链球菌。在拓宽检测病原菌种类的基础上,LAMP在检测病原菌的技术方面也不断地创新,多重LMAP的应用不仅缩短了病原菌检测时间,且可区分2个甚至多个病原菌。沙门菌和副溶血性弧菌是人类最常感染的食物传播病原体,如能对从疑似病例上采集的样本同时进行这2个病原体的快速检测,对判断食源性感染疾病非常有意义。LIU等[14]建立了一种多重实时循环介导的等温扩增LAMP(mLAMP)方法,该方法结合熔融曲线分析,允许在60 min内根据不同的解链温度(Tm)值对扩增产物进行检测和鉴别。该研究共分析了19株已知的细菌,包括1株副溶血性弧菌参考株(ATCC 17802)和7株沙门菌属。结果显示,副溶血性弧菌的Tm值为83.8℃,7株沙门菌的Tm值为86.5~86.8 ℃,平均(86.61±0.11)℃,对非沙门菌和非副溶血性弧菌株未获得Tm值,未发生扩增,表明mLAMP能特异性检测和区分沙门菌和副溶血性弧菌。LAMP不仅可对细菌进行鉴别,还可解决细菌的分型问题,传统血清学分型易受细菌表面抗原表达量的影响。另外,抗生素的不当使用,导致临床标本中存在抗生素,能培养出的细菌量很少甚至没有。LEE等[15]首次采用LAMP法进行脑膜炎血清群特异性鉴定试验,对31例脑膜炎球菌阳性脑脊液标本进行检测,结果显示,PCR检测的检出限为每反应103~104个基因组拷贝,LAMP分析的检出限为10~100个基因组拷贝,LAMP的灵敏度较PCR提高了约100倍。且在2 h内对31例样本中的29例成功分型,其中A、B、C、X、Y型各5株,W型6株。
2.2LAMP在病毒检测中的应用及进展 病毒检测最常用的方法是逆转录环介导的等温扩增(RT-LAMP),利用逆转录酶从RNA中获得互补DNA,并通过DNA聚合酶进行进一步扩增。RT-LAMP将所有的引物和酶(Bst聚合酶和逆转录酶)在恒温下孵育,可一步完成检测[16],已用于检测各种病毒,如登革热病毒、流感病毒、丙型肝炎病毒、埃博拉病毒和寨卡(ZIKA )病毒等。LAU等[17]研发出一种快速检测登革热病毒2种血清型的单管一步法RT-LAMP检测系统,该方法设计了针对登革热病毒的每一种血清型的LAMP引物集,并将引物集及其他反应需要物质加入到一个LAMP反应管中,加入样本反应30 min后就能检测出登革热病毒。研究样本为登革热感染者血清,反应过程通过环介导实时浊度仪LA-320监测。结果显示,该方法的检测限低至10个目的RNA拷贝,在189个样本中检出115个阳性样本,检出率较实时荧光定量聚合酶链式反应(qRT-PCR)高15%,且与样本中登革热病毒特别相似的虫酶病毒无交叉反应。此种单管一步法PR-LAMP虽然不能区分登革热病毒的血清型,但可迅速判断登革热病毒感染与否,具有临床实用性。目前,RT-LAMP最成功的应用之一是诊断人类免疫缺陷病毒(HIV)逆转录病毒。HIV病毒载量的检测受到规模、成本和复杂操作的限制,开发一个能使病毒载量更易获得的技术非常迫切。DAMHORST等[18]利用微流控芯片和硅微芯片平台,对经最小处理的HIV全血样品进行RT-LAMP,并在移动智能设备上进行荧光测量,结果显示,RT-LAMP能检测到微量全血样品中的HIV量,且满足低成本、便携性和易用性的实际要求,具有用于检测其他病毒的潜力,让病毒载样量的检测可在患者家中及临床实验室中用手指血进行。新型OmniAmp DNA聚合酶(POL)的发现是RT-PCR的一次重要革新,其替代了DNA聚合酶(Bst)和逆转录酶,实现靶RNA的单酶检测,让RT-PCR在病毒方面的检测前景更加广阔[19]。与传统DNA聚合酶(Bst)和逆转录酶比较,该酶受全血成分的抑制作用较小,对稀释的低病毒血症样品的检测速度更快,具有更高的耐热性和较好的干燥条件,可延长常温下的储存时间,更适于侧流装置和冻干LAMP反应管的研制。其利用POL对6种RNA病毒进行了RT-LAMP检测,在30 min内扩增出了所有靶标,不需额外步骤,也不改变用于DNA靶标的反应设计。POL较传统RT-LAMP聚合酶更具有优势,更适于恶劣环境下的病毒诊断,为LAMP的便携化发展奠定了基础。
2.3LAMP在寄生虫检测中的应用及进展 寄生虫是世界主要的死亡原因之一。LAMP在寄生虫检测中的应用为寄生虫临床样本的现场检测和在寄生虫感染早期的及时检测提供了有效手段。ZHANG等[20]采用LAMP法对30例恶性疟原虫临床标本进行了检测,结果显示,LAMP检测阳性率可高达90%,检测限低至每微升5个寄生虫,且对间日疟原虫、约氏疟原虫和弓形虫的基因组DNA的检测结果呈阴性,具有较强的抗干扰能力。POOLE等[21]以RF4基因为目标,研制了一种高灵敏度的LAMP检测方法,结果显示,RF4特异度LAMP能在30 min内检测到1条微丝蚴(100 pg)。NZELU等[22]采用LAMP检测了利什曼原虫,对122份疑似临床样本进行了测试。结果显示,LAMP能有效检测到101个DNA拷贝,灵敏度至少是常规PCR的100倍。这对利什曼原虫感染早期,其密度很低时的检测是非常有意义的。有研究利用mLAMP与斑点酶联免疫吸附试验(dot-ELISA)相结合,进行猪肉绦虫、牛肉绦虫和亚洲带绦虫的鉴别,以细胞色素C氧化酶亚基1基因为靶标,分别采用FITC、地高辛(DIG)和四甲基罗丹明(TAMRA)标记FIP引物和生物素标记BIP引物进行单管mLAMP反应。每个物种的mLAMP产物通过dot-ELISA针对FITC、DIG或TAMRA的特异性抗体进行区分。如果用传统的方法鉴别,一个样品需3个反应混合物,既耗时又复杂,并增加了交叉污染的风险。mLAMP法与dot-ELISA相结合,可使人带绦虫的鉴定更加简单、实用[23]。
3 LAMP的优缺点分析
LAMP作为临床微生物检测手段具有快速、适合推广、特异性强等优点。LAMP最显著的优点是其快速性,由于LAMP不需传统PCR中DNA模板的初始热变性过程,所以,较传统PCR减少了约2/3的反应时间,可实现立即诊断。LAMP的另一个优点是推广性强,与其他扩增反应比较,只需简单水浴或金属浴等提供恒温条件,且结果评价可进行肉眼观察。有研究者结合缓冲液中Bst DNA聚合酶的特点,研制出了一种用于LAMP的pH敏感染料。pH敏感染料根据LAMP扩增过程中pH从碱性到酸性的变化监测LAMP反应,易于观察,进一步提高了LAMP结果观察的便利性[24]。LAMP的检测特异性强,不受与靶DNA相似度高的非靶DNA及PCR抑制剂的影响,如血液的检测可在不需要模板提取步骤和未经处理样本的情况下进行[25]。
尽管LAMP具有很多优势,但仍有一些限制因素阻碍其顺利应用。由于LAMP扩增后得到的产物是1条大的DNA链,不适于除鉴定外的其他分子生物学目的,通用性较PCR低。为提高扩增灵敏度和特异性,引物的设计较复杂且受到限制。尽管目前已有免费的引物设计软件,但为保证选择到优选目标位点,仍需人工参与引物设计。另外,多个引物的使用将增加引物之间的杂交概率,产生假阳性结果[26]。
LAMP的反应产物非常稳定,不易降解[6],易形成气溶胶污染,且LAMP灵敏度高,即使极少量的阳性产物污染也会对结果产生影响,这就对操作过程提出了较高的要求[2]。
4 展 望
随着造成感染性疾病的微生物种类日益复杂和耐药菌甚至多重耐药菌的剧增,微生物鉴定变得越来越困难,因此,需不断更新诊断方法。在种类繁多的基因扩增技术中,LAMP以其快速、灵敏、特异度高等优点促使研究人员不断探索其在临床微生物检测中的应用。到目前为止,已开发了冻干形式的LAMP试剂和商业化用于微生物特异性检测的LAMP试剂盒,但离便携式LAMP产品的商业化还有一段距离。由于LAMP易于适应任何现场环境,且具有实时检测所需的所有特性,相信随着便携式LAMP产品的进一步发展,LAMP在临床微生物检测领域的应用范围会更加广泛,为基层医疗及恶劣环境下的病原微生物检测提供了有价值的工具。
